甘草酸二铵治疗药物性肝损害的系统评价
2010-05-22李全志段京莉北京大学第三医院药剂科北京市100191北京大学药学院药事管理与临床药学系北京市100191
李全志,段京莉(1.北京大学第三医院药剂科,北京市 100191;2.北京大学药学院药事管理与临床药学系,北京市 100191)
药物性肝损害(DILI)是指应用治疗剂量的药物时肝脏受药物毒性损害或发生过敏反应所引起的疾病。在美国,药物特异质反应引起的DILI占急性肝衰竭的18%,在发展中国家也属于临床常见病[1]。多数患者临床用药复杂,加上DILI的诊断缺乏特异性指标,也没有特异性治疗方法。临床上最常见的处理方法是及时停用可能造成肝损害的药物,但是有些慢性疾病如结核病,要求不能停用造成肝损害的药物,这时就需要使用保肝药来保护受损的肝脏,帮助恢复肝功能。临床使用的保肝药种类较多,效果参差不齐,其中甘草酸二铵(商品名:甘利欣)是目前临床最常用的保肝、抗炎药物之一,多年临床应用发现其有较强的抗炎、免疫调节、保护肝细胞膜、改善胆红素代谢、抗肝纤维化等作用,有关甘草酸二铵有效率的临床研究不少,但大样本的系统分析尚未见报道。应用系统评价荟萃多项小样本、不同研究结论的资料,定量分析各研究结果数据,可提高研究结论的可信性。为了更加客观地评价甘草酸二铵治疗DILI的作用,现对甘草酸二铵临床随机对照试验(RCT)资料进行系统评价。
1 资料与方法
1.1 文献检索
通过计算机检索中国生物医学文献数据库(CBMdisc)光盘、中国期刊网数据库(CNKI)、EMBASE、PubMed,主题词检索“DILI”、“药物性肝炎”、“肝功能损害”、“药物性肝损伤”、“药物性肝病”、“glycyrrhizic diammonium”“ganlixin”、“drug induced liver injury”,结果中再检索“甘草酸二铵/甘利欣”、“随机、对照研究”,检索年限为1994~2009年。
1.2 纳入标准
(1)1994~2009年公开发表的文献;(2)研究对象为在治疗过程中发生药物相关的肝功能损害的患者,无基础疾病限制,药物性肝损害的诊断根据用药史、临床表现、肝功能检查,除外病毒性肝炎及其他原因所致的黄疸和肝功能异常;(3)研究内容为比较甘草酸二铵与其它护肝药物(包括西药和中药)对照治疗DILI的临床RCT,2组在患者年龄、性别、身体状况等方面无显著性差异;(4)治疗时间≥7 d。
1.3 排除标准
(1)缺乏原始资料的综述文献;(2)重复文献;(3)2组除了甘草酸二铵与对照组保肝药不同之外,其它治疗药物仍有不同者。
1.4 疗效指标
终点指标为保肝有效率、肝功能相关指标。
1.5 资料提取及质量评价
采用Jadad评分量表对各独立研究进行质量评价,评分包含4项,即随机序列的产生、随机化隐藏、盲法、失访情况,评分1~3分为低质量研究,4~7分为高质量研究。摘录的内容包括:(1)受试者的特征,如受试者的例数、平均年龄、年龄范围、性别分布;(2)试验设计细节,如分组方法,随机、开放、单盲或双盲,失访者例数等;(3)治疗方式及剂量;(4)研究期限;(5)研究开始及结束时的保肝有效率;(6)肝功能相关指标在治疗前后的变化(7)不良反应(ADR)及例数。
1.6 统计学方法
应用RevMan 5.0对收集的数据进行统计。计量资料采用Inverse Variance方法,计算加权均值(MD)。计数资料时采用Mantel-Haenszel方法,计算效应量(OR),二者均计算95%的可信区间(CI)。资料敏感性分析:使用I2分析统计学异质性。无统计学(P>0.05)异质性研究结果之间的合并分析采用固定效应模型,有统计学(P≤0.05)异质性合并分析采用随机效应模型;比较剔除1项文献前后结论的差异,分析结果的稳定性。采用失效安全系数(fail-safe number,Nfs)分析发表偏倚情况。
2 结果
2.1 纳入研究的基本特征
本文共收集到18篇[2~19]已发表的关于甘草酸二铵治疗DILI的临床RCT的文献,有1644例DILI患者入选,且全部为中文。通过检索EMBASE、PubMed,结果中0篇符合系统评价的纳入标准。所有文献中,只有1篇提到了关于DILI的诊断标准:丙氨酸氨基转移酶(ALT)或结合胆红素(CB)升高至正常值上限2倍以上,或天冬氨酸氨基转移酶(AST)、碱性磷酸酶(AP)和总胆红素(TBIL)同时升高,且其中1项指标高于正常值上限2倍以上[2]。各组在性别、年龄、病程及病变程度上具有可比性。被纳入的RCT研究的基本信息见表1。甘草酸二铵的剂量在 15项研究[2~4,6~7,9~17,19]中为150 mg 静脉滴注或口服,qd;1项研究[8]中为150 mg口服,tid;1项研究[5]为100 mg静脉滴注,bid;1项研究[18]对象为小儿患者,剂量为3 mg·kg-1静脉滴注,qd。疗程均为7~60 d,其中抗结核药所致的DILI研究,由于不能停止使用抗结核药,所以保肝药的使用时间较长,多为1~2个月。
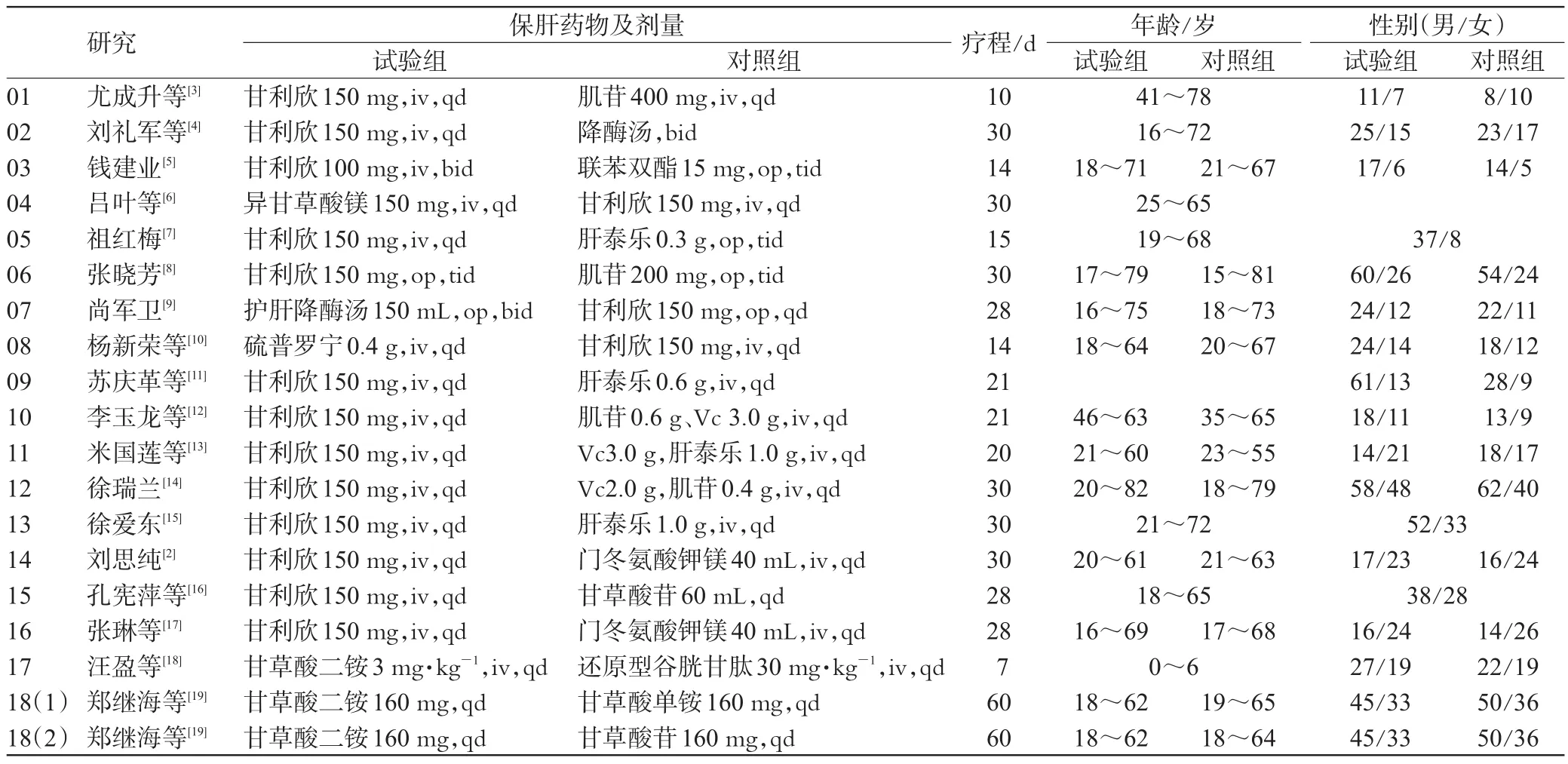
表1 纳入研究的特征Tab 1 The characteristics of included studies
18项研究[2~19]均讨论了甘草酸二铵与对照组的保肝有效率差异,6项研究[3,15~19]18篇文献均比较了治疗有效率,只有6篇[3,15~19]文献同时比较了ALT、AST或TBIL等生化指标。3项研究[16,18,19]讨论了甘草酸二铵与对照组降低AST水平的差异,4项研究[16~19]讨论了甘草酸二铵与对照组降低TBIL水平的差异,4 项研究[5,6,10,19]比较了甘草酸二铵与对照组的 ADR 发生率。
2.2 纳入研究的质量评价
所有纳入研究均未介绍随机方法,随机方案是否隐藏、是否采用盲法均不详,所有试验均无失访。采用满分为7分的Jadad评分标准对纳入研究进行方法学质量评价,得分均为2分,属低质量文献。
2.3 甘草酸二铵治疗组与对照组的治疗有效率比较
在 18篇[2~19]文献中只有 7篇[5,9,10,14,15,18,19]文献提到了有效率判断标准,其他文献的有效率判断指标未知。这7篇的评价指标均为:(1)显效,疗程结束时肝功能恢复正常,临床症状消失,肝脏缩小;(2)有效,疗程结束时临床症状好转,血清ALT、AST、TBIL水平较前下降≥50%或低于正常上限的2倍;(3)无效,疗程结束时临床症状及体征无变化,肝功能指标改善不明显或恶化。异质性检验结果为P<0.05,因此采用随机效应模型。合并治疗效应的分析结果显示,甘草酸二铵组与对照组的差异有统计学意义(OR=2.77,P<0.05),提示甘草酸二铵比其它保肝药更能有效改善药物导致的肝功能损害,详见图1。
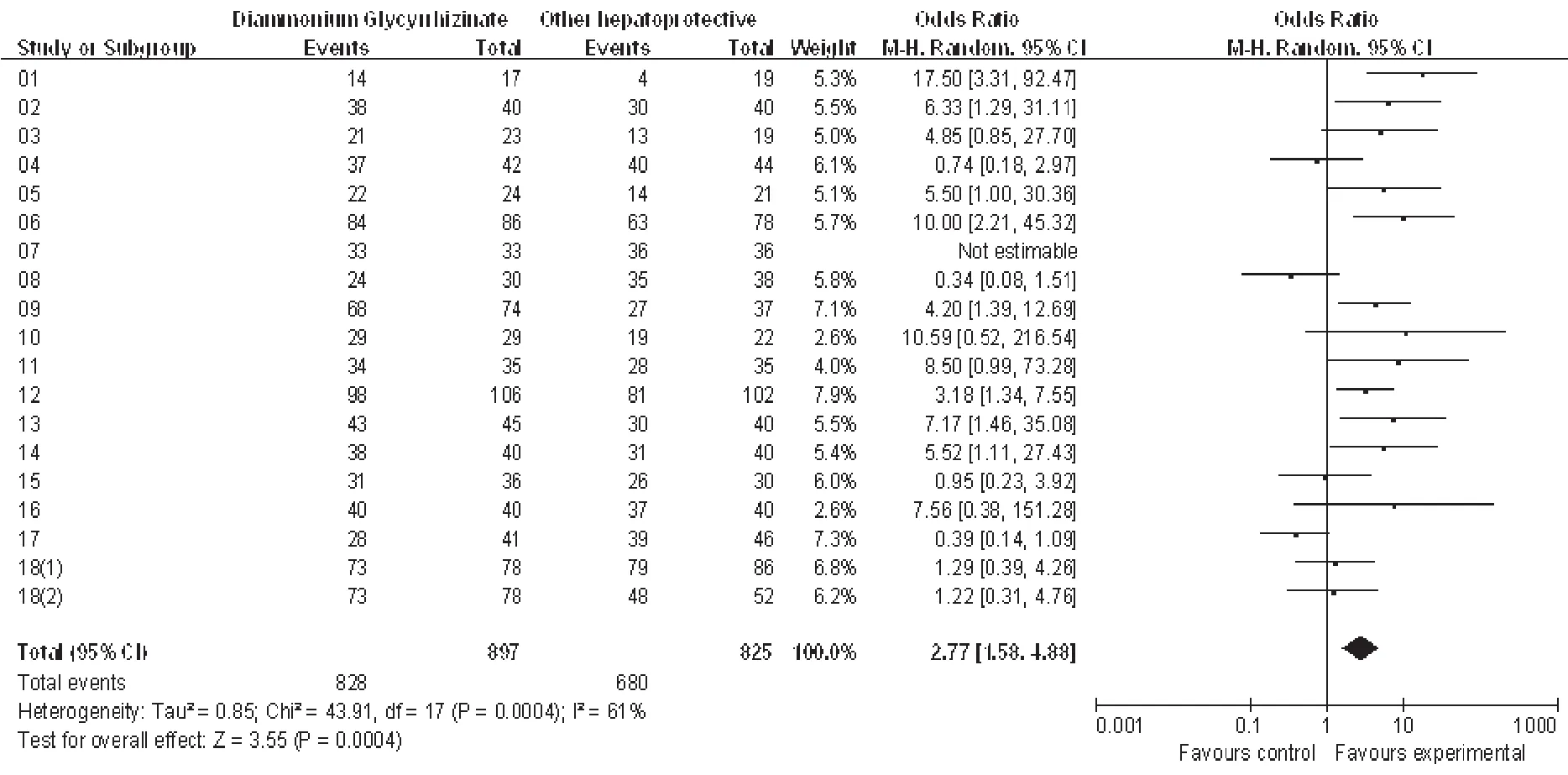
图1 甘草酸二铵与对照组的有效率比较Fig 1 Comparison of effective rate between diammonium Glycyrrhizinate and the control group
2.4 甘草酸二铵治疗组与对照组的肝功能指标比较
2.4.1 数据计算方法。各生化指标的原始数据为μ±σ2,其中μ1、μ2为治疗前后的平均值,σ12、σ22为治疗前后的方差,则治疗前后均数的净变化=μ2- μ1,净变化的方差σ2-12=σ12+σ22-2 r12×[σ12×σ22]1/2(r12=0.5),标准差={σ2-12×n/(n-1)}1/2(n为各组病例数)。
2.4.2 ALT。6项研究[3,15~19]比较了甘草酸二铵组与对照组在降低ALT水平方面的差异,共570例患者。异质性检验结果为P<0.05,因此采用随机效应模型。合并治疗效应的分析结果显示,甘草酸二铵组与对照组的差异无统计学意义(Z=0.58,P=0.56),提示甘草酸二铵与其它保肝药相比在降低ALT方面无明显优势,详见图2。
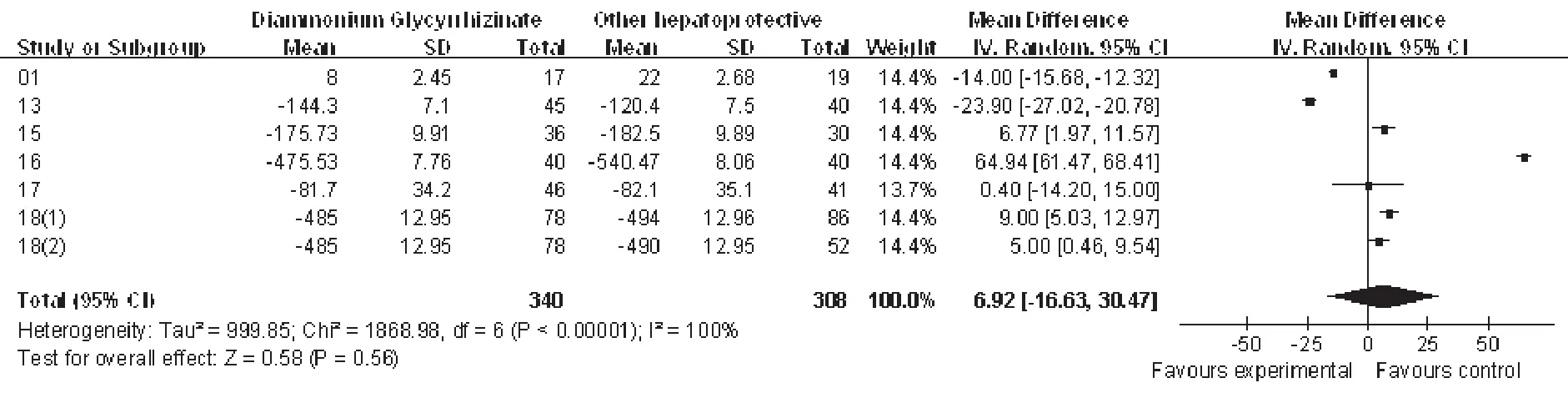
图2 甘草酸二铵与对照组在降低ALT效果方面的比较Fig 2 Comparison diammonium glycyrrhizinate with the control group in reducing the effects ofALT
2.4.3 AST。3 项研究[16,18,19]比较了甘草酸二铵组与对照组在降低AST水平方面的差异,共369例患者。异质性检验结果为P<0.05,因此采用随机效应模型。合并治疗效应的分析结果显示,甘草酸二铵组与对照组的差异无统计学意义(Z=0.89,P=0.37),提示甘草酸二铵与其它保肝药相比在降低AST方面无明显优势,详见图3。
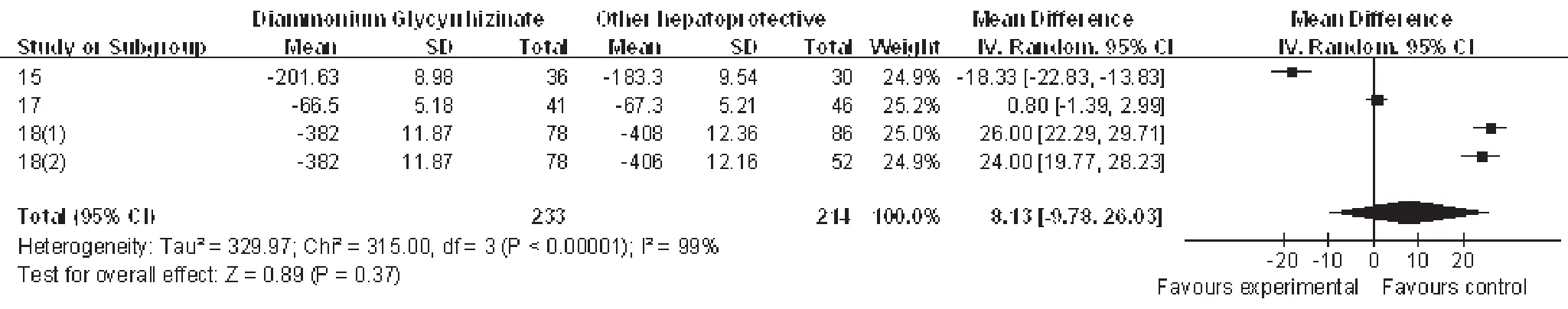
图3 甘草酸二铵与对照组在降低AST效果方面的比较Fig 3 Comparison diammonium glycyrrhizinate with the control group in reducing the effects ofAST
2.4.4 TBIL。4项研究[16~19]比较了甘草酸二铵组与对照组在降低TBIL水平方面的差异,共449例患者。异质性检验结果为P<0.05,因此采用随机效应模型。合并治疗效应的分析结果显示,甘草酸二铵组与对照组的差异无统计学意义(Z=1.20,P=0.23),提示甘草酸二铵与其它保肝药相比在降低TBIL方面无明显优势,详见图4。

图4 甘草酸二铵与对照组在降低TBIL效果方面的比较Fig 4 Comparison diammonium glycyrrhizinate with the control group in reducing the effects of TBIL
2.5 ADR
4 项研究[5,6,10,19]比较了甘草酸二铵组与对照组在 ADR 方面的差异,共412例患者。异质性检验结果为P>0.05,因此采用固定效应模型。合并治疗效应的分析结果显示,甘草酸二铵组与对照组的差异无统计学意义(Z=1.53,P=0.13),提示甘草酸二铵与其它保肝药相比在ADR方面无明显优势,详见图5。
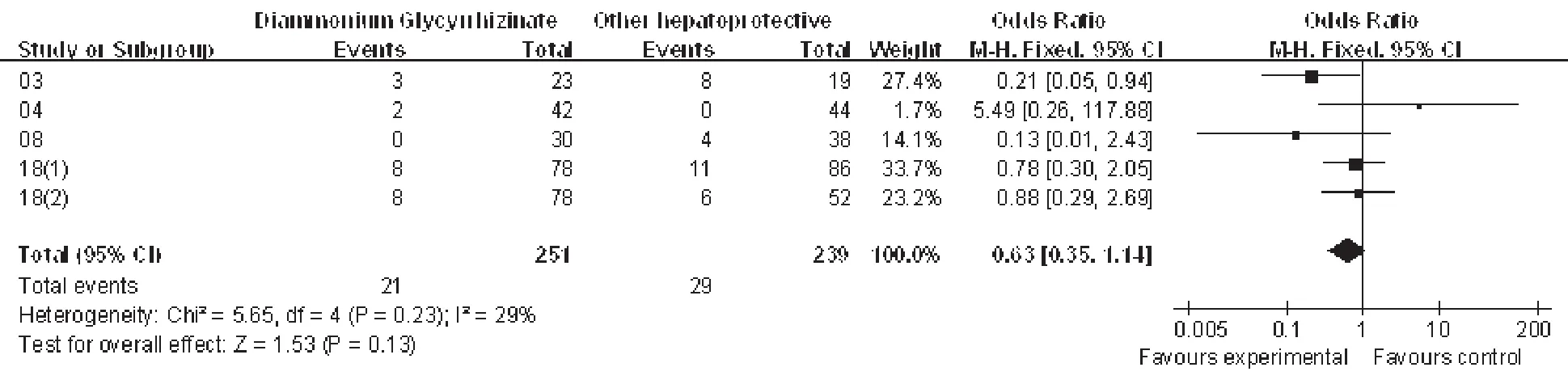
图5 甘草酸二铵与对照组的ADR比较Fig 5 Comparison diammonium glycyrrhizinate with the control group inADR
2.6 敏感性分析
敏感性分析是指在排除结果异常的研究后,重新进行分析的结果并与未排除前的结果进行比较,以探讨该研究对合并效应量的影响程度及结果可靠性。若敏感性分析未从实质上改变结果,说明结果较为可信;若敏感性分析得到不同结论,表明在解释结果和下结论时应非常慎重,提示有潜在的重要因素影响干预措施效果,需明确争议的来源[20]。对保肝有效率和ALT、AST、TBIL降低水平以及ADR做敏感性分析,依次将各试验剔除后计算剩余试验合并后的P值,结果显示各试验去掉以后的P值与去掉之前的P值意义相同,各组的敏感性结果均一致,本研究稳定性好。
2.7 发表偏倚
使用Nfs来评估发表偏倚。失效安全系数的含义是使分析有显著意义的结论逆转需要多少阴性研究个数,按照Rosentha建议的标准,Nfs0.05>5k+1时可认为发表性偏倚得到有效控制。在P=0.05水平,Nfs0.05=(ΣZ/1.64)2-k。式中Z为独立研究的正态离均差;k为纳入的研究个数。通过计算,本研究的失效安全系数为363,>5k+1=91。可见,本次研究结论的可靠性较好,发表偏倚得到了有效控制。
3 讨论
甘草酸二铵是甘草中的活性成分甘草次酸的左旋构型,有较强的抗炎、保护肝细胞膜、改善胆红素代谢、抗肝纤维化等作用,还能诱导干扰素的产生,激活巨噬细胞等功能,在抗病毒、抗肿瘤及免疫调节等方面起重要作用。
3.1 疗效分析
首先,笔者观察单个研究的结果,通过分析发现,研究文献[4,8,15,17,18]的 OR 值<或接近 1,其对照组药物有甘草酸单铵、甘草酸苷、异甘草酸镁、硫普罗宁、还原型谷胱甘肽,说明甘草酸二铵与这些药物相比在保肝疗效方面没有显著性优势。而其他研究的OR值均>3,其对照组药物有肌苷、降酶汤、联苯双酯、肝泰乐、门冬氨酸钾镁,说明甘草酸二铵的保肝疗效明显优于上述传统保肝药。
合并治疗效应后发现,全部18篇[2~19]文献的结果显示甘草酸二铵组与对照组的保肝有效率差异有统计学意义,但是提供生化指标的6篇[3,15~19]文献的结果显示,甘草酸二铵组在降低ALT、AST和TBIL方面的差异并无统计学意义。ALT、AST和TBIL是最直接反映肝功能的生化指标,其变化趋势应该与治疗有效率保持一致。为了找到不一致的原因,笔者对保肝有效率进行亚组分析,并讨论了ALT、AST和TBIL的6组试验分别组成ALT亚组、AST亚组、TBIL亚组,对每个亚组的治疗有效率进行分析,结果见图6、图7、图8。
3个亚组OR值的95%置信区间分别为2.06[0.74,5.74]、0.79[0.43,1.44]、0.91[0.52,1.62],与原来的2.77[1.58,4.88]相差很大,均为P>0.05,说明这6篇文献的有效率比较显示甘草酸二铵组与对照组的保肝有效率差异无统计学意义。
本次评价中共有6篇[3,15~19]文献讨论了ALT、AST和TBIL中的至少1个指标,并通过指标的恢复情况来判断保肝是否有效。其他12篇文献只是单纯记录了治疗有效的人数,并没有明确记录通过何种客观指标来判断治疗有效。亚组分析显示,总体有效率与亚组有效率结论不一致。从图6、图7、图8中可以看出,每个亚组都包含3篇文献[15,17,18],其OR值均在1附近,说明可能是这3篇本身就偏向于“甘草酸二铵的治疗效果没有优势”的文献影响了亚组有效率的最终结果。但是,判断有效率的标准不同也会影响到有效率的最终结果。这提示以后有关DILI的临床RCT应当建立统一的药物治疗有效标准,把生化指标的变化作为治疗效果的直接参考指标。
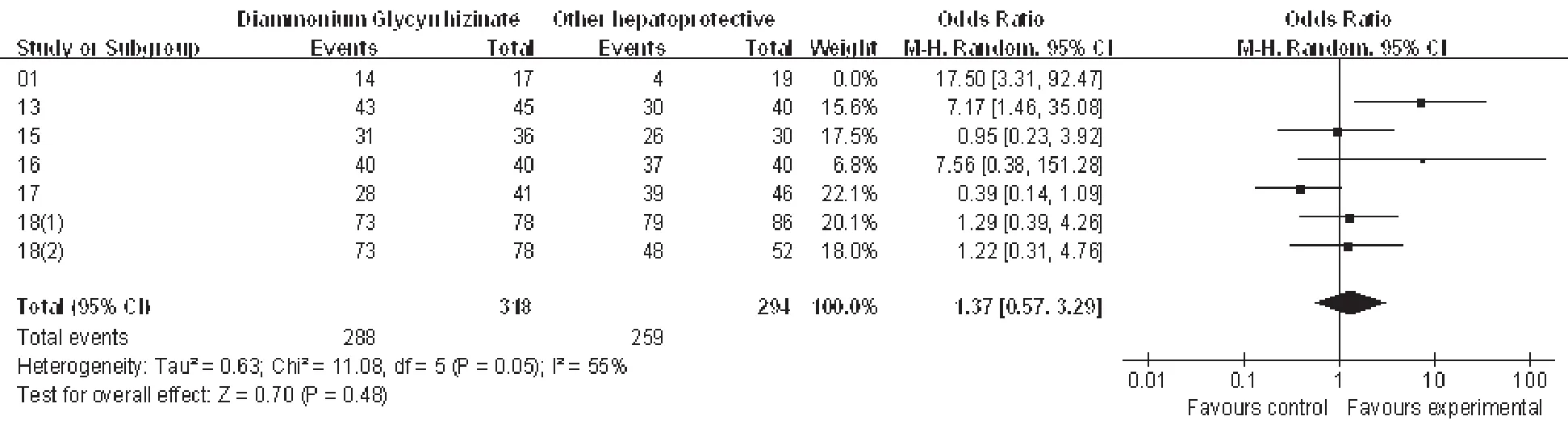
图6 ALT亚组的有效率比较Fig 6 Comparison effective rate ofALT sub-group

图7 AST亚组的有效率比较Fig 7 Comparison effective rate ofAST sub-group
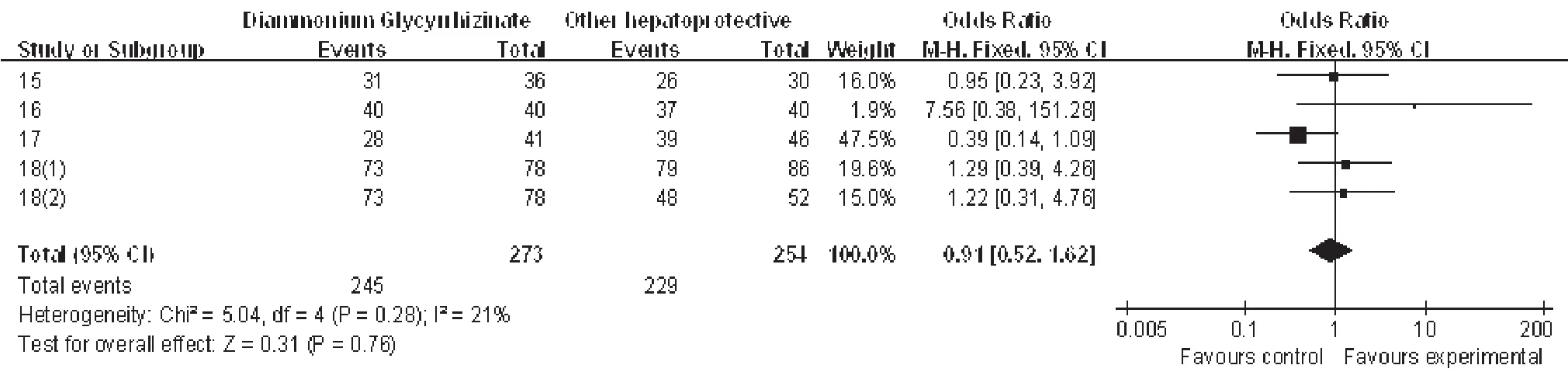
图8 TBIL亚组的有效率比较Fig 8 Comparison effective rate of TBILsub-group
3.2 安全性分析
ADR的分析显示,甘草酸二铵与其它保肝药相比没有统计学意义,在讨论了ADR的5篇文献中,甘草酸二铵治疗组共有315名患者,发生ADR的有26名,ADR发生率为8.3%,主要为恶心、呕吐、腹泻等消化系统反应,无严重ADR。
3.3 异质性分析
本研究分别对甘草酸二铵和对照组保肝药在保肝有效率和降低ALT、AST和TBIL水平以及ADR发生率方面进行系统分析,由于参与每种分析的研究数量不同,所以每次分析之前先比较2组的异质性。结果显示,各种分析中2组均存在异质性,其可能来源于保肝药种类、计量、疗程、研究对象基线状况(包括年龄、性别比例、病程、病情等)及随访时间不完全一致等。
3.4 纳入研究质量分析
本次分析纳入的18篇文献全部为中文文献,质量评分均为2分,纳入研究质量低是影响本系统评价结论的最重要原因:(1)所有研究随机方法不明确,随机分配方案是否隐藏均不详;(2)多数研究未说明DILI的诊断标准,未说明病例排除、脱落及剔除标准;(3)所有研究是否采用盲法不明确;(4)所有试验均未介绍研究者及患者依从性情况;(5)所有研究的样本数均未进行估算。
在查找文献时,发现国外没有关于使用保肝药治疗DILI的文献,进一步搜索关于DILI的文献,发现国外对于DILI的治疗策略是:在使用有引起DILI风险的药物之前,先对发生的可能性进行评估;在治疗期间对ALT进行检测,一旦出现异常就按照DILI的诊断标准进行诊断,确诊后停用引起损害的药物。另外,国外认为DILI是一种过敏反应,症状严重时可以使用激素对症治疗[21]。而关于保肝药的英文文献显示,国外使用的保肝药有甜菜碱、水飞蓟宾、甘草皂苷、维生素E、卵磷脂、乙酰半胱氨酸、激素等,且多用于治疗病毒性肝炎等慢性肝功能损害[22~25]。
通过本次系统评价,笔者发现关于保肝药治疗药物性肝损害的试验主要集中在国内,而这些试验由于设计上的疏忽,文献质量普遍较低,从而降低了系统评价结论的可靠性。要进一步验证甘草酸二铵的疗效及安全性,尚需进行更多设计合理、执行严格、多中心大样本且随访时间足够的RCT。另外,疗效判断方面应当加入实验室生化指标检查等客观标准来加强疗效的说服力。
[1]Lee WM.Assessing causality in drug-induced liver injury[J].J Hepatol,2000,33(6):1003.
[2]刘思纯,马 博.甘草酸二铵治疗急性药物性肝损伤的疗效观察[J].中国处方药,2006,7(10):62.
[3]尤成升,许长春,郭云霞,等.甘利欣对肿瘤化疗过程中药物性肝损害的预防作用[J].中国现代医生,2009,47(13):124.
[4]刘礼军,胡雨梅.中西医结合治疗药物性肝炎80例[J].时珍国医国药,2008,19(8):1866.
[5]钱建业.甘利欣治疗肿瘤化疗所致肝损害的临床观察[J].四川肿瘤防治,2000,13(1):55.
[6]吕 叶,袁 明,林 峰,等.异甘草酸镁治疗药物性肝损害44例效果观察[J].交通医学,2008,22(2):152.
[7]祖红梅.甘利欣治疗抗痨药物性肝损害的疗效观察[J].中国实用医药,2008,3(3):92.
[8]张晓芳.甘利欣胶囊对抗结核药物所致肝损害的预防作用[J].武警医学,2007,18(1):46.
[9]尚军卫.中西医结合治疗抗痨药物性肝损害疗效观察[J].四川中医,2006,24(10):46.
[10]吴永强,李美花.慢性乙型肝炎对干扰素治疗的应答率观察[J].肝脏,2006,11(2):140.
[11]苏庆革,陈素丽.甘利欣治疗药物性肝损害临床疗效观察[J].首都医药,2004,11(24):23.
[12]李玉龙,龚丽霞.甘利欣治疗抗结核药物性肝损害的疗效观察[J].河北医药,2003,25(6):442.
[13]米国莲,许丽丽.甘利欣治疗药物性肝损害35例疗效观察[J].河北医药,2002,24(4):243.
[14]徐瑞兰.甘利欣治疗药物性肝损害的临床观察[J].青岛医药卫生,2001,33(1):11.
[15]徐爱东.甘利欣对抗痨药物引起肝损的治疗作用[J].河北中西医结合杂志,1999,8(4):556.
[16]孔宪萍,葛在吉.复方甘草二胺治疗抗结核药物性肝炎临床观察[J].吉林医学,2007,28(7):903.
[17]张 琳,孟 楠.甘利欣治疗药物性肝炎疗效观察[J].第四军医大学吉林军医学院(现吉林医药学院)学报,2005,26(2):89.
[18]汪 盈,陈丽佳,孙忠敏.还原型谷胱甘肽治疗小儿白血病化疗致肝损害的疗效分析[J].儿科药学杂志,2006,12(5):17.
[19]丁卫民,杨俊行,郑继海.三种复方甘草酸制剂治疗肺结核抗结核化疗过程中肝功能损害对比观察[J].中国药物与临床,2005,5(7):548.
[20]陈直平,沈 毅,吴 雪,等.铅对男性激素分泌影响的Meta分析[J].中国职业医学,2007,34(2):99.
[21]Kaplowitz N.Drug-Induced Liver Injury[J].Clinical Infectious Diseases,2004,38(Suppl 2):44.
[22]Federico A,Trappoliere M,Loguercio C.Treatment of patients with non-alcoholic fatty liver disease:current views and perspectives[J].Dig Liver Dis,2006,38(11):789.
[23]Muriel P,Rivera-Espinoza Y.Beneficial drugs for liver diseases[J].J Appl Toxico,2008,28(2):93.
[24]Vlad Ratziu,Shira Zelber-Sagi.Pharmacologic therapy of non-alcoholic steatohepatitis[J].Clin Liver Dis,2009,13(4):667.
[25]Negi AS,Kumar JK,Luqman S,et al.Recent advances in plant hepatoprotectives:a chemical and biological profile of some important leads[J].Med Res Revs,2008,28(5):746.
