燕窝对ConA刺激下大鼠淋巴细胞增殖的增效作用
2010-05-22冼小敏林洁茹赖小平陈建南
侯 雁,冼小敏,林洁茹,赖小平,陈建南
(广州中医药大学中药学院,广东广州 510405)
燕窝(Ediblebird'snest,EBN)是指雨燕科(Apodidae)若干种金丝燕单独使用唾液分泌物或黏合羽毛、植被所筑的巢窝。据曹炳章的《燕窝考》中记载,燕窝能“养胃液,滋肺阴,生津益血,润燥泽枯,壮阳益气,和中开胃,填精补髓,止咳化痰”,现代多认为燕窝具有免疫促进作用[1]。为此,本文探讨了不同品种燕窝及其伪品对ConA刺激大鼠淋巴细胞转化的增效作用。
1 材料与方法
1.1 实验材料
原燕窝(白燕窝半加工品)、白燕窝、黄燕窝、血燕窝、即食燕窝均由新加坡锦兴公司提供,经本实验室采用分子生物学技术鉴定为爪哇金丝燕产燕窝[2];怀集燕窝来自广东省怀集县,同法鉴定为小白腰雨燕窝;草燕窝产自菲律宾,由新加坡菲利公司提供。市售燕窝经mtDNA序列测定[2]以及SDS-PAGE电泳图谱鉴定为伪品;而燕窝的常见伪品猪皮、明胶则购自传统市场。
1.2 实验动物
SPF 级 SD 大鼠 5只,4~6周龄,雄性,体重(190±10)g,由广东省实验动物中心提供。
1.3 主要试剂
RPMI-1640干粉,广州合达生物有限公司;伴刀豆蛋白A(ConA),Sigma公司产品;胎牛血清,上海微科生化试剂公司;Bradford蛋白定量试剂盒,Tiangen 17803;胃蛋白酶、胰蛋白酶,AMRECO公司。
1.4 主要仪器
Sartorius分析天平 BS110S;Eppendrof台式冷冻离心机5810R;全自动酶联免疫检测仪GENios;恒温水浴锅HH-2,江苏金坛市宏华仪器厂。
1.5 试剂配制
1.5.1 RPMI-1640培养基
10 g RPMI-1640 干粉,0.11 g Na2CO3,5.925 g Hepes,用双蒸水定容至1 000 ml,过滤灭菌,-40℃保存,避免反复冻融。
1.5.2 RPMI-1640完全培养液
在RPMI-1640培养液中加入胎牛血清、青霉素、链霉素和β-巯基乙醇,使其终浓度分别为10%、100 U/ml、5 mM。
1.5.3 2×人工胃液配方
NaCl 4.0 g,胃蛋白酶 6.4 g,浓盐酸 14 ml,双蒸水定容于1 000 ml。 pH 约为 1.2[3]。
1.5.4 2×人工肠液配方
13.6 gKH2PO4溶于250ml双蒸水,振荡完全溶解后加190ml 0.2 mol/LNaOH和400 ml双蒸水。加胰蛋白酶20 g,混匀,用0.2 mol/L NaOH调pH到7.5±0.1,双蒸水定容置1 000 ml[3]。
1.6 方法
1.6.1 大鼠肠系膜淋巴结细胞悬液制备
取大鼠1只,用无菌剪刀和镊子取其肠系膜淋巴结,用磨棒小心研磨过120目筛网,并用PBS清洗。加PBS至4ml,室温800 r/5 min离心,弃上清,重复操作2次。RMPI-1640完全培养基悬浮沉淀,6 g/L台盼蓝拒染,活细胞计数,调整细胞浓度为2×107个/ml[4]。
1.6.2 燕窝样品制备
1.6.2.1 水提取液:取原燕窝粉末适量,加45BV双蒸水室温浸泡1 h,分别在60、80、100℃水浴中提取3 h,离心取上清,过滤灭菌。Bradford法检测上清液的蛋白质浓度。用RPMI-1640培养液分别稀释至浓度为 5.7、14.0、34.0、127.0、180.0 μg/ml。
1.6.2.2 人工胃液消化物[3]:将上述60℃提取的燕窝蛋白质浓度缩至1 mg/ml。加入同等体积2×人工胃液,37℃消化1 h,立即加入0.168 mol/LNa2CO3调pH为7~8终止反应。离心取上清,过滤灭菌。
1.6.2.3 人工肠液消化物[3]:取同样燕窝浓缩液,加入同等体积2×人工肠液,37℃消化1 h,90℃加热5 min灭酶。离心取上清,过滤灭菌。
1.6.3 MTT法测定大鼠淋巴细胞的生长曲线
用 RPMI-1640 完全培养基将细胞悬液稀释成 1×106、2×106、5×106个/ml 3 个浓度,取 200 μl于 96 孔板中,37℃,5%CO2培养箱中培养。 分别于 12、24、36、48、60、72、84、96 h 用 MTT 比色法测定细胞在570 nm处OD值,绘制生长曲线。
1.6.4 Con A浓度对淋巴细胞转化的影响
实验组取2×106个/ml细胞悬液200μl于96孔细胞培养板内,加入 20 μl不同浓度的 ConA(0.125、0.25、0.5、1、2、4、8、16、32、64 μg/ml)共同培养,调零组仅加培养基 200 μl,对照组仅加细胞悬液200μl,每组设 3个重复。37℃,5%CO2培养 48 h。培养结束前4 h,加入5 mg/ml MTT溶液20μl。培养结束后,室温2 000r/5min离心,弃上清,加入150μl DMSO溶液震荡30 s,静止20 min。用酶标仪在570 nm处测各孔OD值。
1.6.5 燕窝浓度对淋巴细胞转化的影响
取3组2×106个/ml细胞悬液200μl和60℃提取的不同浓度(5.7、14.0、34.0、127.0、180.0 μg/ml)原燕窝提取液置 96孔细胞培养板内培养,一组不加ConA,其余两组分别加入浓度为2μg/ml和4μg/ml的ConA;调零组A仅加培养基200μl,调零组B(排除颜色干扰)同时加200μl培养基和180μg/ml燕窝提取液20 μl,对照组仅加 2×106个/ml细胞悬液 200 μl。 同法测定 570 nm处各孔OD值。
1.6.6 爪哇金丝燕不同处理方法对淋巴细胞转化的影响
分别取两组2×106个/ml细胞悬液200μl和不同方法制备的燕窝提取液于96孔细胞培养板内培养,一组不加ConA,另一组加2μg/ml ConA;调零组、对照组同上。同法测定570 nm处各孔OD值。
1.6.7 不同品种燕窝及其伪品对淋巴细胞转化的影响
取2×106个/ml细胞悬液200μl和不同品种燕窝及其伪品提取液于96孔细胞培养板内,加入2μg/ml ConA;调零组、对照组同上。同法测定淋巴细胞在570 nm波长下各孔OD值。
2 结果
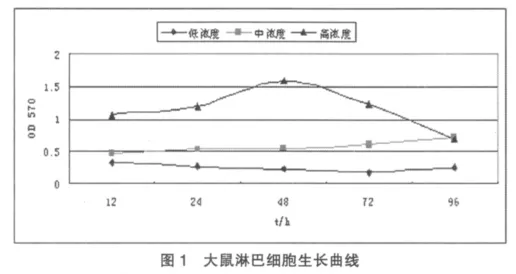
2.1 MTT比色法测定大鼠肠系膜淋巴结细胞的生长曲线
如图1所示,浓度为5×106个/ml的淋巴细胞在48 h内数目不断增加,此后则呈现衰退状态;浓度为2×106个/ml的淋巴细胞在检测时间内呈持续缓慢生长状态;浓度为1×106个/ml的淋巴细胞在检测时间内数量缓慢减少。故其最佳培养浓度为2×106个/ml,检测时间设定为 48 h。
2.2 ConA浓度对淋巴细胞转化的影响
如图2所示,ConA浓度低于2μg/ml时,没有表现出促淋巴细胞转化的作用,当浓度超过2μg/ml开始出现明显的促转化作用,随着浓度升高,转化作用持续增强;直到浓度超过16μg/ml,对淋巴细胞转化逐渐减弱。

2.3 燕窝浓度对淋巴细胞转化的影响
如图3所示,不加ConA组燕窝不能促进淋巴细胞的转化,燕窝浓度对其亦没有太大影响;其余两组淋巴细胞增殖明显,由于3条曲线成平行趋势,故认为大鼠肠系膜淋巴结细胞的转化主要与ConA有关,与是否添加燕窝关系不大,燕窝的浓度对其影响较小。两组加入不同浓度ConA的淋巴细胞转化程度差异不大,但比较之下,低浓度ConA促淋巴细胞转化量缓慢的增加,呈剂量依赖关系,故认为ConA的最佳浓度为2μg/ml;淋巴细胞转化受燕窝浓度影响不明显,故考虑到冷冻干燥后的燕窝粉末复溶较困难,不易得到较高浓度的燕窝样品,故将其浓度确定为40μg/ml。
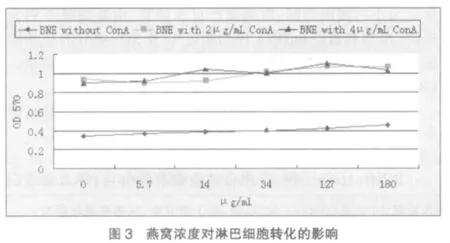
BNE为燕窝提取物缩写,下同
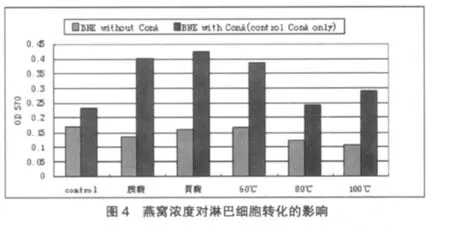
2.4 爪哇金丝燕不同处理方法对淋巴细胞转化的影响
如图4所示,和对照组相比,不加ConA组燕窝没有促淋巴细胞转化作用;ConA组燕窝促淋巴细胞转化作用明显,其中胃蛋白酶消化后的燕窝样品促淋巴细胞转化作用最强,其次是胰蛋白酶消化样品;而水提取样品中,60℃水提取的燕窝促淋巴细胞增殖作用最强,随着温度的增高,增殖作用均有所减弱。
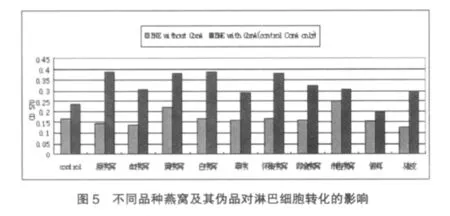
2.5 不同品种燕窝及其伪品对淋巴细胞转化的影响
如图5所示,不加ConA组除了市售燕窝和黄燕窝外,淋巴细胞转化作用均低于对照组;加入ConA后淋巴细胞转化率均有所提高,样品组除银耳外均有辅促淋巴细胞转化的作用,其中原燕窝、黄燕窝、白燕窝和怀集燕窝辅促淋巴细胞转化作用最强,其次是即食燕窝、血燕窝和市售燕窝;草燕窝作用最弱,仅比伪品猪皮、银耳略高。
3 讨论
燕窝始载于清朝张璐的《本草逢原》,具有润肺滋阴,化痰止嗽;开胃气,利劳痢;益气补中,壮阳,添精补髓的功效。一般认为,燕窝平均含有9%水分,20%无机灰分,32.3%蛋白质和38.7%碳水化合物,主要成分是一种黏蛋白样的糖蛋白[5-6]。在现代药理学研究中,张玫等[7]对珍珠燕窝提取液进行药理试验显示,珍珠燕窝提取液能提高T淋巴细胞转化以及提高小鼠血液IgM含量。M.H.NG观察了燕窝水提物对人外周单核细胞在凝集素刺激下有丝分裂的促进作用[8]。
淋巴细胞转化实验的原理是T淋巴细胞在有丝分裂原(如ConA,PHA)的刺激下,引起细胞内新的DNA合成及细胞分化,从而发生一系列增殖变化。和放射性同位素标记法和形态学法比较起来,MTT比色法简便、准确、安全价廉,已经广泛应用于生物学和医学的许多研究领域中[9-11]。与M.H.NG实验结果相似,笔者发现经胃蛋白酶和胰蛋白酶消化后的燕窝辅促淋巴细胞转化作用并没有消失,甚至超过了60℃燕窝水体液,可见胃蛋白酶和胰蛋白酶没有影响燕窝的活性;有研究显示,寡糖链能修饰并改变蛋白质的内在特性,保护多肽链不被蛋白酶水解[12]。在前期研究中笔者亦发现,早期研究中的燕窝活性蛋白确实有可能避开胃肠道的消化降解,直接作用于肠上皮细胞发挥作用。而随着提取温度的升高,燕窝辅促淋巴细胞转化作用开始下降,这说明这种活性蛋白有可能具有热敏感性。
由黄燕窝制作的即食燕窝仍表现出了和原物质相似的性质,可见罐头的加工过程并没有损耗燕窝样品中的活性物质;除银耳外,其他所有样品均表现出辅促淋巴细胞转化的作用,其中以未经加工处理的原始燕窝作用最强,由此可见,加工过程会对燕窝活性物质产生一定影响;在辅促淋巴细胞转化的实验中,怀集燕窝表现出了和燕窝中品质较高的黄燕窝、白燕窝一样的作用,可猜测其中均含有共同的活性物质,由于怀集燕窝含杂质较多,加工处理过程繁琐,虽进入市场但商品价值较低。有人认为血燕窝之所以呈现红色与燕子栖息岩洞中的矿物质有关;如果这个假设是成立的,市场上血燕窝的数量必定稀少。笔者猜测,目前大量于市场中流通的血燕窝其中大部分是采用水溶性或脂溶性染料加工成的染色燕窝,故导致其活性物质减少,辅促淋巴细胞转化的作用减弱。
蛋白多糖是细胞外基质的重要组成成分,参与细胞分化、生长、黏附、迁移、信息传递和组织形态结构的形成,在细胞免疫方面起着重要作用[13]。在SDS-PAGE电泳实验中,笔者亦证明燕窝中含有大量糖蛋白,燕窝辅促大鼠淋巴细胞转化作用的活性物质是否为糖蛋白,仍需要在进一步分离燕窝蛋白质的基础上验证。综上所述,燕窝不能直接促进大鼠肠系膜淋巴结细胞转化,但对低浓度ConA诱导下淋巴细胞的转化有一定增强作用。推测其原因是其具有T淋巴细胞有丝分裂原的性质,可促进T淋巴细胞的分裂增殖,反映了集体细胞免疫水平,但推测燕窝具有细胞免疫增强作用则需要进一步验证。
[1]Ng MH,Chan KH,Kong YC.Potentiation of mitogenic response by extractsof theswiftlet's(Collocalia)nest[J].BiochemInternational,1986,13(3):521-531.
[2]Lin JR,Zhou H,Lai XP,et al.Genetic identification of edible birds'nest based on mitochondrial DNA sequences[J].Food Research International,2009,42(8):1053-1061.
[3]Board of Trustees.The United States Pharmacopeia[S].the United States,1995:2053.
[4]高娟,李芳兰,周一珺,等.不同发育时期大鼠小肠粘膜及派氏结T淋巴细胞发育活化的研究[J].中国免疫学杂志,2009,25(8):678-683.
[5]Wang CC.The composition of Chinese edible bird’s nest and the nature of their proteins[J].Biol ChemBaltimore,1921,49:429-439.
[6]O'Farrell PH.High resolution two-dimensional electrophoresisof proteins[J].Biol Chem,1975,250(10):4007-4021.
[7]张玫,王道生.珍珠燕窝提取液的功效试验[J].药物生物技术,1994,1(2):49-51.
[8]侯温甫,杨文鸽.糖链及其蛋白质糖基化[J].生物技术通报,2005,20(3):14-17.
[9]张涛,赵蕊,柳朝阳,等.川芎嗪对T淋巴细胞活化增殖的影响[J].中国老年学杂志,2009,29(13):1658-1659.
[10] 陈光星,李晓娟,刘清平,等.青藤碱对T淋巴细胞活化增殖的影响[J].广州中医药大学学报,2008,25(5):425-428.
[11]张雷,郑芙林,李珊珊,等.隐丹参酮对淋巴细胞增殖反应的影响[J].时珍国医国药,2010,21(1):92-93.
[12]Erkki R.Proteoglycans in cell regulation[J].Biol Chemistry,1989,264(23):13369-13372.
[13]刘英,程翔,廖玉华.地尔硫卓对刀豆凝集素诱导单个核细胞细胞因子表达的影响[J].中国药理学通报,2010,26(3):376-378.
