UV和NTG复合诱变柠檬酸生产菌种黑曲霉
2010-05-10任晓莉杨宝强赵润柱
任晓莉,赵 林,杨宝强,赵润柱
(1. 天津大学环境科学与工程学院,天津300072;2. 太原工业学院环境工程系,太原030008)
柠檬酸是一种非常重要的有机酸,广泛应用于食品工业和日化行业等.柠檬酸菌种选育在发酵工业中占有重要的地位,是决定该发酵产品能否具有工业化生产价值及发酵过程成败的关键,所以几十年来柠檬酸生产菌种黑曲霉的选育研究一直是研究人员所关注的焦点.国外有很多关于柠檬酸发酵菌种黑曲霉选育的研究报道[1-5],我国在柠檬酸发酵菌种黑曲霉的选育方面也积累了丰富的经验,认为对黑曲霉选育较为有效的诱变因子有紫外线(ultraviolet,UV)、激光、Co-射线、γ-射线、亚硝基胍(Nitrosoguanidine,NTG)、甲基磺酸乙酯(ethylmethane sulphonate,EMS)等[6-8].笔者考虑到柠檬酸生产菌种经过几十年的诱变已经对单一诱变产生一定的抗性,所以重点对UV和 NTG复合诱变进行了实验研究,本文的实验结果对提高柠檬酸的产量与质量、增强我国柠檬酸国际市场竞争力、促进柠檬酸行业的发展有重要的参考价值.
1 实验材料和方法
1.1 菌 种
采用菌种黑曲霉(Aspergillus niger)为保存菌种,经斜面活化筛选后作为出发菌株和对照菌株.
1.2 培养基
斜面培养基:察氏琼脂培养基.
筛选培养基:察氏琼脂培养基添加质量分数为0.04%溴甲酚绿指示剂和2%的玉米淀粉水解液.
摇瓶和发酵罐培养基:玉米淀粉调浆 20%~25%,加入适量耐高温α-淀粉酶和0.15%的氯化钙,加热至 95~98,℃并保温液化 1.5~2,h;当溶液呈基本透明状态碘液检验合格后,100,℃煮沸 5,min;纱布过滤,调整至初糖总量16%左右.
1.3 诱变步骤和方法
将配制好的单孢子悬液置于 15,W 紫外灯下,距离30,cm照射一定时间,取紫外照射好的单孢子悬液分装无菌离心管中并编号,分别加入配制好的丙酮助溶的 NTG母液,NTG最终浓度为 0.25,mg/mL、0.50,mg/mL和0.75,mg/mL 3个浓度梯度.充分混匀后 35,℃、160,r/min振荡处理 30,min,离心,冷生理盐水洗涤2~3次,加入5,mL无菌水,稀释成不同梯度浓度涂布筛选平板,35,℃培养4,d.
1.4 总酸测定
将发酵液经脱脂棉过滤后,用定性滤纸过滤.吸取滤清液 10,mL,置于 250,mL锥形瓶中,加蒸馏水100,mL,并滴加 0.5%的酚酞指示剂两滴,用0.142,9,mol/L的 NaOH溶液滴定,记录所消耗的NaOH的体积V(mL),计算产酸率A(%),

式中:cNaOH为氢氧化钠的浓度,mol/L;ML为柠檬酸的相对分子质量.
1.5 柠檬酸含量的测定
柠檬酸含量测定采用纸上层析法.展开剂:正丁醇/醋酸/水=12∶3∶5;显色剂:400,mg 溴汾蓝溶于1,L体积分数为 95%的乙醇,用NaOH调节pH值至7.5.
2 结果与分析
2.1 紫外照射时间的确定
诱变剂量的选择往往以致死率为依据:若致死率太高,易产生负突变;若致死率太低,则突变较低.为了确定紫外照射的诱变剂量,对不同时间下紫外照射的孢子致死率进行了测定,结果见表1.
由表1可以看出,黑曲霉孢子致死率随着紫外线照射时间的延长而增加,当照射时间为 6~8,min时,致死率约为 73%~85.4%,此时的诱变剂量认为是适宜的诱变剂量,所以笔者认为,对于黑曲霉孢子诱变来说,用 15,W 的紫外灯、距离 30,cm,照射时间应为6~8,min.
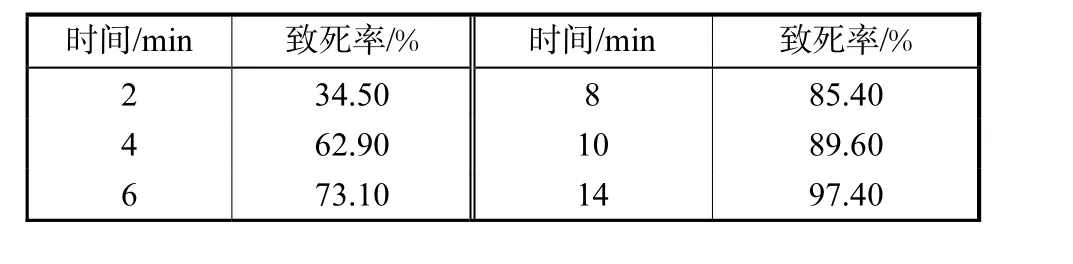
表1 紫外照射时间对致死率的影响Tab.1 Effect of UV radiation period on lethal rate
2.2 突变株的筛选
经 UV和 NTG诱变后的单孢子悬液培养 4,d后,用接种环从筛选平板中挑取变色圈直径(T)与菌落直径(J)的比值(R)较大的黑曲霉菌株接种斜面,35,℃培养4,d后,用无菌水冲洗斜面接种到摇瓶培养液中(500,mL装液50,mL),置于SPX-250B-D型恒温培养箱中,调节至35,℃,摇床转速300,r/min,振荡培养4,d,进行产酸测定,计算糖酸转化率,并对照出发菌株(产酸率为12.5%)计算产酸增幅,结果见表2.
由表 2可知,经过复合诱变后挑选的 12株黑曲霉突变株中,有10株产酸率得到不同程度的提高,其中产酸率最高的为 15.80%,增幅可达26.40%,糖酸转化率达到 98.75%,这说明经过 UV和 NTG复合诱变,可以明显提高黑曲霉菌株的生产能力.由表 2还可以看出,产酸增幅比较大的黑曲霉菌株往往变色圈直径(T)与菌落直径(J)的比值较大,但并不是所有变色圈直径(T)与菌落直径(J)的比值增大的菌株都能产生正突变,这可能与菌种形态和产孢子能力有一定关系.结合表 2产酸结果和实验过程中对菌株形态的观察发现,菌落直径较大、中间凹陷、边缘不规则、颜色较浅、孢子较少的菌株,即使变色圈很大,但是摇瓶发酵效果依然不好,在表2中出现负突变的UN-05和UN-12两个菌株都属于类似情况.
2.3 突变株稳定性考察
从摇瓶产酸结果中筛选出产酸率较高的UN-01、UN-08和UN-09 3个菌株,进一步传代培养,以考察菌株的遗传稳定性,结果见表3.
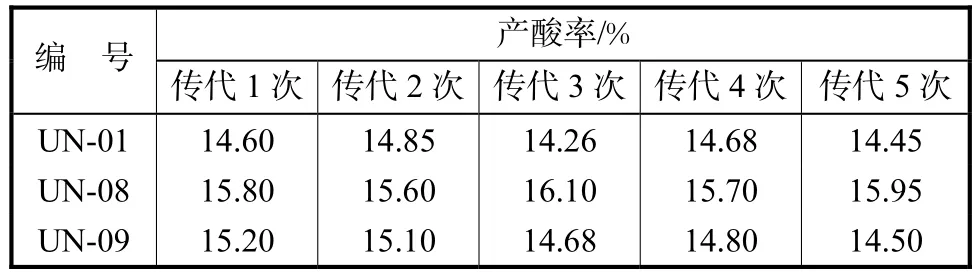
表3 突变株稳定性考察Tab.3 Production stability of mutants
由表 3可以看出,3株高产菌株中,UN-01基本稳定,平均产酸率 14.56%;UN-08遗传比较稳定,平均产酸率最高,可以达到15.83%;UN-09在传代5次之后,生产能力有所下降,从第 1代的 15.20%下降到14.50%,因此本实验认为 UN-08产酸率较高,稳定性能也较好,是一株较优良的突变株.
考虑在柠檬酸生产发酵过程中,黑曲霉还可能产生其他的有机酸,如草酸、葡萄糖酸和异柠檬酸等;物理和化学诱变因子作用于黑曲霉后,有可能改变菌株原来的代谢通路而积累其他的有机酸;因此,采用纸上层析法对突变株 UN-08的产酸进行了柠檬酸纯度检查,检查结果表明UN-08产杂酸较少.
2.4 产酸条件优化研究
对于柠檬酸发酵生产,接种量、温度和溶氧等是最主要的发酵工艺条件,因此笔者对筛选出的突变株UN-08在型号为BIOTECH-10BGZ的10,L全自动发酵罐内进行了实验,以确定此菌株生产的适宜工艺条件,为工业化生产提供参考依据.
2.4.1 接种量对产酸的影响
柠檬酸发酵接种量的多少,决定于进入培养系统的孢子数量.在发酵过程中,菌丝球与接入孢子数呈正比关系:若接种量过小,则菌丝球过少影响产酸,而且不能很好地维持球状;若接种量过大,则由于黑曲霉是好氧菌,影响氧的传质,从而影响到菌体的正常生理代谢.笔者采用斜面孢子,用血球计数板计数后接种不同浓度的孢子,考察接种量对产酸的影响.实验条件如下:温度 35,℃,搅拌转速 300,r/min,通气率0.15,m3/(m3·min),初始 pH 值为 7.0,溶氧饱和度为30%.实验结果见图1.
由图 1可以看出,黑曲霉 UN-08的接种孢子数量在 106~108个/mL范围内柠檬酸产量最高,为15.8%左右,糖酸转化率接近 98.75%,发酵指数为1.32,kg/(m3·h).若接入的孢子数量过少,则产酸量降低;若再增加接入的孢子数量,产酸量不仅不再升高,反而略有下降,因此笔者认为黑曲霉 UN-08接入的孢子数量应在106~108个/mL范围内.
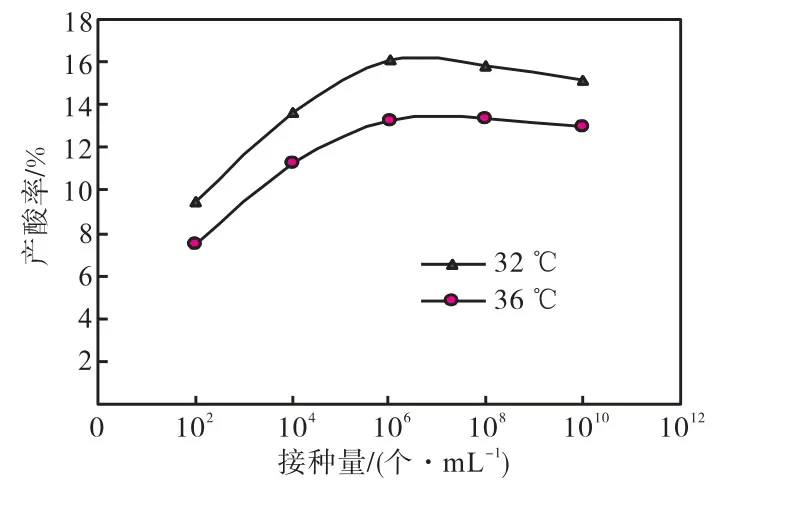
图1 接种量对产酸的影响Fig.1 Influence of inoculation rate on citric acid yield
2.4.2 温度对产酸的影响
温度主要通过影响酶的活性而影响菌体的生长代谢活动,一般微生物菌体生长和产物形成都有一个最适温度,本实验通过调节温度对不同接种量下黑曲霉UN-08的产酸率进行了研究.实验条件如下:搅拌转速300,r/min,通气率0.15,m3/(m3·min),初始 pH值为7.0,溶氧饱和度30%,孢子接入量在106~108个/mL范围内.实验结果见图2.
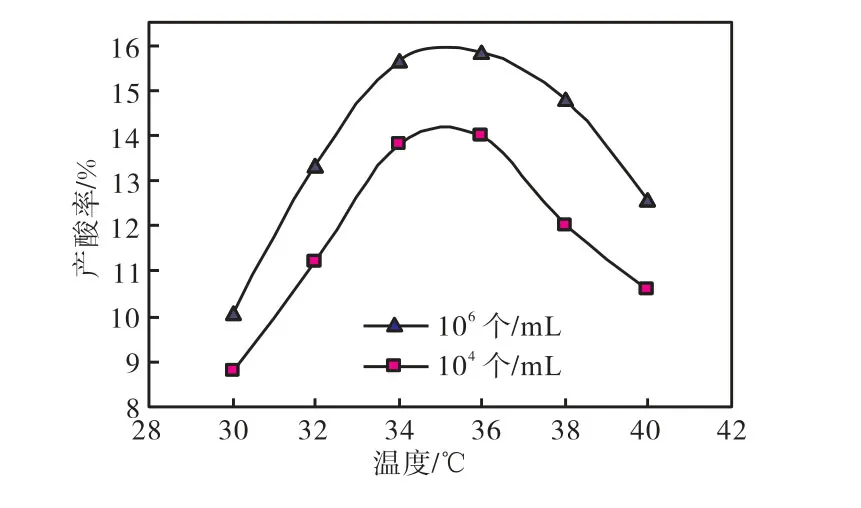
图2 发酵温度对产酸的影响Fig.2 Influence of fermentation temperature oncitric acid yield
由图 2可以看出,随着发酵温度的升高,接种孢子数量为104,个/mL和106,个/mL时的柠檬酸的产酸率都是先增加后降低;当温度在 34~36,℃时,产酸率达到最高,接近 16%,糖酸转化率接近 100%,发酵指数为1.33, kg/(m3·h).所以黑曲霉UN-08的适宜发酵温度范围为34~36,℃.
2.4.3 溶氧对产酸的影响
柠檬酸发酵属于好氧发酵,发酵过程中的溶氧水平对产酸率影响很大.结合发酵生产中的实际情况,分别对种子液接种后 0.12,m3/(m3·min)、0.15,m3/(m3·min)和分段控制(0~40,h为 0.12,m3/(m3·min),40~96,h 后为 0.15,m3/(m3·min))溶氧水平进行了实验研究.实验条件如下:温度 35,℃,搅拌转速300,r/min,初始pH值为7.0.实验结果见图3.

图3 溶氧对产酸的影响Fig.3 Influence of DO on citric acid yield
由图 3可以看出,分段控制溶氧时产酸率最高,当发酵过程溶氧控制在 0.12,m3/(m3·min)时,整体发酵水平降低,尤其是后期,产酸率增长缓慢,这说明柠檬酸合成时期,足够的溶氧是保证高产酸率的必要条件.当发酵过程溶氧控制在 0.15,m3/(m3·min)时,由于前期溶氧较高,导致前期菌体生长过快,代谢旺盛,最终影响柠檬酸产量[9],而且溶氧过高,也会导致产品成本升高.因此笔者认为,分段控制(0~40,h为0.12,m3/(m3·min),40~96,h 后 为 0.15,m3/(m3·min))溶氧水平有利于提高产酸率.
3 结 论
(1)当用 15,W 的紫外灯对黑曲霉孢子进行诱变,孢子悬液距离紫外灯 30,cm 时,照射时间在 6~8,min是适宜的.
(2)采用 UV和 NTG方法对实验室保存的黑曲霉菌种进行了复合诱变,并通过溴甲酚绿平板初筛和摇瓶复筛,筛选出了 3株产酸增幅率较高的菌株.通过对3株菌株的稳定性考察,获得了一株遗传性能稳定、产酸率为 15.80%的高产菌株.通过对高产菌株UN-08的发酵条件进行研究,确定了此菌株生产接种时适宜的孢子数量为 106~108个/mL,发酵温度应控制在 34~36,℃,溶氧应采用分段控制,前期(0~40,h)控制在 0.12, m3/(m3·min)左右、后期(40~96,h)控制在0.15,m3/ (m3·min)左右.
[1] Sanjay G,Chandra B S. Biochemical studies of citric acid production and accumulation byAspergillus nigermutants[J].Biotechnology Letters,2002,5(18):379-383.
[2] Ikram-ul-Haq,Samina Khurshid,Sikander Ali,et al.Mutation of Aspergillus niger for hyperproduction of citric acid from black strap molasses[J].World Journal of Microbiology & Biotechnology,2001,17:35-37.
[3] Lotfy W A,Ghanem K M,El-Helow E R. Citric acid production by a novelAspergillus nigerisolate(I):Mutagenesis and cost reduction studies[J].Bioresource Technology,2007,98(18):3464-3469.
[4] Nibedita Mukherjea,Banik A K. Introduction of mutation onAspergillus nigerby chemical and physical methods for improved bioleaching of bauxite[J].Asian Journal of Chemistry,2006,18(4):2840-2845.
[5] Watanabe T,Suzuki A,Nakagawa H,et al. Citric acid production from cellulose hydrolysate by a 2-deoxyglucose-resistant mutant strain ofAspergillus niger[J].Bioresource Technology,1998,66(3):271-274.
[6] 潘 涛,周 剑,虞 龙,等. 紫外诱变柠檬酸生产菌黑曲霉的选育[J]. 化学与生物工程,2007,24(1):50-52.
Pan Tao,Zhou Jian,Yu Long,et al. Breeding of citric acid producing bacteriaAspergillus nigerby UV mutation[J].Chemistry & Bioengineering,2007,24(1):50-52(in Chinese).
[7] 李文友. 复合诱变柠檬酸菌种的选育及发酵条件和培养基的优化[D]. 天津:天津大学环境科学与工程学院,2007.
Li Wenyou. Composite Mutation Breeding of Citric Acid Bacteria and the Optimization of Fermentation Conditions and Medium[D]. Tianjin:School of Environmental Science and Engineering,Tianjin University,2007(in Chinese).
[8] 张建军,甘秀英,侯 娟,等. He-Ne激光复合诱变选育柠檬酸高产菌[J]. 石河子大学学报,2007,25(2):225-228.
Zhang Jianjun,Gan Xiuying,Hou Juan,et al. Breeding of citric acid producing strains by He-Ne laser compound mutation[J]. Journal of Shihezi University,2007,25(2):225-228(in Chinese).
[9] 刘 辰. 木薯原料生产柠檬酸工艺的研究[D]. 无锡:江南大学生物工程学院,2005.
Liu Chen. Citrate Acid Production from Cassava[D].Wuxi:School of Biotechnology,Jiangnan University,2005(in Chinese).
