异鼠李素对缺血再灌注损伤大鼠心室肌细胞凋亡的抑制作用*
2010-05-07陈芬杨超蔡哲石超杨春蕾
陈芬 杨超 蔡哲 石超 杨春蕾
(四川大学生命科学院,医学细胞生物学教研室,四川 成都 610041)
心脏病是严重威胁人类生命的疾病,据统计每年死于该病的人数占到总死亡人数的40%[1]。其中心肌的局部损伤是一种常见的心脏病,其病损主要由血栓或急性动脉粥样硬化斑块引起动脉血管供血不足造成的。为了挽救缺血组织,对局部缺血的心脏进行再灌注已经被广泛应用。但这种措施也会造成不可逆的损伤,即缺血再灌注损伤[2]。近来很多研究表明心肌在缺血再灌注损伤会出现大量细胞凋亡,因此心肌缺血再灌注损伤的病理及各种保护机制已成为医学研究的热点之一。
黄酮类化合物在植物代谢产物中普遍存在并且成为人类和动物饮食的一部分[3]。有研究指出冠状动脉心脏病的死亡率和饮食中黄酮类化合物的摄入量呈负相关[4]。槲皮素对心肌细胞的保护作用在实验和临床研究中都已经被证实[5]。本次实验主要研究槲皮素在体内的一级代谢物异鼠李素(Isorhamnetin)[6]是否对缺血再灌注损伤的心肌细胞生长、增殖有影响,拟寻求其对心肌细胞起到的保护作用。
1 材料和方法
1.1 实验动物及主要试剂
新生SD大鼠(出生24~48h之内),体重 50-60g,雌雄兼用,由四川大学实验动物中心提供(实验动物使用许可证号:046)。
异鼠李素(M EDCO制药有限公司,中国);DMEM、II型胶原酶、透明质酸酶(GIBCO公司,美国);胰蛋白酶、HEPES和MTT(Sigma公司,美国);胎牛血清(元亨金马公司,中国);兔抗Bcl-2(sc-7832)、兔抗Bax(sc-7480)、兔抗 p53(sc-126)、兔抗NF-κ B/p65(sc-8008)和抗兔 IgG(Santa Cruz,美国);乳酸脱氢酶试剂盒(建成科技公司,中国);BCA蛋白试剂盒、NE-PER核酸提取试剂盒和ECL底物发光试剂(百泰克公司,中国)。
1.2 方法
1.2.1 新生SD大鼠心肌细胞的原代培养
将出生24~48h SD大鼠处死后取其心脏。取出心脏用预冷的PBS清洗血块。剥去心包膜,剪碎后用混合酶在37℃下孵育消化25min,用200μ m孔径滤网除去未消化的组织块残渣,得到的细胞悬液离心,得到的细胞沉淀加入含有10%胎牛血清的 DMEM中重悬置于培养箱中(37℃,5%CO2)孵育45min后,轻轻吸出细胞悬液于离心管离心后重悬培养,重复2次。最后纯化的心室肌细胞培养在含10%胎牛血清,青霉素(100μ g◦ml-1)和链霉素(100μ g◦ml-1)的 DMEM 中,置于5%CO2,37℃培养箱中培养。
1.2.2 心肌细胞的缺血再灌注模型的建立
选取3d以后生长良好的心室肌细胞,首先加入模拟缺血液置于缺氧装置中通入95%N2+2.5%CO2混合气体缺血缺氧24h。后弃去模拟缺血液,加入模拟再灌注液置于标准的培养环境下(5%CO2,37℃)再灌注培养1h。
1.2.3 实验分组
心肌细胞以相同细胞数随机分为三组,分别为:I/R-/Isor-,I/R+/Isor-和 I/R+/Isor+组。正常对照组(I/R-/Isor-)以10%胎牛血清DMEM完全培养基培养,用以评估I/R对心肌细胞的损伤程度。缺血再灌注组(I/R+/Isor-):作为实验组1。缺血再灌注后异鼠李素处理组(I/R+/Isor+):除加入模拟再灌注液外再加入了适量的异鼠李素,用以评估异鼠李素对缺血再灌注(I/R)损伤后心室肌细胞的保护作用,作为实验组2。
1.2.4 检测指标
1.2.4.1 MTT测定细胞活力
将心肌细胞(1×104个◦孔-1)植入96孔板。在建立缺血再灌注模型后,分别用0,1,2,4,8,16和32μ M的浓度梯度的异鼠李素处理各组心肌细胞。37℃,5%CO2条件下培养48h后,每孔加入5mg◦ml-1MTT 10μ l培养4h,弃上清,加0.1ml二甲基亚砜,振荡15min,酶联免疫分析检测仪测定OD490。每个浓度重复4孔。
1.2.4.2 乳酸脱氢酶活力测定
分别在I/R-/Isor-,I/R+/Isor-和I/R+/Isor+组中检测作为细胞损伤生化指标之一的乳酸脱氢酶的释放。整个检测遵照试剂盒的产品说明,在340nm下的吸光值即反映乳酸脱氢酶活性。实验重复3次。
1.2.4.3 流式细胞术凋亡率测定
分别收集 I/R-/Isor-,I/R+/Isor-和I/R+/Isor+组心肌细胞1×106,70%预冷的乙醇固定[7]。固定的细胞用PBS洗两次后用DNA萃取试剂在室温下孵育5min。离心后,细胞在含碘化丙啶(20mg◦l-1)和 RNA酶 A(1 g◦l-1)的溶液中重悬避光孵育30min。然后将样品放入FACS420流式细胞仪中测量DNA含量来估算每个样品中细胞的凋亡率。所有检测结果来自相同的仪器和相同的实验条件。
1.2.4.4 Western blot检测 Bcl-2、Bax、p53及 NF-kB/p65的表达
用胰酶消化I/R-/Isor-,I/R+/Isor-和I/R+/Isor+组心肌细胞,再以PBS洗两次后,溶于含有亮胰蛋白酶肽(Leupeptin,10μ g◦ml-1),抑肽酶(aprotinin,10μ g◦ml-1)和苯甲基磺酰氟(PMSF,100μ g◦ml-1)的细胞裂解液置于冰上30min后12000g离心10min。上清液既是整个细胞的提取物。核蛋白用NE-PER核蛋白萃取试剂进行分离。以BCA蛋白检测试剂盒定量后,调整至同一浓度。取50μ g上样至12%浓缩胶和5%分离胶上,120V恒压电泳1.5h。50V恒压转膜30min。将膜置于NC膜与5%脱脂牛奶和TBST封闭液中封闭1h。再将NC膜与 TBST 稀释的一抗 Bax(1:400)、Bcl-2(1:400)、NF-κ B/p65(1:400)、p53(1:400)、β-actin(1:1000)进行孵育4℃过夜。TBST洗膜三次,后将膜和辣根过氧化偶联的二抗(1:10000)室温孵育1h,洗膜三次,每次10min。在膜上加ECL化学发光剂,暗室观察后用胶片(Kodak)曝光对免疫印迹进行采集。
1.3 统计学处理
2 结果
2.1 MT T检测结果
相对于正常的I/R-/Isor-组,I/R+/Isor-组的心肌细胞生长活力受到严重影响(P<0.05)。实验观察到异鼠李素对心肌细胞生长活力的双重作用:异鼠李素的浓度在1-4μ M 范围时,随着浓度的加大,细胞的活力逐渐增强;当浓度在8至32μ M 逐步增大时,细胞活力逐渐减弱(见图 1)。异鼠李素对缺血再灌注后心肌细胞的活力正面或负面的影响都存在一个浓度效应而4μ M的异鼠李素可以有效的补救缺血再灌注对心肌细胞造成的损伤。本研究中的后续实验都基于此最适浓度(4μ M)。

图1 不同浓度的异鼠李素对心肌细胞生长的影响
I/R-/Isor-与I/R+/Isor-相比:*P<0.05;I/R+/Isor+(4μ M)与I/R+/Isor-相比:**P<0.05。下同。
2.2 乳酸脱氢酶活力检测
与正常对照组相比,I/R+/Isor-组乳酸脱氢酶的活力提高了近4倍,从5.9±0.7升至 24.1±2.3;异鼠李素处理后可明显抑制乳酸脱氢酶的活力,降低近50%至 11.4±1.2。(P<0.05)(见表 1)。
表1 乳酸脱氢酶活力检测(,n=3)

表1 乳酸脱氢酶活力检测(,n=3)
组乳酸脱氢酶活力(U◦L-1)I/R-/isor- 5.9±0.7 I/R+/Isor- 24.1±2.3*I/R+/isor+ 11.4±1.2**
2.3 流式细胞仪检测
缺血再灌注处理后心肌细胞的凋亡率由5.8±0.96%升至21.4±1.56%(P<0.05);而异鼠李素可以使这些细胞的凋亡率降至7.87±0.97%(P<0.05)(见图 2)。
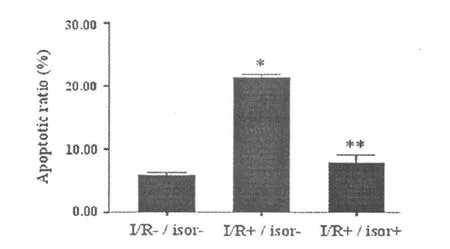
图2 心肌细胞凋亡率
2.4 Western blot检测
缺血再灌注处理的I/R+/Isor-组心肌细胞bax表达量显著上升而Bcl-2显著下降;但在I/R+/Isor+组,异鼠李素处理后bcl-2表达量升高,相对bax表达量下降(见图3 a)。因此,相对于I/R+/Isor-组,Bcl-2/Bax比率在异鼠李素处理后得到显著上升。此外I/R+/Isor-组心肌细胞p53的表达上调,在经异鼠李素处理后表达量开始下降(见图3 c)。
另外,利用NE-PER核蛋白萃取试剂得到全部的核蛋白,Western blot分析显示缺血再灌注可以明显诱导NF-κ B/p65在核内的大量聚集,异鼠李素可减少该蛋白在核内的聚集,表明异鼠李素能阻断 NF-κ B信号通路(见图3b)。

图3 Western blot检测
3 讨论
缺血再灌注损伤和氧自由基的形成有关[8]。这种过氧化作用导致了无氧代谢和细胞死亡的标记物乳酸脱氢酶的释放[9]。Bao和 Lou证实异鼠李素对氧化修饰低密度脂蛋白(LDL)引起的体外内皮细胞损伤具有保护作用[10]。另有研究指出莲属坚果醛的雄蕊中分离出的异鼠李素还具有清除氧自由基和过氧亚硝酸盐阴离子(ONOO)的能力[11]。我们研究发现,在I/R+/Isor-组我们检测到乳酸脱氢酶的活力上升。经异鼠李素处理后,乳酸脱氢酶的活力受到抑制。而且I/R+/isor-组的心肌细胞出现了大量的凋亡,其凋亡率是对照组的4倍;但是异鼠李素也使心肌细胞的存活率明显提高。细胞水平的这种结果导出了一个假设:异鼠李素通过抑制凋亡来完成它的保护任务和发挥抗氧化作用。
为了探讨异鼠李素潜在的抗凋亡机制,我们首先检测了四个典型的与凋亡相关的蛋白。
Bcl-2家族中的蛋白兼具有促凋亡和抗凋亡的作用。该家族的数个蛋白中,Bcl-2具抗凋亡作用,同时Bax被视为具促凋亡作用[12]。研究发现Bcl-2/Bax的比率在包括心肌细胞在内的各种细胞凋亡中发挥重要作用[13]。最近研究显示降低Bcl-2/Bax比率可以显著的增加凋亡率。在本实验I/R+/isor+组,则检测到Bcl-2/Bax比率的升高。
据报道,NF-κ B在心脏缺血再灌注过程中起了关键作用,作为多向调节性的核转录因子,近年发现其广泛调控与免疫反应、应激反应和炎症反应相关的基因。Maulik等发现急性缺血再灌注可诱导NF-κ B的活化和心肌细胞的凋亡及抗凋亡基因Bcl-2表达减少[14]。而NF-κ B信号通路的激活依赖于 NF-κ B/p65从细胞质到细胞核的转位[13]。本实验显示经异鼠李素处理后NF-κ B/p65在心肌细胞核的积累减少,凋亡也明显的减少,显示异鼠李素的抗凋亡作用和NF-κ B信号通路有很大关系。
在细胞各个方面都发挥重要作用的p53在过去几十年得到了广泛的研究[15]。上调p53通过刺激bax的表达或者抑制bcl-2的表达来诱导心肌细胞的凋亡[16]。此外,研究发现缺血再灌注损伤在包括心脏在内的不同器官和组织中与p53的激活有关[17-19]。在凋亡的心肌细胞中还观察到作为p53转录靶点的Bax也同时增加[20]。我们实验结果显示异鼠李素抑制了p53的表达,这可能和下调bax表达有关系[18,21]。
从实验结果看,我们揭示了缺血再灌注损伤后异鼠李素对心肌细胞可能的保护作用,同时异鼠李素对缺血再灌注损伤的心肌细胞保护作用的机制之一是通过抗凋亡来实现的。
1 Chambless L,Keil U,Dobson A,et al.Population versus clinical view of case fatality from acute coronary heart disease:results from the WHO MONICA Project 19851990[J].Circulation,1997,96(11):3849-3859.
2 Gross GJ,Hsu A,Falck JR,et al.Mechanisms by which epoxy eicosatrienoic acids(EET s)elicit cardioprotection in rat hearts[J].J M ol Cell Cardiol,2007,42(3):687-691.
3 Bravo L.Poly phenols:chemistry,dietary sources,metabolism,and nutritional significance[J].Nutr Rev,1998,56(11):317-333.
4 Yang GE,Bao L,Zhang XQ,et al.Studies on flavonoids and their antioxidant activities of Artemisia annua[J].Zhong Cao Yao,2009,32(11):1683-1686.
5 Sato S,Kajiyama Y,Sugano M,et al.Flavopiridol as a radio-sensitizer for esophageal cancer cell lines[J].Dis Esophagus,2004,17(4):338-344.
6 Lan K,HE JL,T ian Y,et al.Intra-herb pharmacokinetics interaction between quercetin and isorhamentin[J].Acta Pharmacol Sin,2008,29(11):1376-1382.
7 Pozarowski P,Grabarek J,Darzynkiewicz Z.Flow cytometry of apoptosis[M].Curr Protoc Cytom,2003.
8 Hung LM,Chen JK,Lee RS,et al.Beneficial effects of astringinin,a resveratrol analogue,on the ischemia and reperfusion damage in rat heart[J].Free Radic Biol Med,2001,30(8):877-883.
9 Palmen M,Daemen M J,De Windt LJ,et al.Fibroblast g rowth factor-1 improves cardiac functional recovery and enhances cell survival after ischemia and reperfusion:a fibroblast growth factor receptor,protein kinase C,and ty rosine kinase-dependent mechanism[J].J Am Coll Aardiol,2004,44(5):1113-1123.
10 Bao M,Lou Y.Iso rhamnetin prevent endothelial cell injuries from oxidized LDL via activation of p38 MAPK[J].Eur J Pharmacol,2006,547(1-3):22-30.
11 Hyun SK,Jung YJ,Chung HY,et al.Isorhamnetin glycosides with free radical and ONOO-scavenging activities from the stamens of Nelumbo nucifera[J].A rch Pharm Res,2006,29(4):287-292.
12 Youle RJ,Strasser A.T he BCL-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(1):47-59.
13 Chao DT,Korsmeyer SJ.Bcl-2 family:regulators of cell death[J].Annu Immuno,1998,16:395-419.
14 Maulik N,Go sw am iS,Galang N,et al.Diffenerential regulation of Bcl-2,AP-1 and NF-kappaB on cardiomyocyte apoptosis during myocardial ischemic stress adaptation[J].FEBS Lett,1999,443(3):331-336.
15 Sidransky D,Hollstein M.Clinical implications of the p53 gene[J].Ann Med,1996,47:285-301.
16 Ruxing Y,Dezhai Y,Jiaquan L.Effects of cardiotrophin-1 on hemodynamics and cardiomy ocyte apoptosis in rats with acute myocardial infaraction[J].J Med Invest,2004,51(1-2):29-37.
17 Kelly KJ,Plotkin Z,Vulgamott SL,et al.P53 mediates the apoptotic response to GTP depletion after renal ischemia-reperfusion:protective role of a p53 inhibitor[J].J Am Soc Nephrol,2003,14(1):128-138.
18 Hatoko M,Tanaka A,Kuwahara M,et al.Difference of molecular response to ischemia-reperfusion of rat skeletal muscle as a function of ischemic time:study of the expression of p53,p21(WAF-1),Bax protein,and apoptosis[J].Annu Plast Surg,2002,48(1):68-74.
19 Leker RR,Aharonowiz M,Greig NH,et al.The role of p53-induced apoptosis in cerebral ischemia:effects of the p53 inhibitor pi?thrin alpha[J].Exp Neurol,2004,187(2):478-486.
20 Zhao ZQ,Velez DA,Wang NP,et al.Progressively developed myocardial apoptotic cell death during late phase of reperfusion[J].Apoptosis,2001,6(4):279-290.
21 Moll UM,Wolff S,Speidel D,et al.Transcription-independent pro-apoptotic functions of p53[J].Curr Opin Cell Biol,2005,17(6):631-636.
