邻溴苯酚在高温碱水中的脱溴和降解动力学研究
2010-05-01李光明贺文智
徐 敏,李光明,关 杰,贺文智
(1.上海第二工业大学 城市建设与环境工程学院,上海 201209;2.同济大学环境科学与工程学院,上海 200092)
0 引言
废弃印刷线路板的资源化技术一直是电子废弃物领域的重要研究内容。近年来废弃线路板热解技术成为新的研究热点,在无氧高温(400 ℃~700 ℃)条件下处理废弃线路板,基板树脂发生热解,可以回收金属、热解油气和玻璃纤维等产物,具有较强吸引力。然而由于传质阻力等原因,由基板树脂中的溴阻燃剂热解生成的溴代酚类、溴化芳烃类等含溴有机物仍残存于热解油中(浓度约为千分之几到万分之几),限制了热解油品作为燃料或化工原料的进一步使用[1]。国内外对含溴热解油的热解脱卤技术进行了不少研究,主要集中在催化热解和加氢催化热解技术上[2],虽取得了一定进展,但积炭造成的催化剂失活问题没得到很好解决。
高温液态水通常指温度在200 ℃~ 350 ℃之间的压缩液态水,它能同时溶解有机物和无机物,自身具有酸催化与碱催化的功能,是一种环境友好的反应介质[3-5]。近年来,以高温水为反应介质的水热脱卤技术由于具有反应速度快、可实现选择性分解、能抑制热分解产生的焦化等特性而逐渐受到国内外研究者的关注。王宝凤[6]研究了煤中氯在高温水中的变迁和脱除规律,在350 ℃, 15 Mpa, 水流量580 mL/h条件下,反应1 h,煤中氯的脱除率达到65.8 %。Okajima等[7]研究了溴化环氧树脂在高温水中的分解行为,在300 ℃, 25 MPa条件下,反应30min,树脂脱溴率达到98 %。Brebu[8]采用高温KOH溶液处理含溴聚苯乙烯塑料,在 280 ℃、7 MPa 条件下,脱溴率达到80 %~90 %,得到可回用的聚苯乙烯塑料,并以KBr形式回收了溴。邻溴苯酚是溴阻燃剂四溴双酚 A的典型热解产物,广泛存在于线路板和含溴塑料的热解油中。已有研究表明此物质是生成多溴代二苯并二口恶 英(简称PBDD)和多溴代二苯并呋喃(简称PBDF)等剧毒物质的前驱体,有氧条件下易生成二口恶 英类物质,具有较大的环境风险[9-10]。目前关于溴阻燃剂在高温水热条件下的具体降解行为研究较少,本文利用间歇反应器,研究邻溴苯酚在高温液态水中的脱溴和降解动力学,以期为水热技术处理含溴塑料或含溴热解油提供参考。
1 试验部分
1.1 试剂
邻溴苯酚(≥98 %),Lancaster 试剂;溴化钾,分析纯;碳酸钠、氢氧化钠,优级纯,国药集团上海化学试剂公司;乙酸乙酯和N,O-双(三甲基硅烷基)三氟乙酰胺(简称BSTFA)由美国Sigma公司提供;去离子水,自制。
1.2 试验设备及方法
试验采用SUS316不锈钢管式反应器,长10 cm,外径10 mm,体积为6 cm3,可操作压力为25 Mpa。试验用自制盐浴炉加热,所用的盐为KNO3和NaNO3按质量比为1 :1混和,温度可达500 ℃。
移取一定浓度和体积4 mL的邻溴苯酚溶液至间歇反应器中,充氮气3min后立即密封反应器,将反应器投入一定温度的盐浴装置中反应,反应过程中不断摇晃振荡反应器。反应预定时间后立即取出反应器,放入冷水槽中冷却,打开反应器取样分析。
1.3 分析方法
(1) 定量分析
采用离子色谱分析溶液中 Br离子浓度,并依此计算邻溴苯酚的脱溴率。离子色谱分离柱为IonPacAS9-HC,淋洗液浓度1.8 mmol/L Na2CO3~1.7 mmol/L NaHCO3,自动再生抑制器电流50 mA,淋洗液流速为1.0 mL/min,进样体积为20 μL。采用HPLC分析邻溴苯酚的浓度,HPLC色谱条件为:Shim-pack C18(250 mm×4.6 mm i.d.,5 μm);流动相为乙腈和水,体积比为55 :45;流速为1.0 mL/min;紫外检测器,检测波长为278 nm;进样体积为20 μL。
(2) 降解产物GC-MS分析
取3 mL样品用HCl溶液调节pH值至2~3,并加入NaCl至饱和,然后用一定量的乙酸乙酯萃取3次,合并有机相,经无水硫酸钠脱水后,80 ℃水浴条件下浓缩至1 ml。用乙酸乙酯将浓缩液移至安瓿瓶中,用高纯氮吹至0.5 mL并迅速加入一定量的BSTFA进行衍生化。将安瓿瓶封口后在100 ℃恒温下反应1 h后取出,用美国热电公司的GC-MS联用仪分析。色谱条件:DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度200 ℃,炉温70 ℃,保留2min,以15 ℃·min-1升温至250 ℃,保留10min。载气为高纯氦,流速为1.0 mL/min,分流进样,分流比为10 :1。质谱条件为:电离方式EI,电子能量70 eV,质量数范围45~300,溶剂延迟时间3min。
2 结果与讨论
2.1 高温水中的脱溴反应
200 ℃~350 ℃范围的高温液态水的离子积几乎增加了1000倍,其中[H3O+]和[OH-]已接近弱酸或弱碱的浓度[3],具有一定的酸催化和碱催化的功能,因此一些有机物能在其中发生化学反应。图1为300 ℃水溶液中邻溴苯酚和溴离子的浓度随时间的变化曲线。

图1 纯水中的邻溴苯酚和溴离子的浓度变化曲线Fig.1 Concentration of o-bromophenol and Br- in aqueous solution at 300 ℃
由图1可知,邻溴苯酚能在300 ℃的高温水中自行发生分解,反应40min后基本达到平衡。此温度下的水分子具有较大的活性,邻溴苯酚在高温水解离出来的[OH-]的催化作用下,部分苯环上的Br基团被脱除,以溴离子形式进入溶液中。
2.2 碱性物质对脱溴的影响
在温度为300 ℃、邻溴苯酚初始浓度2 mmol/L的条件下,考察了碱性物质对脱溴率的影响,结果如图2所示。
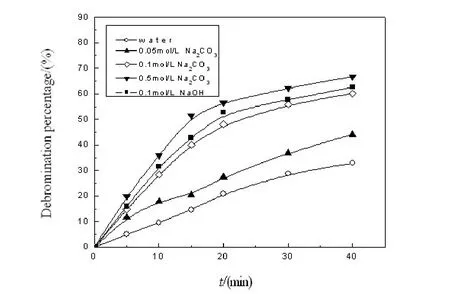
图2 碱性物质对脱溴率的影响Fig.2 The effect of alkaline additives on the debromination percentage
由图2可知,邻溴苯酚在纯水中分解缓慢,反应40min时的脱溴率仅为32.8 %,脱溴程度较低。而在0.05 mol/L碳酸钠溶液中,40min时的脱溴率达到44.1 %,比纯水中的脱溴率提高了34.5 %。当碳酸钠浓度增至0.1 mol/L时,相同条件下,脱溴率提高到60.2 %,比纯水中将近提高1倍。在0.1 mol/L氢氧化钠溶液中,反应40min时的脱溴率可达到62.8 %。由此可见,加入适量的碳酸钠或者氢氧化钠物质后,能有效提高邻溴苯酚的脱溴率。这是因为OH-在高温水溶液中可作为亲核试剂吸引一些包括Br基在内的吸电子基团[11],添加碱性物质能增大溶液中的OH-浓度,因而能够加快由OH-作用下的水解脱溴反应进程。
研究发现提高碳酸钠溶液浓度至0.5 mol/L,反应40min后脱溴率达到67 %, 0.1 mol/L碳酸钠溶液中的脱溴率相比,增幅不大,说明增大碱浓度只能在一定程度上促进水解脱溴过程。
2.3 温度和时间对脱溴的影响
保持其它条件不变,试验考察了0.1 mol/L碳酸钠溶液中,反应温度和反应时间对脱溴率的影响,结果如图3所示。

图3 不同温度下反应的脱溴率随时间的变化Fig.3 Time-course of debromination percentage at different temperature
图 3表明,升高温度和延长时间有利于提高反应的脱溴率,温度越高,脱溴速率越快,到达平衡所需时间越短。在250 ℃条件下反应40min,脱溴率仅为17 %;而当温度升至300 ℃以上时,反应的脱溴率明显提高。325 ℃时,反应15min的脱溴率达到为83.9 %,30min时的脱溴率增至98 %;温度升至350 ℃时,20min的脱溴率接近100 %,基本完成脱溴。温度成为影响邻溴苯酚脱溴的重要因素。温度升高,一方面有利于促进水分子的解离并提高邻溴苯酚的水解脱溴速率,另一方面也能加剧邻溴苯酚在水中的热降解反应,使更多的C-Br键发生断裂,进一步增强脱溴效应。
2.4 降解动力学
对于邻溴苯酚在0.1 mol/L的碳酸钠溶液中分解,采用 − ln (C / C0)= kt 方程来拟合250 ℃~350 ℃范围内的试验数据,结果如图4所示,拟合得到不同温度下的速率常数列于表1中。

图4 邻溴苯酚在0.1mol/L碳酸钠溶液中的降解动力学数据拟合Fig.4 Kinetic fitting for o-bromophenol decomposition in 0.1mol/L Na2CO3 solution
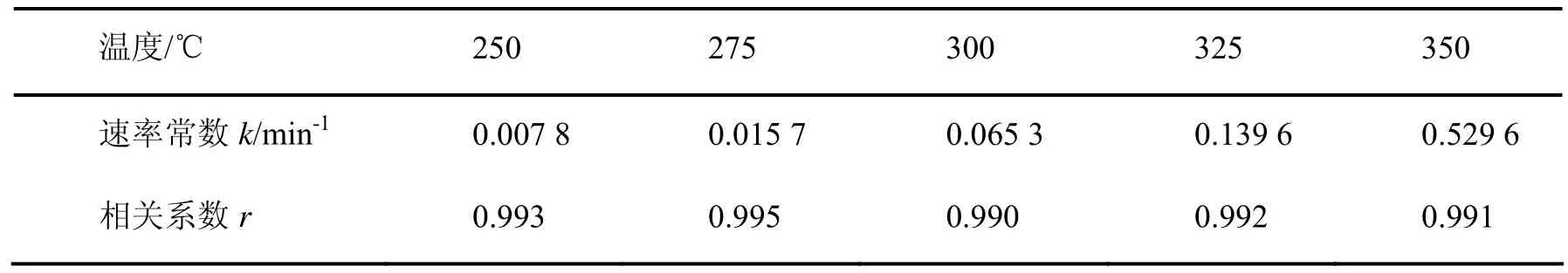
表1 不同温度下的邻溴苯酚高温碱水中的反应速率常数Tab.1 Evaluated rate constants for o-bromophenol decomposition at different temperatures
由图4和表1可知,邻溴苯酚在试验条件下的降解反应可以用拟一级动力学方程式描述,这和乙酸苯酯、苯乙腈等有机物在高温水中的降解规律相近[12-13]。用 Arrhenius公式关联不同温度下的反应速率常数,求得反应的表观活化能Ea为114.7 kJ/mol,指前因子为1.76×109min-1,R2=0.993。
2.5 降解产物分析和降解途径
对邻溴苯酚在高温碱溶液的液相产物进行GC-MS分析,根据据NIST标准数据库定性鉴定了降解产物,结果如图5所示(0.1 mol/L Na2CO3溶液,300 ℃,反应20min)。
由图5可知,溶液中除有未降解的邻溴苯酚(f, RT7.98min)以外,还存在着相对浓度较大的苯酚(c,RT5.50min)和邻苯二酚(g, RT8.29min)物质,此外还检测出少量的邻二甲苯(a, RT3.43min)、2,6-二叔丁基甲酚(h, RT10.01min)等芳香类物质和乙二醇(b, RT4.76min)、2-羟基丙醛(d, RT5.59min)4-羰基戊酸(e, RT6.38min)等脂肪类化合物。卤代酚类物质在高温碱水中的降解过程中会发生许多反应,生成多种产物。Lee等[14]研究氢氧化钠对邻氯酚在超临界水中分解的作用时,在460 ℃、26 MPa反应条件下的分解产物中检测出苯酚、甲酚类物质、2-环戊烯-1-酮以及乙醛,丙酮等一些开环化合物。Uchida[15]发现邻溴苯酚在1 mol/L的氢氧化钠溶液、250 ℃反应3 h,产物中含有苯酚、甲酚、2,2-二甲氧基丙烷和4-羟基-4-甲基-2-戊酮等物质。GC-MS分析结果表明本试验条件下苯酚和邻苯二酚是邻溴苯酚的主要降解产物,与前人研究结果相比,本研究检测出小分子的开环化合物种类不多,一方面可能与反应条件(温度和时间)有关,另一方面也可能与试验装置较小未能收集气相产物进行分析有关。

图5 邻溴苯酚高温碱水分解产物的GC-MS谱图Fig.5 GC-MS chromatogram of o-bromophenol decompositionin 0.1 mol/L Na2CO3 solution at 300 ℃
有机物在高温水中化学反应大致可分为酸碱催化和自由基反应两种类型[3]。根据GC-MS分析结果,结合Sun[11]和Lee[14]等人的研究结果,初步推测邻溴苯酚在250 ℃~350 ℃碳酸钠溶液中的降解途径如图6所示:

图6 邻溴苯酚在高温碳酸钠溶液中的主要降解途径Fig.6 Proposed pathways for o-bromophenol decomposition in hot Na2CO3 solutions
3 结论
(1) 250 ℃~350 ℃的高温水自身具有酸、碱催化作用,邻溴苯酚高温水解离出来的[OH-]的催化作用下自行发生分解脱溴反应。升高温度和添加碱性物质均能显著提高反应的脱溴率。0.1 mol/L碳酸钠溶液中,在350 ℃,反应20min条件下,脱溴率接近100 %。
(2) 在250 ℃~350 ℃、0.1 mol/L碳酸钠溶液中,邻溴苯酚的降解反应符合拟一级动力学规律。通过拟合不同反应温度下的速率常数,求得降解反应的活化能为114.7 kJ/mol,指前因子为1.76×109min-1。
(3) 邻溴苯酚在高温碱水中的降解产物种类较多,苯酚和邻苯二酚是主要产物,邻溴苯酚主要通过水热和水解两种途径进行降解脱溴。
[1]陈烈强, 黄斯珉, 陈源.电视机外壳热解油中1,2,4,5-四溴苯催化脱溴研究[J].环境科学学报, 2009, 29(10):2148-2151.
[2]CORNELIA V, MIHAI A B, TAMER K, et al.Feedstock recycling from plastics and thermosets fractions of used computers.Ⅱ[J].Pyrolysis Oil Upgrading.Fuel, 2007, 86(4):477-485.
[3]AKIYA N, SAVAGE P E.Roles of water for chemical reactions in high-temperature water[J].Chemical Reviews, 2002, 102:2725-2750.
[4]吕秀阳, 何龙, 郑赞胜,等.近临界水中的绿色化工过程[J].化工进展, 2003, 22(4):477-480.
[5]KRUSE A, DINJUS E.Hot compressed water as reaction medium and reactant 1.Properties and synthesis reactions[J].Journal of Supercritical Fluids, 2007, 39:362–380.
[6]王宝凤, 李文, 李保庆,等.煤中氯在亚临界水条件下的变迁[J].燃料化学学报, 2007, 35(5):518-522.
[7]OKAJIMA I, SUGETA T, SAKO T.Decomposition and debromination of flame-resistant polymers containing bromine atoms with subcritical water[J].Kobunshi Ronbunshu, 2001, 58(12):692-696.
[8]BREBU M, BHASKAR T, MUTO A, et al.Alkaline hydrothermal treatment of brominated high impact polystyrene (HIPS-Br) for bromine and bromine-free plastic recovery[J].Chemosphere, 2006, 64:1021-1025.
[9]Söderström G, MARKLUND S.PBCDD and PBCDF from incineration of waste-containing brominated flame retardants[J].Environmental Science&Technology, 2002, 36:1959-1964.
[10]EVANS C S, DELLINGER B.Mechanisms of dioxin formation from the high-temperature pyrolysis of 2-bromophenol[J].Environmental Science&Technology, 2003, 37:5574-5580.
[11]SUN Z, TAKAHASHI F, ODAKA Y, et al.Effects of potassium alkalis and sodium alkalis on the dechlorination of o-chlorophenol in supercritical water[J].Chemosphere, 2007, 66:151-157.
[12]鹿骋, 吕秀阳, 何龙,等.高温高压水中乙酸苯酯五催化水解反应动力学[J].化学反应工程与工艺,2004, 20(3):218-222.
[13]石超君, 吕秀阳.近临界水中苯乙腈无催化水解反应动力学[J].高校化学工程学报, 2009, 23(2):252-257.
[14]LEE G, NUNOURA T, MASTSUMURA Y.Effects of a sodium hydroxide addition on the decomposition of 2-chlorophenol in supercritical water[J].Industrial & Engineering Chemistry Research,2002, 41:5427-5431.
[15]UCHIDA M, FURUSAWA M, OKUWAKI A.Decomposition of 2-bromophenol in NaOH solution at high temperature[J].Journal of Hazardous Materials, 2003:231-238.
