水蛭素的提取及含量测定
2010-04-25田丽华刘利成
田丽华,刘 娟,刘利成
(1.佳木斯大学药学院,黑龙江 佳木斯 154007;2.佳木斯大学生药学研究生,黑龙江 佳木斯 154007)
水蛭素是从水蛭中提取的一种酸性多肽,在临床上多用于治疗不稳定性心绞痛(USA),急性心肌梗死(AM),血管形成术,血液透析,体外循环,肾移植(CRRT),弥漫性血管内凝血(DIC)等病症。
天然水蛭素的分离与纯化主要包括从活体水蛭素和干水蛭中分离提取水蛭素。传统的水蛭素的获得是对水蛭的一次性掠夺,而本实验采用诱导方法对活体水蛭素的提取,避免了传统方法对水蛭的一次性掠夺,保护了水蛭的野生资源,又带动了水蛭养殖业的发展。国内曾报道了一种能利用水蛭反复吸血并用其嗉囊消化液为原料,既不杀死水蛭又能提取批量水蛭素的方法。
水蛭素的含量测定方法有多种,如生物底色法、凝血酶滴定法、光散射法、酶联免疫法吸附测定法、同位素标记示踪法等。本实验采用凝血酶滴定法,1970年 Markwardt报道了凝血酶滴定法,其原理是根据水蛭素与凝血酶结合比例为1:1(mol/mol)和1:5(g/g)。凝血酶的国际单位 N IH,水蛭素的活性以抗凝血酶活力单位 ATU表示,一个 AU T等于中和一个 N IH凝血酶的水蛭素量。
1 实验仪器、材料及试剂
本实验所用水蛭购于山东省济宁市,经佳木斯大学药学院生药学教研室主任刘娟教授鉴定。
BSZ-2型自动双重纯水蒸馏仪(上海之信仪器有限公司),5μL微量进样器 (上海安亭微量进样器厂),10μL微量进样器(上海安亭微量进样器厂),酶示板。
凝血酶(北京生物制品研究所);纤维蛋白原(上海市生物制品研究所);双重蒸馏水(自制);L-精氨酸(北京生物制品研究所);牛肠系膜 (佳木斯肉联厂 );氯化钠(分析纯);生理盐水(黑龙江省肇东市华富药业有限责任公司)。
2 实验方法
2.1 诱导法
本实验对活体的诱导有两种方法,一种用不同浓度的氯化钠溶液组成的诱导系统,对活体水蛭进行诱导,收集水蛭唾液腺分泌物,测定水蛭素含量,比较结果。
另一种是用氯化钠和 L-精氨酸组成的诱导系统,对活体水蛭进行诱导,测定水蛭素含量,比较结果。
2.1.1 不同浓度的氯化钠溶液诱导
配制浓度为0.9%的氯化钠溶液(即生理盐水),分别稀释至浓度为0.45%和0.225%的氯化钠溶液(即1/2生理盐水和1/4生理盐水),装入3个小试剂瓶里,用牛肠系膜封口组成诱导系统,对活体水蛭进行诱导,观察水蛭的反应,收集其唾液,分别用凝血酶滴定法进行含量测定,选择最佳诱导条件。
2.1.2 氯化钠加 L-精氨酸诱导
配制150mm的氯化钠溶液,分别装于5个小试剂瓶中,分别加入 1mmol、 2mmol、 4mmol、 6mmol的 L- 精氨酸 ,用牛肠系膜封口组成诱导系统,对活体水蛭进行诱导,观察水蛭的反应,收集其唾液,分别用凝血酶滴定法进行含量测定,选择最佳诱导条件。
2.2 凝血酶滴定法
2.2.1 凝血酶滴定法原理
本实验对水蛭素的含量采用凝血酶滴定法,其原理是:凝血酶是一种丝氨酸蛋白酶,在止血时起中心作用,在凝血酶的分子表面有一个富含碱性氨基酸的纤维蛋白原识别位点 (FRS)。而水蛭素的 C端含有较多的酸性氨基酸,可以结合在 FRS上,阻止凝血酶与其底物血纤维蛋白原的相互作用,从而达到抗凝血的目的。
2.2.2 凝血酶滴定过程
具体方法如下:配制不同梯度(20NIH/mL,40NIH/mL,80NIH/mL,100NIH/mL)的凝血酶溶液,采用逐步缩小活性范围,多次换管重滴的浓度梯度法,对水蛭素含量进行测定,在酶示板小孔中加200μL0.5%的纤维蛋白原(0.05mol/L)Tris-HCL缓冲液(pH7.4)再加入 10-100μL水蛭素溶液,充分混均。用微量注射器吸取标准的凝血酶溶液(20NIH单位 )5μL(即 0.1NIH单位),若在1min内纤维蛋白原发生凝固,即说明已经达到滴定终点。若没有发生凝固,则换取40NIH/mL单位的凝血酶溶液进行滴定,若仍没有凝固,则逐步扩大范围直至确定活性范围。
3 结果
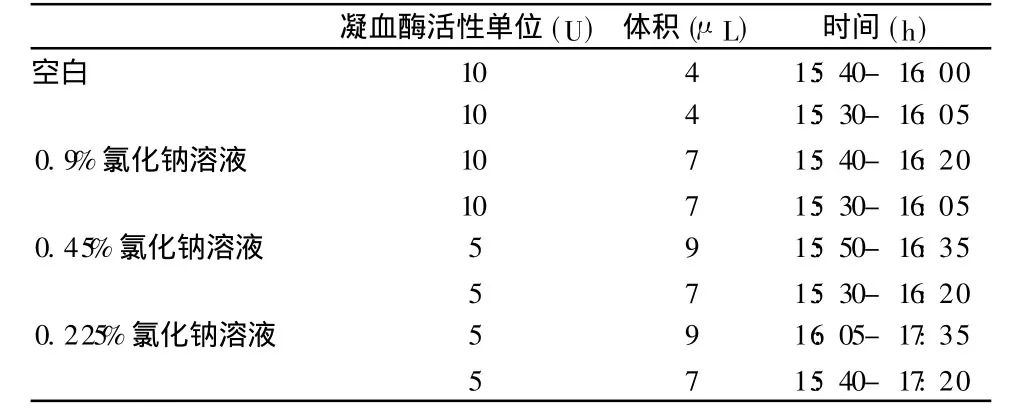
表1 氯化钠溶液诱导结果

表2 氯化钠+L-精氨酸诱导结果(U=40)
4 结论
通过应用仿生诱导的方法对活体水蛭进行诱导后比较发现,当诱导溶媒为不同浓度氯化钠溶液时,其最佳的提取浓度为0.9%,也就是生理盐水组的提取效果较好。当诱导溶媒为氯化钠+L-精氨酸时,发现150mL NaCl加 4mL-精氨酸组的效果最好,能够得到最大剂量的水蛭素。综合两种诱导溶媒发现,诱导溶媒为氯化钠+L-精氨酸的效果较好。
本实验对水蛭素含量测定采用改进后的凝血酶滴定法,即逐步缩小活性范围,多次换管重滴的浓度梯度法,对水蛭分泌的唾液进行含量测定时,具有节省时间,重复性和准确度都较好的优点。
