溶剂与pH值对溶胶凝胶法制备LiFePO4/C的影响
2010-04-21高明霞俞永标
林 燕,高明霞,俞永标
(1.台州学院物理与电子工程学院,浙江台州 318000;2.浙江大学材料科学与工程学系,浙江杭州 310027;3.浙江台州电业局,浙江台州 317000)
磷酸铁锂(LiFePO4)具有橄榄石型结构,空间群为pnma,是一种极具潜力的锂离子电池正极材料[1]。其理论比容量为170mAh/g,相对于锂的电极电势为3.45 V。由于LiFePO4原料价格低廉、环境友好、循环稳定性好、可逆性好、安全性好等一系列优点引起了广泛关注,极有潜力成为新一代锂离子动力电池正极材料。但LiFePO4室温下较低的电导率(10-9S/cm)制约了其实用化。目前,对LiFePO4电导率进行改善的方法有:(1)表面碳包覆[2-3],可提高颗粒之间的电接触,并且抑制颗粒长大;(2)对Li位[4-6]或铁位[7-8]进行高价金属元素的掺杂。此外,不同的合成制备方法,如溶胶凝胶法[9-10]、水热法[11]、共沉淀法[12]和超声波喷雾干燥法[13]等也不断地被研究和开发,以获得颗粒尺寸小且分布均匀的LiFePO4,从而缩短充放电时Li+在颗粒内部的迁移距离,提高该材料的倍率性能。
溶胶凝胶法因能使材料达到分子级水平的混合,而广泛应用于纳米及亚微米级粉末的合成。但溶胶凝胶法中溶剂的种类、溶胶的pH值、反应温度和溶质的浓度等对溶胶凝胶过程中的水解和缩聚反应有重要的影响,并最终影响合成产物的性能[14]。本文采用溶胶凝胶法,以硝酸铁为铁源,柠檬酸为络合剂及碳源合成锂离子电池正极材料磷酸铁锂,研究了不同合成条件如采用不同的溶剂,调节溶胶的pH值等对LiFe-PO4/C的结构和电化学性能的影响。
1 实验
1.1 LiFePO4/C的制备及其微观结构表征
将等摩尔量的硝酸锂、磷酸二氢铵和硝酸铁(均为分析纯)分别加入到一定量的蒸馏水、无水乙醇和乙二醇中。随后再加入与铁离子等摩尔量的柠檬酸(分析纯),升温搅拌至凝胶形成。凝胶经干燥后研磨成粉,置于管式电阻炉内,在N2+5%H2气氛中经700℃烧结10 h得到样品。选取上述电化学性能最好的体系,进一步调节溶胶pH值,合成LiFePO4/C样品。
样品的物相采用多晶X射线衍射仪分析 [日本Rigaku D/max-3B,Cu靶,0.02(°)/s]。样品的微观形貌采用场发射扫描电镜(SEM,Philips-FEI公司的SIRION-100型)进行观察。碳含量采用Flash EA1112元素分析仪(ThermoFinnigan公司)进行测量,碳结构采用拉曼光谱分析仪(Nicolet公司,A lmega Dispersive Raman)在室温下以532 nm波长的激光进行测试。
1.2 电池组装及电化学性能测试
将质量比为83︰12︰5的活性物质、导电剂和粘结剂,与NMP(1-甲基-2-吡咯烷酮,分析纯)调成浆料,搅拌均匀并涂于一定面积的圆形铝片上,在110℃下干燥12 h得到正极。以纯锂片为对电极,ENTEK聚乙烯多孔膜为隔膜,1mol/L LiPF6的碳酸乙烯酯(EC)/碳酸二甲酯(DMC)(体积比为1︰1)的混合溶液为电解液,在水氧含量均小于0.1×10-6的LABSTAR手套箱中组装成CR2025扣式电池。采用LAND恒流充放电测试系统对电池进行充放电实验。
2 结果与讨论
2.1 溶剂对合成LiFePO4/C的结构及电化学性能的影响
由于蒸馏水、无水乙醇、乙二醇等三种溶剂的极性、极矩及对活泼质子的获取不同,对溶胶中发生交换反应时产生了不同的影响。其中,以蒸馏水为溶剂时,实验采用的先驱体不含可以发生缩聚反应的活性基团,相互间不可能发生反应而联结起来,因此产物之间的交联只是通过升温搅拌蒸发溶剂使产物靠近得以氢键相联而成凝胶[15]。以无水乙醇为溶剂时,当加入柠檬酸后瞬间成了凝胶,主要是柠檬酸与无水乙醇发生了较强的聚合反应,瞬间形成了连续的三维网络结构。而乙二醇为溶剂时,可能其与柠檬酸的聚合反应较弱,经过一定时间后形成凝胶。
图1是采用不同溶剂合成的LiFePO4/C的XRD图。可见,样品在物相组成上没有明显区别,都生成了LiFePO4主相和少量FeP、Fe2P相。样品的显微形貌如图2所示。由不同溶剂合成的LiFePO4/C样品均存在团聚现象。
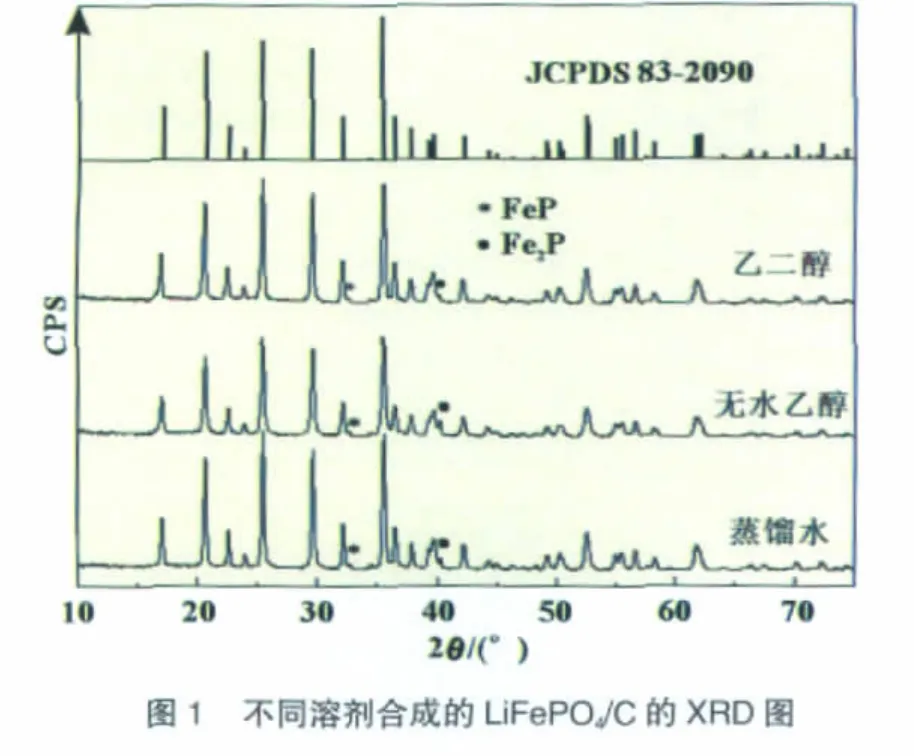
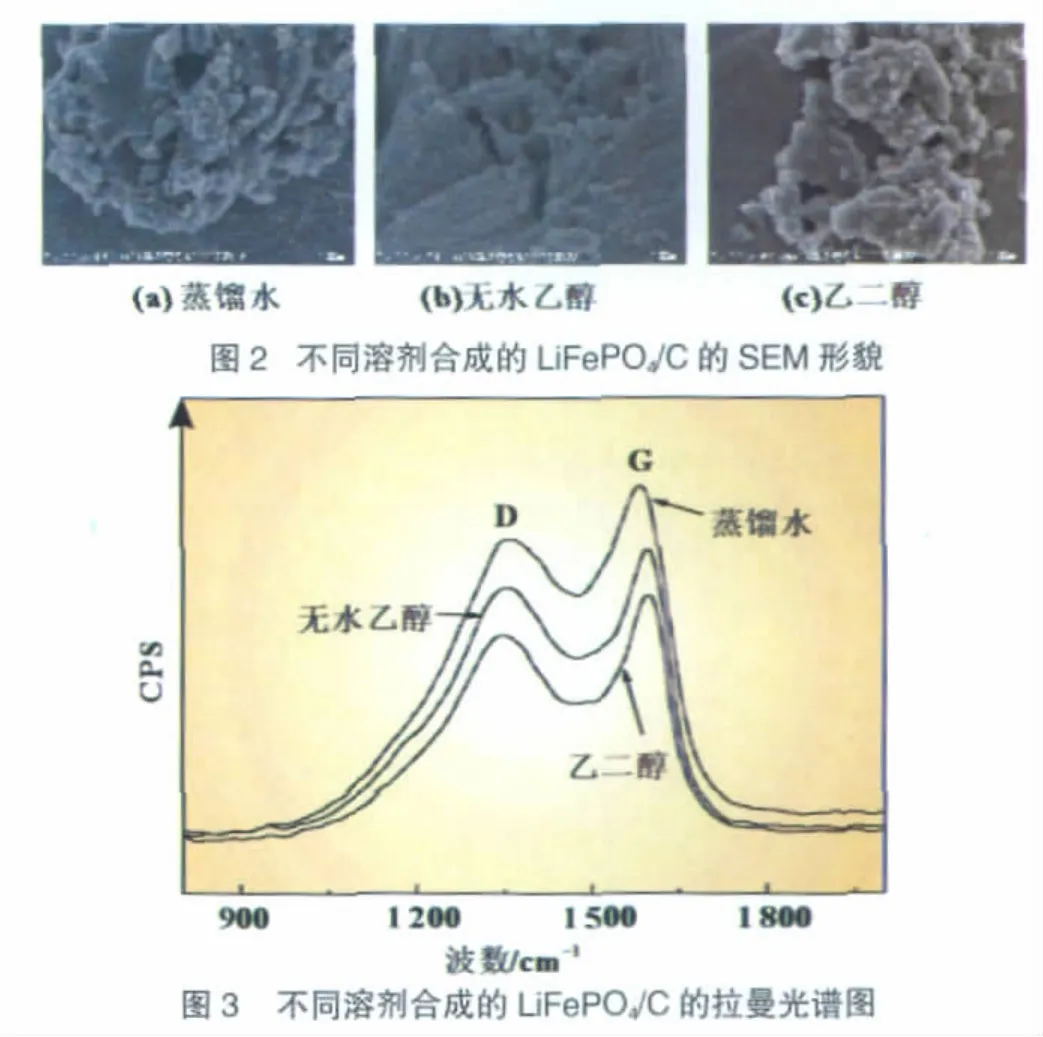
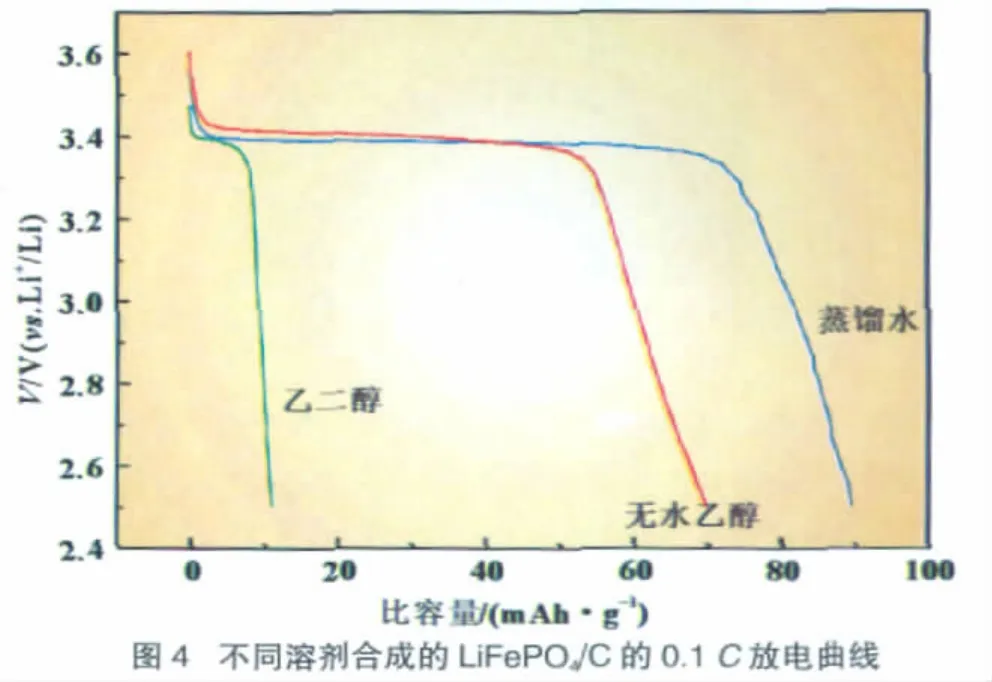
图3为由不同溶剂制备所得LiFePO4/C样品的拉曼光谱图。由图可得,不同溶剂制备的LiFePO4/C具有相似的峰形,较强的Raman峰均出现于1 580 cm-1和1 350 cm-1附近。前者是与多晶石墨相似的反映有序结构的G峰,它对应于石墨层中两个邻近碳原子的相反方向运动所形成的振动模式,而后者是反映sp2态碳的有限尺寸效应或/和缺陷导致的对称性降低产生的D峰。Doeff等[16]指出碳包覆LiFePO4的性能改善情况与所包覆碳的结构有关。优化碳的结构使其石墨化程度更高,能更有效地提高LiFePO4的倍率性能。通常认为,1 350 cm-1和1 580 cm-1处Raman峰强度之比ID/IG是表征各种碳材料石墨化程度的重要参数[17]。计算得到图中样品的ID/IG比值相近,约为0.86,可见上述不同溶剂对合成产物中包覆碳的结构无明显影响。
图4是上述样品在0.1C(1C=170mA/g)的放电曲线。样品都具有3.4 V(vs.Li+/Li)的放电平台,这是LiFePO4作为锂离子电池正极材料典型的特征之一。其中以蒸馏水为溶剂制得的LiFePO4/C具有最高的放电容量90mAh/g。样品的电化学性能较差的主要原因是颗粒的严重团聚,使得充放电时Li+在颗粒内部的迁移距离增加,导致LiFePO4的利用率大大降低。
2.2 溶胶pH值对LiFePO4/C的结构及电化学性能的影响
对上述电化学性能较好的以蒸馏水为溶剂的溶胶凝胶过程进行pH调节,分别在溶胶pH值为0(未调节pH值)和2时合成样品。在pH值为2时,澄清草绿色溶胶瞬间变成了淡绿色凝胶。
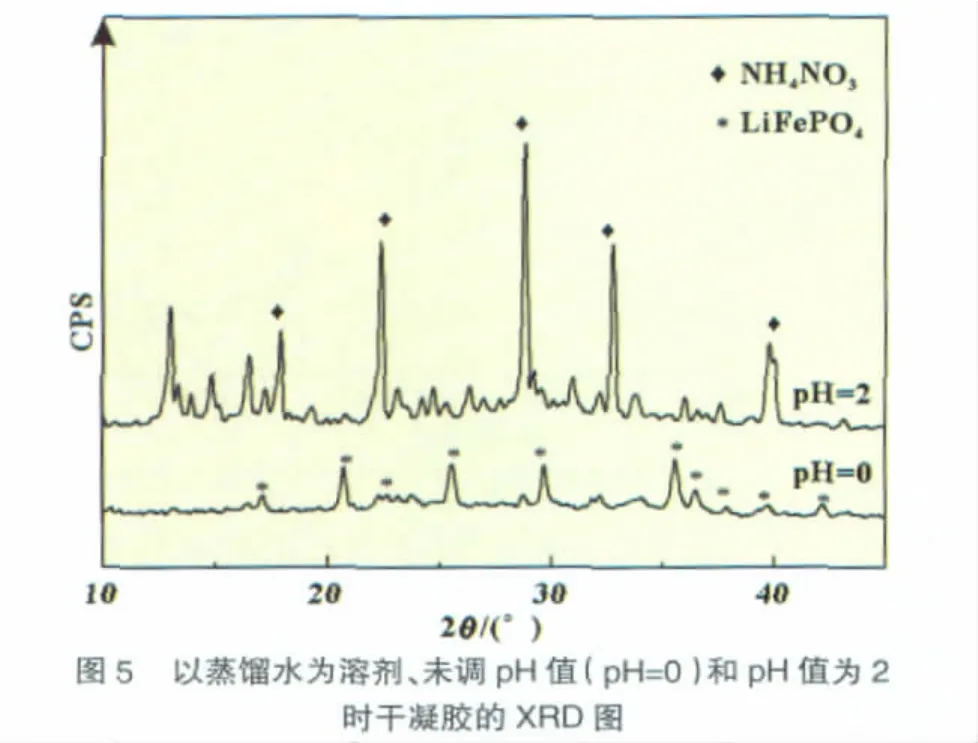
图5是未调pH值(0)和pH为2时所得干凝胶的XRD图。可见,未调pH值的干凝胶出现了较强的LiFePO4衍射峰,而pH为2的干凝胶的衍射峰除了硝酸氨和含碳氢氧氮化合物的衍射峰外,并未出现含Li+、Fe3+和PO43-的化合物的衍射峰。可以推断调节溶胶pH值为2时,可以提高Li+、Fe3+和PO43-在干凝胶中分布的均匀性。
pH值为2的凝胶合成的样品具有与pH值为0的样品基本相同的XRD衍射峰特征,主相仍为LiFePO4,溶胶pH值对样品的物相组成没有明显影响。图6为pH为2的干凝胶烧结得到样品的SEM形貌,其颗粒尺寸较未调节pH值时[图2(a)]明显减小,分散程度大大改善。通常,溶胶pH值可改变金属阳离子与络合剂的络合情况。本实验中,pH值的增加有可能提高了金属阳离子在有机物中分布的均匀性,提高了碳源在凝胶中分布的均匀性,从而使LiFePO4/C产物的颗粒尺寸减小,分布均匀性得到提高。
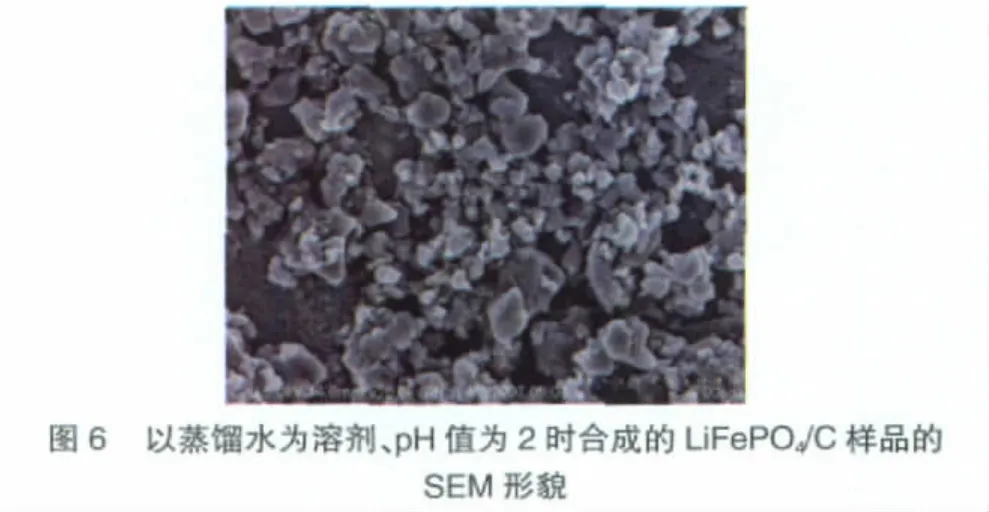
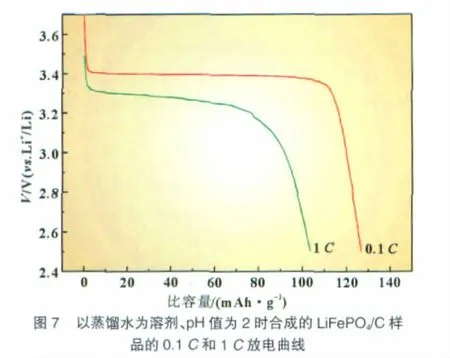
图7是由以蒸馏水为溶剂、pH值为2的干凝胶烧结得到的LiFePO4/C样品在0.1C和1C下的放电曲线。对比未调pH值的LiFePO4/C样品的0.1C放电曲线(图4),其平台电压没有明显变化,但放电比容量却由90mAh/g上升到了近130mAh/g,提高了近45%。其1C放电比容量达到了105 mAh/g。溶胶pH值为2时,样品电化学性能改善的主要原因是颗粒分散性的改善和尺寸分布均匀性的提高。
3 结论
以Fe3+为铁源,柠檬酸为络合剂及碳源,采用溶胶凝胶法制备了LiFePO4/C粉末。采用蒸馏水、无水乙醇和乙二醇为溶剂,均能得到高LiFePO4相含量的产物,但产物均存在严重的团聚现象,其中以蒸馏水为溶剂合成的LiFePO4/C样品具有相对较高的放电容量。进一步对以蒸馏水为溶剂的溶胶进行pH调节的研究结果表明,当pH为2时样品的物相组成没有发生明显变化,但LiFePO4/C颗粒尺寸减小,分散性显著提高,其0.1C容量提高了近45%,为130mAh/g,其1C容量为105mAh/g。溶胶pH值对合成LiFePO4/C的颗粒尺寸有明显的影响。
[1]PADHIA K,NANJUNDASWAMY K S,GOODENOUGH J B.Phospho-olivines as positive-electrode materials for rechargeable lithium batteries[J].Journal of the Electrochem ical Society,1997,144(4):1188-1194.
[2]HUANG H,YIN SC,NAZAR L F.Approaching theoretical capacity of LiFePO4at room temperature at high rates[J].Electrochemical and Solid State Letters,2001,4(10):A170-A172.
[3]BELHAROUAK I,JOHNSON C,AM INE K.Synthesis and electrochem ical analysis of vapor-deposited carbon-coated LiFePO4[J].Electrochemistry Communications,2005,7(10):983-988.
[4]CHUNG SY,BLOKING JT,CHIANG Y M.Electronically conductive phospho-olivines as lithium storage electrodes[J].Nature Materials,2002,1(2):123-128.
[5] HERLE PS,ELLIS B,COOMVSN,et al.Nano-network electronic conduction in iron and nickel olivine phosphates[J].Nature Materials,2004,3(3):147-152.
[6] 陈学军,赵新兵,曹高劭,等.一步固相合成Nb掺杂LiFePO4/C及其电化学性能[J].中国有色金属学报,2006,16(10):1665-1671.
[7] WANG G.X,BEWLAY S,NEEDHAM S A,et al.Synthesis and characterization of LiFePO4and LiTi0.01Fe0.99PO4cathodematerials[J].Journal of the Electrochem ical Society,2006,153(1):A25-A31.
[8] WANG D Y,LIH,SHISQ,etal.Improving the rate performance of LiFePO4by Fe-site doping[J].Electrochim ica Acta,2005,50(14):2955-2958.
[9] YANG J S,XU J J.Nonaqueous sol-gel synthesis of high-performance LiFePO4[J].Electrochem ical and Solid State Letters,2004,7(12):A515-A518.
[10]HSU K F,TSAY SY,HWANG B J.Synthesisand characterization of nano-sized LiFePO4cathodematerials prepared by a citric acidbased sol-gel route[J].Journal of Materials Chemistry,2004,14(17):2690-2695.
[11] 庄大高,赵新兵,曹高劭,等.水热法合成LiFePO4的形貌和反应机理[J].中国有色金属学报,2005,15(12):2034-2039.
[12]PARK K S,SON JT,CHUNG H T,et al.Synthesis of LiFePO4by co-precipitation andmicrowave heating[J].Electrochemistry Communications,2003,5(10):839-842.
[13] YANG M R,TENG T H,WU S H.LiFePO4/carbon cathode materials prepared by ultrasonic spray pyrolysis[J].Journal of Power Sources,2006,159(1):307-311.
[14] HENCH L L,WEST JK.The sol-gel process[J].Chem ical Review,1990,90:33-72.
[15]SEGAL D.Chem ical Synthesisof Advanced Ceramic Materials[M].Cambridge:Cambridge University Press,1989:144-145.
[16]DOEFFM M,HU Y Q,MCLARNON F,etal.Effectof surface carbon structure on the electrochemical performance of LiFePO4[J].Electrochem icaland Solid State Letters,2003,6(10):A 207-A 209.
[17] GEN K.Raman spectroscopy of graphite and carbonmaterials and its recentapplication[J].Carbon,1997,35(5):716.
