谷氧还蛋白和硫氧还蛋白对动物抗氧化应激生物学效应的研究进展
2010-04-17黄金昌郭荣富
黄金昌 郭荣富
(云南农业大学云南省动物营养与饲料重点实验室,昆明 650201)
氧化应激使动物体内氧化与抗氧化作用失衡,其实质是自由基在机体内产生的一种负面作用[1]。目前,在研究抗氧化酶的过程中,许多学者已逐渐认识到非酶系统在抗氧化反应中的重要作用[2]。谷氧还蛋白(glutaredoxin,Grx)和硫氧还蛋白(thioredoxin,Trx)分别是抗氧化酶系统和抗氧化非酶系统的重要成员[3],具有强大的抗氧化作用,发挥着维持细胞内的氧化还原稳态、抗衰老以及肠道保护生物学效应等作用。在此基础上,若对抗氧化酶系统和抗氧化非酶系统同时进行研究,则有可能为动物抗氧化应激和肠道保护生物学效应提供新的研究途径和技术支撑。本文就Grx和Trx的结构和功能以及对动物的抗氧化机制方面的研究进行综述,旨在为动物抗氧化应激和肠道保护的研究与技术应用提供重要参考。
1 Grx和Trx的结构与功能
1.1 Grx的结构与功能
Grx,又称巯基转移酶,普遍存在于细菌、病毒和哺乳动物体内,分子量约为12 ku,由106或107个氨基酸组成,是巯基-二硫键氧化还原酶家族的重要组分,通过催化谷胱甘肽(GSH),与蛋白质二硫键之间进行氧化还原反应,修复蛋白质活性[4]。Grx是一种多效性细胞因子,具有多种生物学功能,参与氧化应激和抗细胞凋亡等[5]。在细胞质正常的生理状态下,Grx、GSH、谷胱甘肽还原酶(GR)和还原型烟酰腺嘌呤二核苷酸磷酸(NADPH)构成一套Grx酶体系,用于催化二硫键与巯基之间的氧化还原反应[6]。Grx活性中心的氨基酸序列为-Cys-Pro-Ty r-Cys-,其中半胱氨酸(Cys)为催化基团。在空间结构上,Grx有3个活性区域(图1),即巯基-二硫键活性中心、GSH结合位点和疏水性表面区域[7]。Lundberg等[8]报道,Grx家族(Grxs)逐渐扩大,新的Grxs成员不断被发现,诸如:谷氧还蛋白1 (G rx1)存在于细胞液中,分子量为12 ku,由106或107个氨基酸残基组成;谷氧还蛋白2(Grx2)分布在线粒体和核膜上,分子量为18 ku,结构上与谷胱甘肽硫转移酶(GST)超家族蛋白质相似,但是却显示典型的Grx活力,Grx1的抗氧化作用明显强于Grx2,但其具体生理作用目前尚不明确。
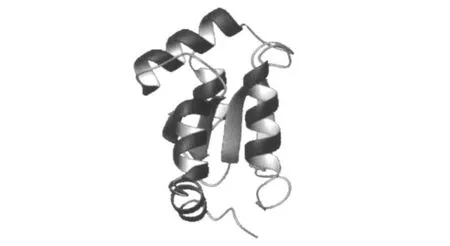
图1 人谷氧还蛋白的结构Fig.1 Struc ture of hum an glutaredoxin
1.2 Trx的结构与功能
Trx最初是在植物叶绿体中发现的,广泛存在于原核和真核生物中,是一种由104个氨基酸组成的低分子量(12 ku)和热稳定的酸性蛋白质[9]。其三维结构是一个紧密的球状蛋白质,含有5个β-折叠和4个α-螺旋,β-折叠被α-螺旋包围形成一个紧密的球状结构的蛋白质(图2),含有高度保守的-Cys-Gly-Pro-Cys-氧化还原调节活性位点序列,具有抗氧化、促进细胞生长、调节细胞凋亡和转录调节以及趋化等作用。氧化型的Trx含有二硫键,还原型的Trx含有巯基(图3),Trx的氧化反应过程是通过可逆的二硫键和二巯基可逆转换完成酶活力调节蛋白质的作用[10]。目前在硫氧还蛋白家族(Trxs)中,主要有硫氧还蛋白1(Trx1)和硫氧还蛋白2(Trx2)2个类型,它们在细胞抗氧化方面发挥着重要作用[11]。Trx1是一个氧化还原蛋白,其作用是调节细胞的氧化还原。除了催化位点上的2个Cys残基,还有另外3个Cys残基(Cys-62、Cys-69和Cys-73)。这些结构性残基不属于活性位点,但是与主要的蛋白质构型有关,它们的氧化会导致酶活性的丧失[12]。Trx2仅位于线粒体中,有1个保守的Trx催化位点和由60个氨基酸组成的N-末端延伸,其可能是线粒体引导序列,应用Western Blotting技术已证实了Trx2的线粒体定位[13]。
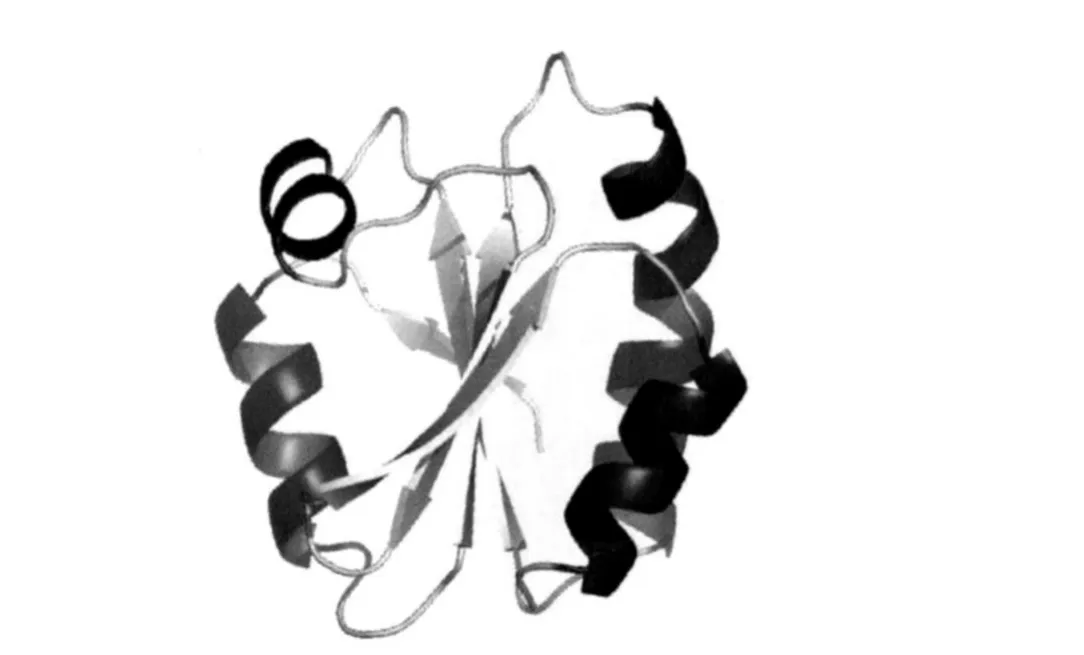
图2 人硫氧还蛋白结构Fig.2 Structure of human thioredoxin

图3 人硫氧还蛋白立体结构模拟图Fig.3 Simulation figure o f stereoscopic struc ture of hum an thioredoxin
1.3 Grx与Trx之间的联系
Grx和Trx是机体内2个重要的抗氧化蛋白,它们有着许多相似之处:1)都是小分子蛋白质;2)都拥有-Cys-X 1-X 2-Cys-活性中心(X 1、X 2可以是除Cys外的任何一种氨基酸);3)都存在于细胞中氧化还原反应密集的部位且都有缓解细胞氧化胁迫的能力;4)在脱氧核糖核苷酸的合成中,均为氢携带蛋白,通过传递氢共同参与脱氧核糖核苷酸的合成[3]; 5)NADPH/Grx/Trx氧化还原调节介导了一条由营养诱导胰岛素分泌的新的信号通路[14]。另外, Grx和Trx系统被视为并行的氧化还原系统,可以独立运行,但G rx能够还原蛋白质二硫化物和蛋白质谷胱甘肽二硫化物,能够补偿Trx系统并拓宽了功能范围,同时还具有其独特的功能。
2 Grx和Trx对动物抗氧化应激的生物学效应
2.1 Grx和Trx的抗氧化机制
Grx的抗氧化机制主要依赖于GSH的巯基-二硫化物转换的反应,对与GSH相连的二硫化物具有高度特异性,维持细胞内蛋白质巯基的稳态,保持细胞内酶或蛋白质的生物学活性,以修复蛋白质活性。Grx在氧化过程中,其活性部位的氨基酸序列是-Cys-Pro-Tyr-Cys-,催化基团为其中的1或2个Cys,因此Grx的抗氧化作用可分为单巯基和双巯基的反应机制(图4)。单巯基机制中,Grx特异性的催化还原与GSH相连的二硫键,反应只需要活性部位N端的巯基。这个反应首先是活性部位N端的巯基亲核进攻GSH上的二硫键,并释放出被还原的去GSH化的分子。反应过程中形成了Grx-GSH反应中间体,接下来被第2个分子的GSH还原,产生氧化型谷胱甘肽(GSSG)[11]。双巯基机制中,G rx催化还原蛋白质中的二硫键。首先, Grx活性部位N端的巯基亲核攻击底物蛋白质的二硫键,形成了Grx与底物蛋白质以二硫键连接的反应中间体,接下来Grx中活性部位C端的巯基攻击中间体的二硫键,反应释放出了被还原的底物。Fernandes等[15]研究发现,在各种氧化应激损伤过程中,谷胱甘肽化蛋白质(Pr-S-S-G)结构最先形成,而Grx的作用主要是对巯基-蛋白质(SH-protein)早期氧化损伤形成的Pr-S-S-G进行修复。因此,在体内的抗氧化防御体系中,Grx发挥着关键作用。
图4 谷氧还蛋白的2种催化反应机制Fig.4 Tw o catalytic mechanisms o f g lutaredoxin
在各种氧化还原环境中,Trx具有多种功能,包括:对核糖核苷酸还原酶和3'-磷酸腺苷-5'-磷酸硫酸(PAPS)-还原酶的还原;对哺乳动物转录因子和激素调控的调节;对生长因子自分泌的调节等。目前普遍认为,Trx的抗氧化效应主要表现在2个方面:第一,Trx能直接作为某些过氧化物酶的电子供体清除活性氧,从而降低脂质过氧化、DNA损伤以及蛋白质的失活[16];第二,作为细胞内蛋白质二硫键还原酶,Trx能还原多种蛋白质(如激酶、磷酸酶和转录因子)的二硫键,从而使其恢复生理功能。Trx与硫氧还蛋白还原酶(thioredoxin reductase, TrxR)和NADPH组成Trx系统,具有清除活性氧及还原二硫键的功能,维持细胞氧化还原稳态,其抗氧化过程见图5。Trx具有保守催化部位(-Cys-Gly-Pro-Cys-),经过可逆的氧化作用形成半胱氨酸二硫化物(Trx-S2),通过还原物转变成含二硫化物的底物(X-S2),氧化型Trx通过TrxR被还原成半胱氨酸巯基化合物﹝Trx-(SH)2﹞形式,还原型Trx可以催化许多含有二硫键的蛋白质的还原反应[17]。

图5 硫氧还蛋白系统抗氧化过程图解Fig.5 The scheme o f antioxidant process o f thioredoxin system
2.2 Grx和Trx与细胞凋亡
Lee等[18]研究证明,Grx能与细胞凋亡信号调控激酶1(apoptosis signal-egulating kinase 1, ASK 1)相连,抑制ASK 1的活性,并且这种相互作用依赖于Grx的氧化还原活性。当ASK 1与还原型的Grx1结合时,ASK 1无活性,而氧化型的Grx1会导致ASK 1的释放而启动细胞凋亡。此外,G rx也可以通过核因子-κB(NF-κB)途径,抑制神经递质多巴胺(DA)对细胞氧化应激损伤所介导的凋亡。ASK 1是通过线粒体通路诱导凋亡,而Trx是ASK 1的直接抑制剂,Trx能直接结合到ASK 1的N端,形成蛋白质-蛋白质复合物,从而抑制了ASK 1的活性以及ASK 1依赖的凋亡[19],其调控过程如图6所示。

图6 硫氧还蛋白抑制细胞凋亡机制Fig.6 M echanism of inhibition apop tosis o f thioredoxin
2.3 Grx和Trx与消化道疾病
消化道既是动物体内物质代谢和能量代谢非常旺盛的系统,又是动物体内最大的内分泌和免疫器官。胃肠道的结构整体性、氧化还原状态、微生物菌群和酶系的平衡状态是保证其正常生理功能的重要因素[20]。由于活性氧族(ROS)引起机体氧化应激,动物消化道器官与肠道黏膜极易遭受损伤,肠内容物渗透压升高,肠道脱水,引起腹泻,严重时导致炎症性肠道疾病。正常情况下,机体细胞内的酶系统和非酶系统的抗氧化作用可清除ROS,使机体ROS的产生和清除处于动态平衡状态[21]。Grx和Trx分别是抗氧化酶系统和抗氧化非酶系统的成员,在酶促与非酶促2个体系中发挥着重要的生物学作用,有效地维持消化道健康,预防疾病的发生。
2.4 Grx和Trx与机体免疫
在氧化应激状态下,为了清除多余的自由基,细胞内形成了大量的防御机制[22]。免疫系统在体内起着应答、防御和监视的功能,由于这一特殊地位,使其能对机体的抗氧化应激发挥着关键性的作用。氧化应激时,动物机体首先将无暇抵御各种细菌、真菌、病毒、寄生虫和肿瘤细胞的侵袭,易发生各种流行性疾病[23]。其次,在氧化应激状态下,免疫细胞受到破坏,然后凋亡而失去功能。Grx和Trx在酶促与非酶促2个体系中通过清除ROS,能够有效地发挥抗氧化应激作用,控制细胞凋亡,提高机体的整体免疫力,在机体内有效地保护免疫器官和组织,在防止免疫细胞的凋亡中发挥着重要生物学作用。
3 展 望
目前对动物抗氧化应激的研究大多数都是以饲料添加剂为切入点。在饲料中添加适量的抗氧化物质(如GSH、维生素C、铜蛋白、硒、硒蛋白和丙氨酰谷氨酰胺等)均可提高机体的抗氧化能力,缓解氧化应激。但这些抗氧化物质均属于添加剂,量多或量少都有产生副作用的可能。Grx和Trx是在人类医学上关于抗氧化研究比较热门的2个功能蛋白,具有清除机体内ROS和控制细胞凋亡的生物学作用,但对其抗氧化作用的研究都是分别进行的。在有关动物的抗氧化应激研究文献中,尚未见到有关Grx和Trx共同发挥抗氧化生物作用的研究报道。因此,Grx和Trx对动物抗氧化应激的研究的重点将有以下几个方面:1)在动物抗氧化应激系统中,抗氧化酶系统和抗氧化非酶系统的协调关系的研究;2) Grx和Trx在抗氧化酶系统和抗氧化非酶系统中的作用以及分子表达调控的相互关系;3)环境因素(如紫外线、高压低氧和温度等)和微量养分(如硒、铁和维生素等)与Grx和Trx表达的分子调控的关系。以上这几个方面将是动物抗氧化应激研究的热点,也必将会为Grx和Trx在动物生产中的应用提供理论依据。
[1] Sand rine D,Eleni R M.Invo lvement o f oxidative stress and NADPH oxidase activation in the development o f cardiovascular comp lications in a mode l of insulin resistance,the fructose-fed rat[J].A therosclerosis,2005,179:43-49.
[2] Powis G,M ontfort W R.Proprties and biological activities of thioredoxins[J].Annual Review of Biophysics and Biomo lecular Structure,2001,30:421-455.
[3] 王丽丽,张秋梅.人抗氧化基因GLRX2、TXN 1的初步研究[J].生物学杂志,2008,25(1):17-20.
[4] Ahn B Y,Moss B.G lutaredoxin homolog encoded by vaccinia virus is a virion-associated enzyme w ith thioltransferase and dehydroascorbate reductase activities[J].Proceedings of the National A cademy of Sciences o f the United States o f Am erica,1992,89 (15):7 060-7 064.
[5] Landino L M,M oynihan K I,Todd J V,et al. Modulation of the redox state of tubulin by the glutathione/glutaredoxin reductase system[J].Biochem ical and Biophysical Research Comm unications,2004,314:555-560.
[6] Holmgren A.Antioxidant function o f thioredoxin and glutaredoxin systems[J].Antioxidants&Redox Signaling,2000,2(4):811-820.
[7] 李 民,冯银刚,高 杨,等.谷氧还蛋白系统及其对细胞氧化还原态势的调控[J].生物物理学报, 2007,23(5):343-350.
[8] Lundberg M,Johansson C,Chandra J.Cloning and expression of a novel hum an glutaredoxin(Grx2) with m itochondrial and nuclear iso form s[J].Journal of Biological Chem istry,2001,276(28):26 269-26 275.
[9] Tamura T,Stadtman T C.A new selenoprotein from hum an lung adenocarcinom a cells:purification, p roperties,and thioredoxin reductase activity[J]. Proceedings o f the National A cademy o f Sciences of the United States of America,1996,(93):1 006-1 011.
[10] Takano H,Zou Y,Hasegaw a H,et al.Oxidative stress-induced signal transduction pathw ays in cardiac m yocytes:invo lvemen t of ROS in heart diseases [J].Antioxidants&Redox Signaling,2003,5:789-794.
[11] 葛 岩.基因工程方法构建含硒谷氧还蛋白[D].博士学位论文.长春:吉林大学,2009.
[12] Burke-Gaffney A,Callister M E,Nakamura H.Thioredoxin:friend or foe in human disease?[J]. Trends in Pharm acological Sciences,2005,26(8): 398-404.
[13] Pow is G,Montfort W R.Proprties and biological activities o f thioredoxins[J].Annual Review o f Bioph ysics and Biomolecular Structure,2001,30:421-455.
[14] M aria A P,Francesco A,Monica M.Vascu lar actions of insulin w ith im plications for endothelial dysfunction[J].American Journal o f Physiology, 2009,297:E568-E577.
[15] Fernandes A P,Fladvad M,Bernd t C,et al.A novelmonothio l glutaredoxin(G rx4)from Escherichia colican serve as a substrate for thioredoxin reductase[J].The Journal of Biological Chem istry,2005, 280(26):24 544-24 552.
[16] W atson W H,Yang X,Choi Y E,et al.Thioredoxin and its ro le in toxicology[J].The Journal o f Toxicological Sciences,2004,78:3-14.
[17] 刘光慧,沈 恂.硫氧还蛋白与心血管疾病[J].生物物理学报,2006,22(6):406-417.
[18] Lee K O,LeeG R,Yoo JY,etal.GSH-dependent peroxidase activity of the rice(Oryza sativa)glutaredoxin,a th ioltransferase[J].Biochem ical and Biophysical Research Communications,2002,6: 1 152-1 156.
[19] 段晓燕,范建高.硫氧还蛋白与肝脏疾病[J].国际消化病杂志,2009,29(2):83-85.
[20] 陈 群.氧化应激对动物消化道结构与功能影响的研究[D].博士学位论文.无锡:江南大学,2007.
[21] Scho ll T O,Leskiw M,Chen X H,et al.Oxidative stress,diet,and the etiology of preeclampsia[J].A-merican Journal o f Clinical Nutrition,2005,81(6): 1 390-1 396.
[22] 钟卫一.硫氧还蛋白-1在实验性急性坏死性胰腺炎大鼠的表达及褪黑素干预的影响[D].博士学位论文.南宁:广西医科大学,2009.
[23] Chen JQ,Cha-M olstad H,Szabo A,et al.D iabetes induces and calcium channel blockers p revent cardiac expression of p roapoptotic thioredoxin-interacting p rotein[J].American Journal of Ph ysiology,2009, 296:E1 133-E1 139.
*Correspond ing au thor,p rofessor,E-m ail:rongfug@163.com
(编辑 菅景颖)
