精氨酸对左旋硝基精氨酸甲酯诱导猪宫内生长受限的缓解作用
2010-04-17瞿明仁游金明王自蕊黎观红丁君辉
叶 帅 瞿明仁 游金明 王自蕊 黎观红 丁君辉
(江西农业大学动物科技学院,南昌 330045)
猪的宫内生长受限(intrauterine grow th retardation,IUGR)(或发育迟缓)是妊娠母猪在缺乏营养、缺氧、药物刺激或胎盘功能不足等情况下引起胚胎原有的发育路线发生改变,以至于造成胎儿发育缓慢,新生仔猪体重偏小、健康状况较差及成活率下降的一种复杂生理现象。在养猪生产中,IUGR不仅是母猪产弱胎、死胎和畸形胎的一个主要原因,而且是仔猪出生后生长受阻、饲料转化效率下降的一个重要原因[1-2]。对于集约化饲养的猪只来说,IUGR多由母猪孕期(尤其是孕中、后期)胎盘运输能力的低下和功能的缺失所引起[2]。由于精氨酸经一氧化氮合酶(NOS)催化后生成的气态信号分子一氧化氮(NO)可以促进血管内皮生长因子(VEGF)的分泌,并对血管的扩张起着举足轻重的作用,而胎儿的营养又主要依靠胎盘的血管运输,这就意味着胎盘血流可能受到NO的直接调节作用和精氨酸的间接调节作用。因此,通过精氨酸的NO信号通路干预胎盘血流就成了调节胎儿营养供给、预防或改善仔猪发生IUGR的理想途径。目前,用1.0%精氨酸提高母猪繁殖性能的研究[2]已有报道,但能揭示其机理的研究还有待于进一步深入。本研究通过NOS抑制剂——左旋硝基精氨酸甲酯(L-NAME)刺激妊娠母猪诱导IUGR的发生,同时以NO通路为主线,探讨精氨酸对猪宫内受限的调节作用,从而为提高母猪的繁殖性能和提高胎儿的生长发育奠定理论基础,为减少IUGR给我国养猪业造成的巨大损失提供技术支持。
1 材料与方法
1.1 试验材料
试验所用L-精氨酸(L-A rg)为L-精氨酸盐酸盐(L-A rg◦HCl),由日本味之素株式会社公司提供,产品纯度为99.0%,L-精氨酸实际含量为81.8%;丙氨酸购自河北省冀州市华阳化工有限公司,纯度≥98.5%;L-NAME购自美国Sigm a公司,纯度≥98.0%,使用时按预试验确定的15.0 m g/kg BW注射剂量准确称取一定质量的LNAME溶解于2.5 m L灭菌蒸馏水中配成LNAME溶液。猪血清NO、总一氧化氮合酶(TNOS)及VEGF试剂盒购自南京建成生物工程研究所。
1.2 试验动物与分组设计
选取胎次(2~4胎)、膘情和预产期相近,健康状况良好的长白×大约克夏妊娠母猪40头,随机分为4个处理:处理Ⅰ(正对照)、处理Ⅱ(L-NAME,负对照)、处理Ⅲ(L-NAME+1.0%L-A rg)、处理Ⅳ(1.0%L-A rg),每个处理10个重复,每个重复1头母猪。自孕85 d开始,连续21 d对处理Ⅱ、Ⅲ母猪于颈背部皮下多点注射2.5 m LL-NAME溶液,每天(09:00~10:00)1次,每次剂量为15.0 mg/kg BW。处理Ⅰ和Ⅳ母猪则以相同方式注射等体积的生理盐水。
1.3 试验饲粮及营养水平
妊娠母猪试验饲粮参照NRC(1998)推荐的营养标准并做适当调整而配制。处理Ⅰ、Ⅱ饲粮为玉米-豆粕型基础饲粮中添加1.7%丙氨酸(等氮处理);处理Ⅲ、Ⅳ饲粮为在基础饲粮中添加1.0%L-精氨酸盐酸盐。饲粮组成及营养水平见表1。
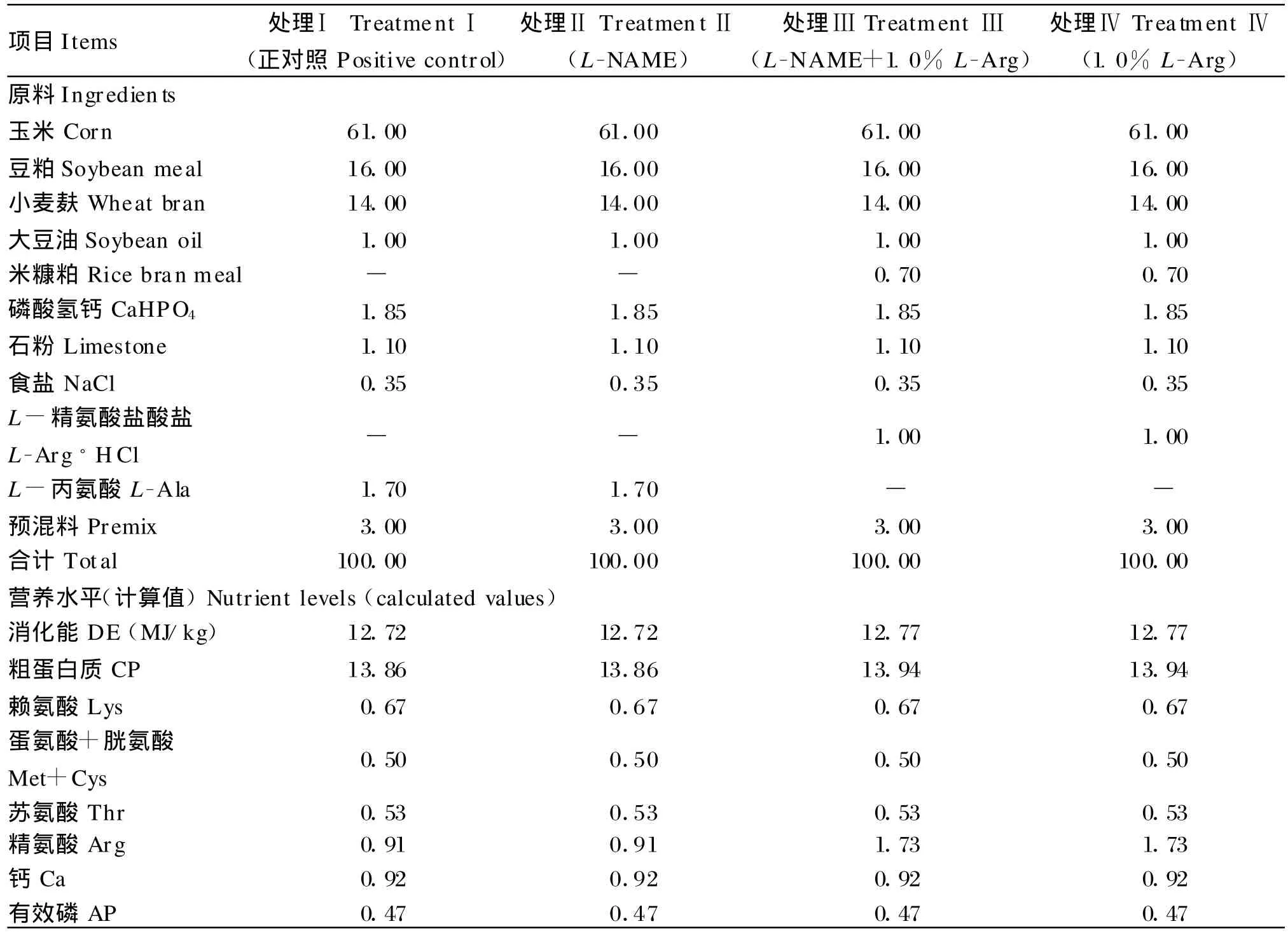
表1 饲粮组成及营养水平(饲喂基础)Tab le 1 Composition and nutrient levels o f diets(as-fed basis,%)
1.4 饲养管理
试验在广东旺大集团南昌试验猪场执行。妊娠母猪单栏饲养,按常规饲养规程限量饲喂。于预产期前7天将试验母猪转入彻底消毒过的产仔舍,饲养于全漏缝地板式的单体限位栏内。舍内保持清洁干燥,通风良好,圈舍温度保持在16~25℃。限制采食,自由饮水。
1.5 测定指标与方法
1.5.1 繁殖性能
于母猪分娩后,记录窝产仔数、窝活仔数、窝仔重、窝活仔重、仔猪初生重及活仔初生重等。根据活仔体重判断IUGR仔猪,判断标准为:BWx<BWc-2SD(即体重低于对照组活胎平均体重减去2倍标准差的仔猪为IUGR猪),并计算IUGR发生率。
1.5.2 血清NO和TNOS的含量
分别于L-NAME注射前和注射结束时(即妊娠第85天、第105天)采集每头母猪耳静脉血液10 m L于采血管,静置1 h后于3 000 r/m in离心10 min,取上清液置于-20℃保存。测定时,采用NO、TNOS分析试剂盒分别测定血清中NO、TNOS的含量。
1.5.3 胎盘血清NO、TNOS及VEGF的含量
于母猪分娩时,采集每头母猪胎盘血液10 m L于采血管,静置1 h后于3 000 r/m in离心10m in,取上清液置于-20℃保存。胎盘血清NO、TNOS含量的测定方法同1.5.2。
于母猪分娩后,从母体面的中央取2 cm×2 cm× 2 cm的胎盘组织块,置-70℃冻存。测定时,将组织置于冰上进行研磨,超声粉碎,在4℃下6 000 r/m in离心10 m in,取上清液-20℃保存。测定时,取适量上清液采用VEGF ELISA试剂盒测定胎盘VEGF的含量。
1.6 统计分析
所有试验数据应用SPSS 16.0软件进行方差分析,结果以“平均值±标准差”表示,经F检验组间差异显著者再用Duncan氏多重比较,以分析精氨酸对L-NAME刺激后母猪繁殖性能、胎盘血清NO、TNOS及VEGF含量的影响。以P<0.05为差异显著性判断标准。
2 结果与分析
2.1 精氨酸对L-NAME刺激后妊娠母猪繁殖性能的影响
精氨酸对L-NAME刺激后妊娠母猪繁殖性能的影响见表2。表中数据显示,从妊娠第85天开始在饲粮中添加1.0%精氨酸(处理Ⅳ)、注射LNAME(处理Ⅱ)或注射L-NAME的同时在饲粮中添加1.0%精氨酸(处理Ⅲ)后母猪的窝产仔数、活仔初生重与正对照组差异均不显著(P>0.05)。饲粮中添加1.0%精氨酸后,母猪窝产活仔数由11.20头提高到12.60头(P<0.05),窝活仔重由16.21 kg提高至18.26 kg(P<0.05),而注射LNAME后母猪窝产活仔数降低了19.64%(P<0.05),窝活仔重降低了27.14%(P<0.01)。不过,在注射L-NAME母猪的饲粮中再添加1.0%精氨酸后窝产活仔数、窝活仔重达到正常水平。饲粮中添加1.0%精氨酸后,母猪平均窝产死胎数由1.60头降低至0.52头(P<0.01),而注射L-NAME后母猪窝产死胎数则显著提高到3.20头(P<0.01);然而,在注射L-NAM E母猪的饲粮中再添加1.0%精氨酸后达到正常水平。饲粮中添加1.0%精氨酸后,仔猪IUGR发生率由17.49%降低至6.35% (P<0.05),而注射L-NAME后,仔猪IUGR发生率显著提高至34.49%(P<0.01)。但在注射LNAME的同时添加1.0%精氨酸,仔猪发生IUGR的现象得到有效抑制,即IUGR发生率与正对照组差异不显著(P>0.05)。
2.2 精氨酸对L-NAME刺激后妊娠母猪血清NO和TNOS含量的影响
精氨酸对L-NAME刺激后妊娠母猪血清NO和TNOS的影响见表3。由表中数据可知,妊娠第85天,各处理母猪血清NO、TNOS起始含量差异不显著(P>0.05)。而在饲粮中添加1.0%精氨酸后,妊娠第105天母猪血清NO含量由338.53 U/m L升高至573.69 U/m L,显著高于正对照组的377.98 U/m L(P<0.01)。给妊娠母猪注射LNAME后,妊娠第105天母猪血清NO含量由340.35 U/m L降至113.33 U/m L,显著低于正对照组(P<0.01)。补充1.0%精氨酸对注射LNAM E的妊娠母猪血清NO含量没有影响(P>0.05),即NO含量(116.62 U/m L)与负对照(113.33 U/m L)相当。表3还显示,精氨酸对LNAME刺激后妊娠母猪血清TNOS的影响表现出与NO相似的变化规律。
2.3 精氨酸对L-NAME刺激后妊娠母猪胎盘血清NO、TNOS及VEGF含量的影响
表4数据显示,饲粮中添加1.0%精氨酸后母猪胎盘血清NO含量比正对照组高57.9%(P<0.01),而给母猪连续注射21 d的L-NAME后,胎盘血清NO含量比正对照组降低49.7%(P< 0.01)。不过,在注射L-NAME的同时给母猪补充1.0%精氨酸后,胎盘血清NO含量达403.51 U/m L,显著高于负对照组的197.19 U/m L(P<0.01),而与正对照组(392.27 U/m L)差异不显著(P>0.05)。精氨酸对母猪胎盘血清TNOS的影响表现出与NO相似的变化规律。
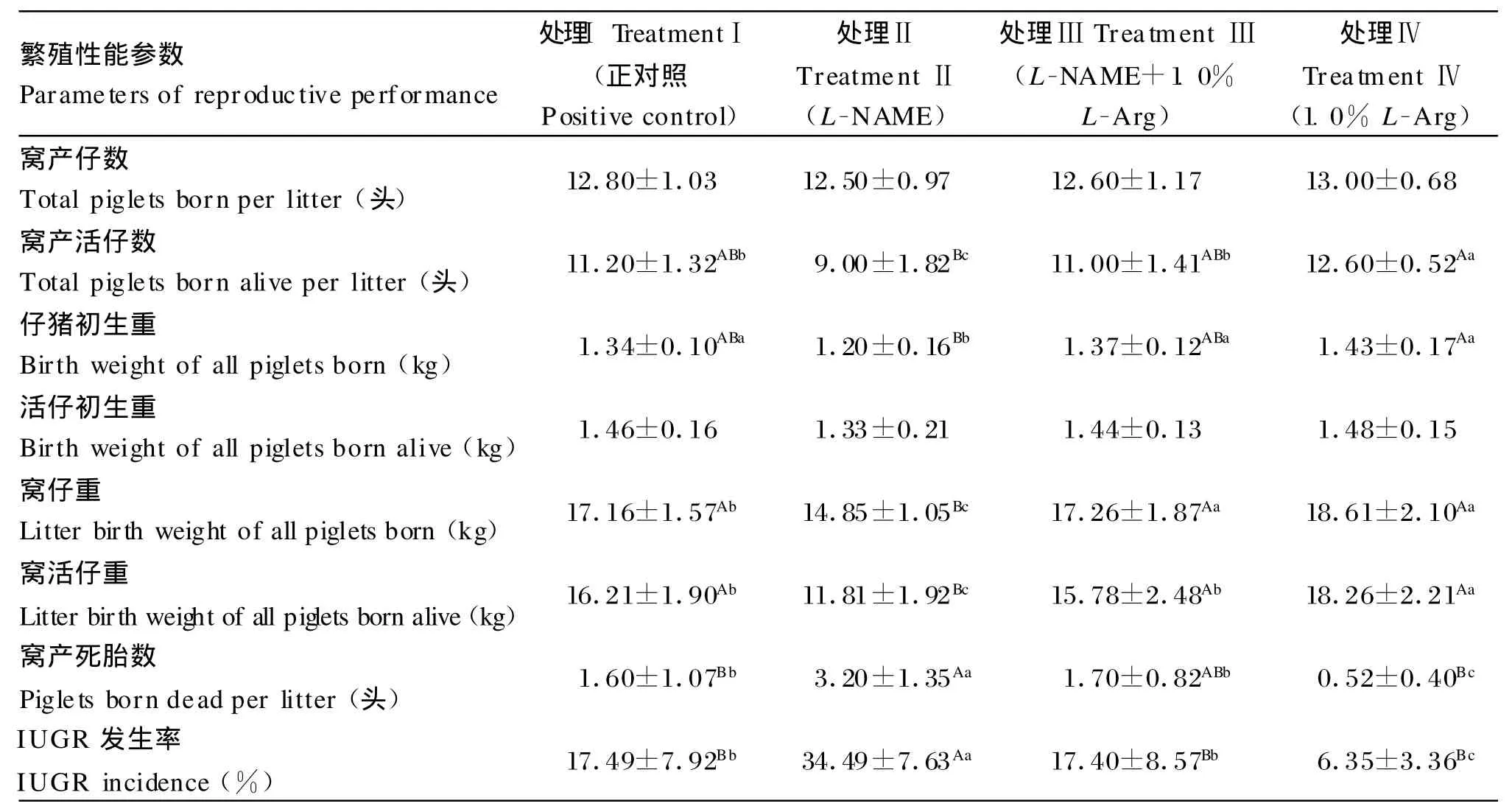
表2 精氨酸对L-NAME刺激后妊娠母猪繁殖性能的影响Table 2 Ef fects o f L-A rg on rep roductive performance o f pregnant gilts induced by L-NAME challenge(n=10)
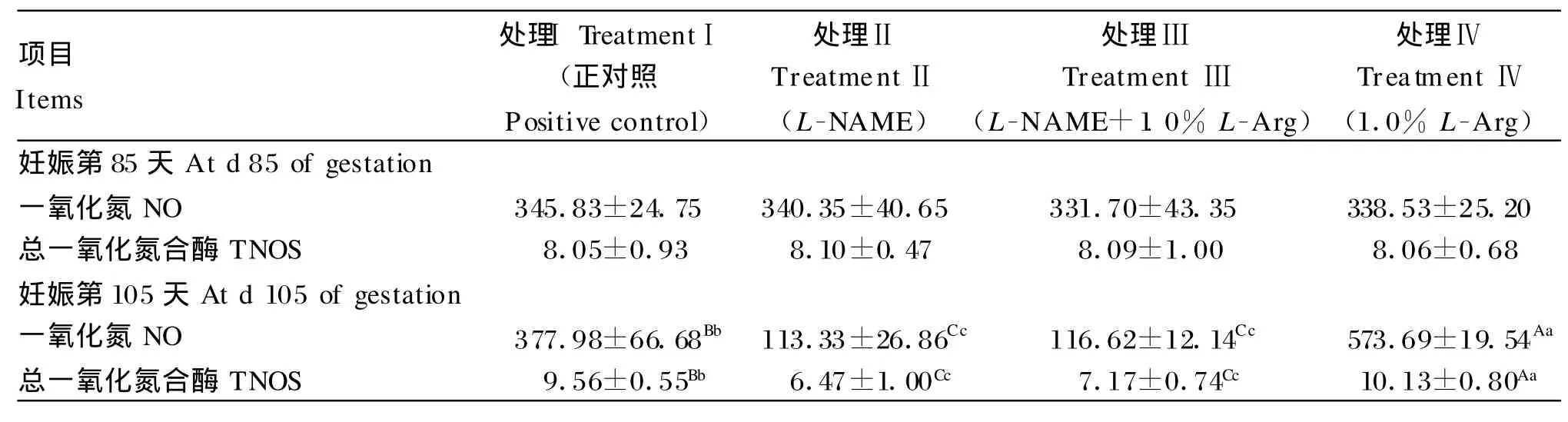
表3 精氨酸对L-NAME刺激后妊娠母猪血清NO和TNOS含量的影响Table 3 Effects of L-A rg on NO and TNOS contents in serum of pregnant gilts induced by L-NAME challenge (U/m L)
饲粮中添加1.0%精氨酸后母猪胎盘VEGF含量显著高于正对照组(P<0.05),而给母猪注射LNAME后,胎盘VEGF含量为1.85 mg/L,显著低于正对照组的2.45 m g/L(P<0.05)。在注射LNAME的同时给母猪补充1.0%精氨酸后,胎盘VEGF含量高于L-NAM E刺激组,但差异不显著(P>0.05)。

表4 精氨酸对L-NAM E刺激后妊娠母猪胎盘血清NO、TNOS及VEGF含量的影响Tab le 4 Ef fects o f L-Arg on NO,TNOS contents in serum and VEGF content of p lacenta o f pregnant gilts induced by L-NAME challenge
3 讨 论
对于集约化饲养的猪只来说,引起IUGR的原因多为母猪孕期(尤其是孕中期和孕后期)胎盘运输能力的低下和功能的缺失[3]。目前,人们对于猪胎儿宫内发育调控方面的研究还十分有限,IUGR困扰养猪业的现象也一直在生产上没有得到很好的解决。直到近来研究人员将精氨酸与母猪胎盘功能联系在一起后发现L-精氨酸对妊娠母猪繁殖性能具有明显的促进作用才获得了重大突破。Remaekers等[4]研究发现,在妊娠第14~28天的经产母猪饲粮中添加1.0%的精氨酸,可使窝产仔数增加1头,而不会影响仔猪平均初生重。M ateo等[2]在妊娠第30~114天的母猪饲粮中添加1.0%的L-精氨酸盐酸盐后发现,平均窝产活仔数从9.13头增加到11.23头(比对照组提高了23.0%),窝活仔重从12.37 kg增加到15.80 kg(比对照组提高了28.0%)。M ateo等[5]在重复试验中获得了相似结果。本研究对妊娠85 d的母猪进行的试验再次印证了上述结论,试验结果表明,尽管在妊娠后期饲粮中添加1.0%的精氨酸对母猪窝产仔数和活仔初生重没有显著影响,但窝产活仔数、窝活仔重得到显著提高,窝产死胎数和IUGR发生率明显降低。
精氨酸是哺乳仔猪的一种必需氨基酸[6]。当母乳作为仔猪唯一的饲粮蛋白质来源时,母乳中精氨酸的含量并不能够满足仔猪最佳生长性能的发挥,因为母乳中精氨酸含量只有1.34 g/L全乳(泌乳第7~21天),这就意味着母乳每天仅能提供1.06 g的精氨酸,而7日龄仔猪(2.5 kg)日增重为200 g左右,其精氨酸的实际需要量(用于蛋白质沉积及氨基酸代谢)在2.7 g/d以上[7]。但对于性成熟的母猪而言,精氨酸是一种非必需氨基酸。精氨酸之所以在促进母猪繁殖性能方面具有特殊功能,是由于其代谢后的产物发挥了积极作用。不过,有关精氨酸促进母猪繁殖性能的机理尚无系统的解释。目前,研究人员普遍将其可归结为精氨酸代谢后的NO对胎盘血清功能起着调节作用。由于L-精氨酸在TNOS催化作用下生成具有生物活性的NO,而NO是动物体内细胞信号传导的重要神经递质,它可直接激活可溶性鸟苷酸环化酶(sGC),被激活的sGC立即将二磷酸鸟苷(GDP)转化为环磷酸鸟苷(cGMP),产生的cGMP最终参与到心血管扩张这一核心生理过程中[8]。本研究结果显示,在饲粮中添加1.0%精氨酸后,母猪血清NO、TNOS含量及胎盘血清NO、VEGF含量均显著高于正对照组,因此,精氨酸通过NO信号通路,可在一定程度上提高胎盘血流速率,改善胎盘缺氧状态,进而对胎盘血清养分运输起着重要的促进作用[9-11]。NO通路不畅将引起妊娠母猪胎盘血清功能的衰退。本试验结果表明,给妊娠母猪注射L-NAME后,母猪血清和胎盘血清NO、TNOS的合成受到抑制,这是造成该组母猪窝产活仔数、窝活仔重显著降低,死胎率和IUGR发生率明显升高的直接原因。然而,在注射LNAM E母猪的饲粮中补充1.0%精氨酸后,尽管母猪血清NO、TNOS合成量不变,但胎盘血清NO、TNOS合成量明显升高,窝产活仔数、窝活仔重达到正对照组水平,仔猪发生IUGR的现象也得到有效缓解。这与Helmbrecht等[12]在大鼠、吴燕等[13]在小鼠中的试验结果一致。这说明,精氨酸代谢产生的NO弥补了因L-NAME诱导的胎盘血清NO不足,并抵消或逆转了由L-NAME诱导的胎猪宫内发育迟缓作用。不过,本试验中在注射L-NAME母猪的饲粮中补充1.0%精氨酸后,胎盘VEGF合成量并未得到恢复性的提升,这可能是由于连续给母猪注射L-NAME的持续时间较长以及饲粮中精氨酸补充的时间较短所致。
4 结 论
①在妊娠后期母猪饲粮中添加1.0%精氨酸后,其窝产仔数、窝仔重不受影响,但窝产活仔数和窝活仔重得到显著提高。
②妊娠后期母猪饲粮中添加的1.0%精氨酸抵消或逆转了由L-NAME诱导的胎盘血清TNOS、NO合成减少及胎猪生长受限的作用,促进了胎猪在宫内的生长速率,并有效地预防了IUGR的发生。
[1] 周根来.新生仔猪小肠发育及胎儿宫内发育迟缓对其的影响[D].硕士学位论文.南京:南京农业大学, 2003.
[2] Mateo R D,W uG,Carroll JA,et al.Ef fec ts ofL-arginine supp lementation on lactation performance of first parity sows[J].Journal o f Animal Science, 2006,84(Supp l.1):257-260.
[3] W u G,Bazer FW,W allace JM,et al.Board-invited review:intrauterine grow th retardation:implications for the animal sciences[J].Journal of Anim al Science,2006,84:2 316-2 337.
[4] Rem aekers P,Kem p B,van der Lende T.Progenos in sows increases num ber o f pig lets born[J].Journal of Animal Science,2006,84(Suppl.1):394-399.
[5] Mateo R D,Wu G,Bazer F W,et al.DietaryL-arginine supplementation enhances the reproductive performance o f gilts[J].Journal of Nutrition,2007, 137:652-656.
[6] W u G,Knabe D A,K im SW.A rginine nutrition in neonatal pigs[J].Journal of Nutrition,2004,134: 2 783S-2 790S.
[7] W u G,Knabe D A.Free and protein-bound am ino acids in sow's co lostrums and m ilk[J].Journal of Nutrition,1994,124:415-424.
[8] M ichael A M,M ichelle M S.Traceelements and nitric oxide function[J].Journal of Nutrition,2003, 133:1 431S-1 433S.
[9] Parra M C,Lees C,Mann G E,et al.Vasoac tive mediator release by fetal endothelial cells in intrauterine grow th restriction and p reeclam psia[J].A-merican Journal of Obstetrics and Gynecology, 2001,184(3):497-502.
[10] Vosatka R J,Hassoun PM,Harvey-Wilkes K B.DietaryL-arginine p revents fetal grow th restric tion in rats[J].American Journal of Obstetrics and Gynecology,1998,178(2):242-246.
[11] Gil F Z,Lucas S R,Gomes G N,et al.Effects of intrauterinine food restric tion and long-term dietary supp lementation w ithL-arginine on age-related changes in renal function and structure of rats[J]. Pediatric Research,2005,57:724-731.
[12] Helmbrech t G D,Farhat M Y,Lochbaum L.L-arginine reverses the adverse pregnancy changes induced by nitric oxide synthase inhibition in the rat [J].American Journal of Obstetrics and Gynecology,1996,175(4):800-805.
[13] 吴 燕,张雅琴,徐道银,等.L-精氨酸对LNAM E诱导的妊高征小鼠的影响[J].中国妇幼保健,2008,23(27):3 894-3 897.
*Correspond ing au thor,associate professor,E-mail:youjinm@163.com
(编辑 何丽霞)
