日粮中等硫添加DL-蛋氨酸和蛋氨酸羟基类似物游离酸在幼建鲤上饲喂效果的比较研究
2010-04-17肖伟伟姜维丹2李树红周小秋
肖伟伟 冯 琳,2 刘 扬,2 姜 俊,2 姜维丹,2 胡 凯,2李树红周小秋,2*
(1.四川农业大学动物营养研究所,雅安625014;2.动物抗病营养教育部重点实验室,雅安 625014)
蛋氨酸是水生动物重要的含硫必需氨基酸,同时也是许多植物性原料的第一限制性氨基酸[1]。随着鱼粉价格不断上涨且产量达到饱和,水生动物饲料逐渐以植物蛋白替代鱼粉作为主要的蛋白质源,造成饲料中蛋氨酸普遍缺乏,补充合成蛋氨酸源成为解决此问题的重要途径[2]。DL-蛋氨酸(DLMet)和蛋氨酸羟基类似物(蛋氨酸羟基类似物游离酸是其中一种形式,英文简写为MHA-FA)是目前常见的合成蛋氨酸源,都已在陆生动物饲料中广泛使用[3]。但水生动物上关于MHA-FA的应用效果还存在争议。Keem biyehetty等[4]和Kelly[5]在条纹石鮨(Morone chrysops♀×Morone saxatilis♂)上,Goff等[6]在眼斑拟石首鱼(Sciaenops ocellatus)上的研究发现,等硫添加DL-M et和MHAFA时,MHA-FA促生长的效果显著低于DL-Met。水生动物的生长与肠道消化酶和刷状缘吸收酶活力密切相关[7],但目前还未见MHA-FA和DL-Met在水生动物肠道消化酶和刷状缘吸收酶活力上的比较研究。蛋氨酸的特殊结构与功能使其具有重要的抗氧化作用[8]。零星的研究表明,DL-Met提高条纹石鮨肝脏谷胱甘肽(GSH)含量和降低条纹石鮨肝脏丙二醛(MDA)含量的幅度明显高于等硫的MHA-FA[5,9]。但关于MHA-FA和DL-M et在水生动物多种抗氧化酶上的比较研究还未见报道。因此,本试验拟从幼建鲤(Cyprinus carpiovar.Jian)的生长性能、消化吸收和抗氧化能力方面比较MHA-FA和DL-M et的饲喂效果。
1 材料与方法
1.1试验日粮与试验设计
试验日粮以鱼粉、大米蛋白粉、棉籽粕、菜籽粕、豆粕为蛋白质源,其组成及营养水平见表1。日粮1中添加2%的DL-M et预混料(DL-Met在日粮中含量为0.52%,DL-Met纯度为98.5%,日本住友化学提供),使日粮蛋氨酸总含量达到本课题组推荐的幼建鲤需要量[10]。日粮2中添加2%的MHAFA预混料(MHA-FA在日粮中含量为0.58%, MHA-FA纯度为88%,日本住友化学提供),与日粮1达到等硫。原料60目粉碎,混匀后制成粒径为1.5 mm的颗粒料,自然风干备用。试验选用300尾平均体重为(8.24±0.03)g的健康幼建鲤,随机分成2组,每组3个重复,每个重复50尾,分别饲喂日粮1(DL-Met组)和日粮2(MHA-FA组),试验期60 d。
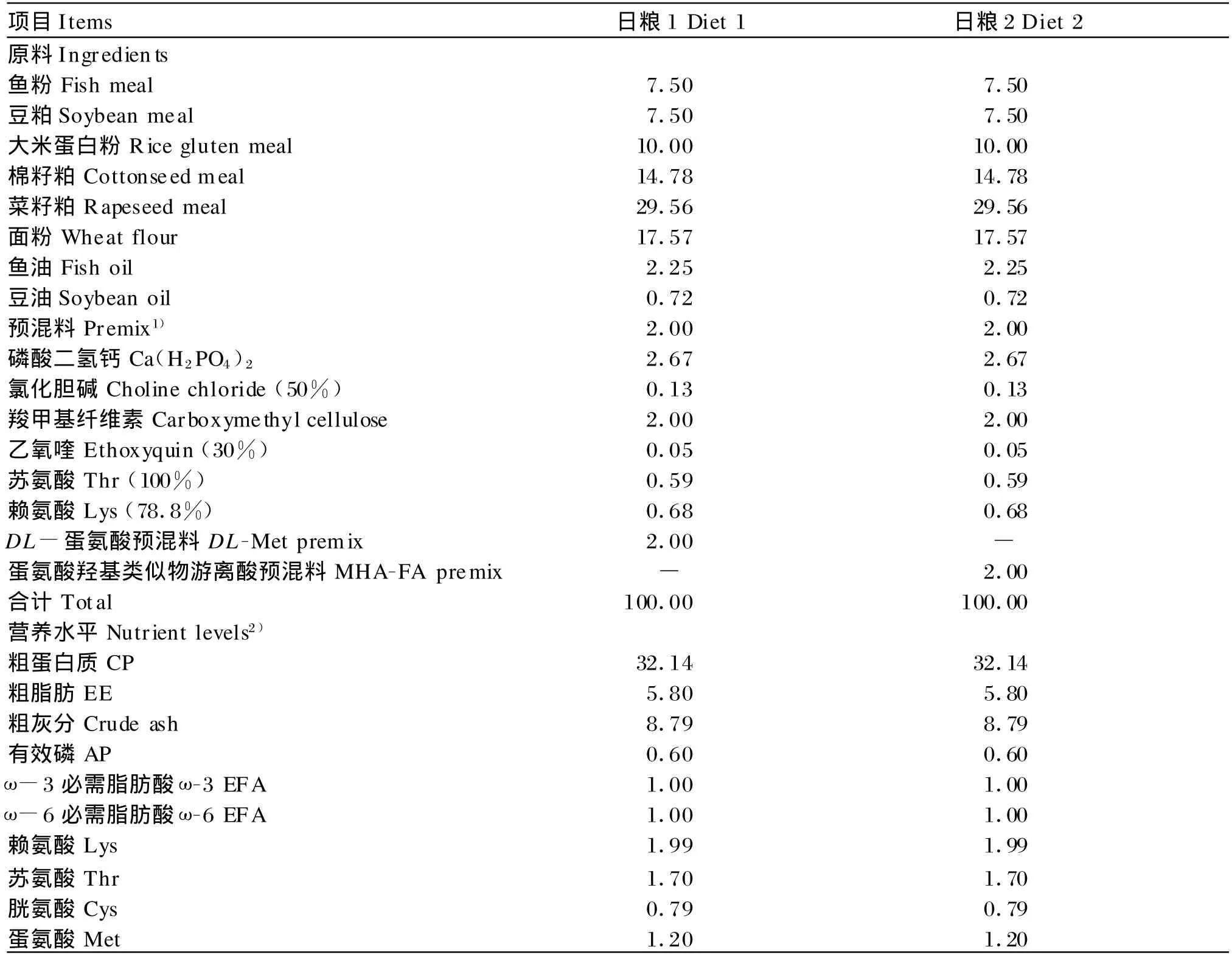
表1 试验日粮组成及营养水平(风干基础)Tab le 1 Composition and nutrient levels of experimental diets(air-d ry basis,%)
1.2饲养管理
鱼苗购回驯化30 d后开始试验,饲养于循环流水过滤水族箱(90 cm×55 cm×30 cm)中,水源为曝气自来水。水温为(25.0±1.5)℃,pH 7.0,溶氧保持在5m g/L以上。试验期间根据建鲤采食情况调整投喂量,保证每次饲喂30m in后有剩料,并迅速收集剩料,计算摄食量。
1.3 指标测定
1.3.1 生长性能
试验开始和结束时对试验鱼称重,计算增重和饲料转化率。试验前随机选取与试验鱼体重一致的30尾鱼用于鱼体蛋白质、脂肪和灰分含量测定。试验结束时,每个重复随机选取5尾鱼,经冷冻干燥后分别用凯氏定氮法、索氏抽提法和灼烧法测定鱼体蛋白质、脂肪和灰分含量,并计算蛋白质、脂肪和灰分的沉积率。计算公式为:
蛋白质(脂肪或灰分)沉积率=[(B-A)/I]×100。
其中,B为试验结束时鱼体中蛋白质(脂肪或灰分)总量(g);A为试验开始时鱼体中蛋白质(脂肪或灰分)总量(g);I为试验期蛋白质(脂肪或灰分)摄入总量(g)。
1.3.2 肝胰脏和肌肉谷草转氨酶(GOT)、谷丙转氨酶(GPT)活力及血浆氨含量
最后1次投饲12 h后,每个重复随机选取15尾鱼,尾静脉采血并将血液置于4℃冰箱中过夜后,4℃,3 000 r/min离心10 min。取血清按测定各指标所需要的样品量进行分装,然后置于-20℃冰箱中冷冻保存备用。同时取肝胰脏、肠道和肌肉用液氮冷冻后在-70℃冰箱保存备测。肝胰脏和肌肉GOT、GPT活力用试剂盒测定(南京建成生物工程研究所)。最后1次投饲6 h后,每个重复随机选取5尾鱼,乙二胺四乙酸二钠(EDTA-Na2)抗凝针管尾部血管采血,两点法测定血浆氨含量(中生北控测试盒),2 h内完成。
1.3.3 消化吸收指标
肝胰脏和肠道糜蛋白酶、胰蛋白酶活力测定参照Hummel[11]的方法进行。肝胰脏和肠道脂肪酶和淀粉酶活力测定参照Furne等[12]的方法进行。全肠肌酸激酶(CK)和各肠段碱性磷酸酶(AKP)、Na+,K+-ATP酶活力的测定分别参照W eng等[13]、K rogdah l等[14]、Ilenchuk等[15]的方法进行。各肠段γ-谷氨酰转肽酶(γ-GT)活力用试剂盒测定(南京建成生物工程研究所),具体按试剂盒说明书进行。
1.3.4 抗氧化指标
血清、肠道和肝胰脏的MDA含量测定参照Lingstone等[16]的方法,超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活力的测定参照Zhang等[17]的方法,过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、GSH和谷胱甘肽硫转移酶(GST)活力的测定分别参照Aebi[18]、Lora等[19]和Lushchak等[20]的方法。
1.4 统计分析
采用SPSS 11.5对试验数据进行t检验,结果以平均值±标准差表示。
2 结 果
2.1生长性能
由表2可知,MHA-FA组幼建鲤的末重、增重、饲料转化率以及蛋白质、脂肪和灰分的沉积率与DL-Met组均差异不显著(P>0.05),但摄食量显著低于DL-Met组(P<0.05)。
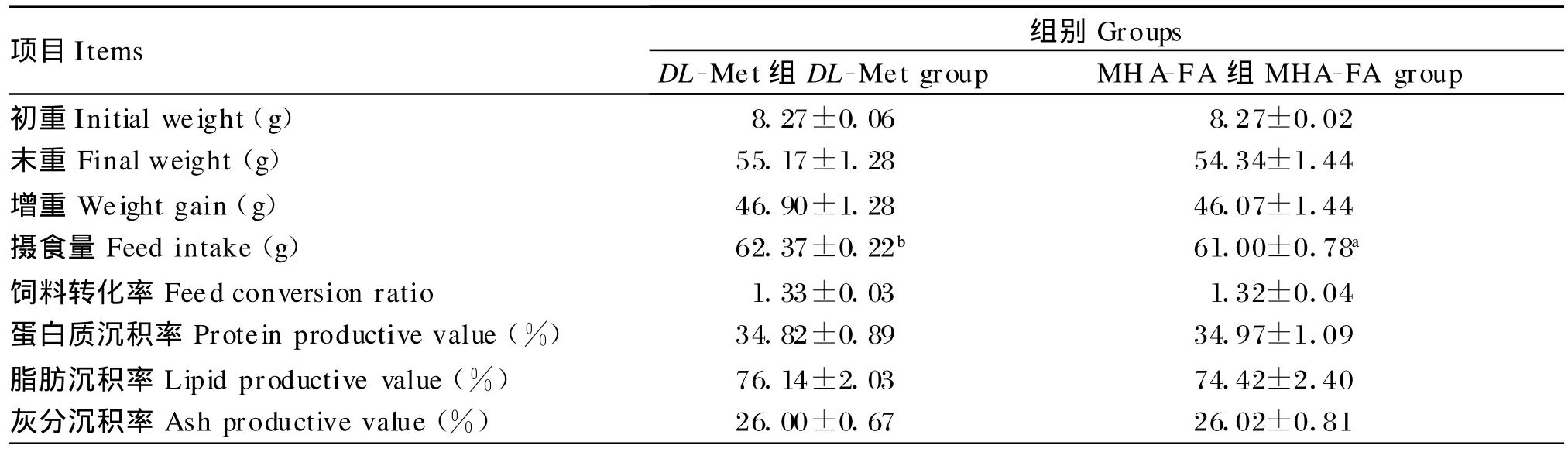
表2 等硫添加DL-Met和M HA-FA对幼建鲤生长性能的影响Table 2 Effects of equal-sulfur supp lementation with DL-Met and MHA-FA on grow th perform ance of juvenile Jian carp
2.2 肌肉和肝胰脏GPT、GOT活力以及血浆氨含量
由表3可知,MHA-FA组幼建鲤的肝胰脏GOT、肌肉和肝胰脏GPT活力以及血浆氨含量与DL-Met组均差异不显著(P>0.05),但肌肉GOT活力显著低于DL-M et组(P<0.05)。

表3 等硫添加DL-M et和MHA-FA对幼建鲤肌肉和肝胰脏GPT、GOT活力以及血浆氨含量的影响Tab le 3 Ef fects of equal-sulfur supp lem entation w ith DL-M et and MHA-FA on GPT and GOT activities in muscle and hepatopancreas and p lasma ammonia content of juvenile Jian carp(U/g)
2.3消化吸收指标
由表4可知,MHA-FA组的肝胰脏和肠道胰蛋白酶、糜蛋白酶以及肠道脂肪酶和淀粉酶活力与DL-Met组均差异不显著(P>0.05),但肝胰脏脂肪酶和淀粉酶活力显著低于DL-Met组(P<0.05)。

表4 等硫添加DL-M et和MHA-FA对幼建鲤肠道和肝胰脏消化酶活力的影响Table 4 Ef fects of equal-sulfur supp lementation w ith DL-Met and MHA-FA on digestive enzyme activities in intestine and hepatopancreas of juvenile Jian carp(U/g)
由表5可知,MHA-FA组的前肠和中肠AKP、各肠段Na+,K+-ATP酶、中肠γ-GT以及全肠CK活力与DL-M et组均差异不显著(P>0.05),但后肠AKP、前肠和后肠γ-GT活力显著低于DL-M et组(P<0.05)。
2.4 抗氧化指标
由表6可知,MHA-FA组的血清、肠道和肝胰脏MDA含量显著高于DL-Met组(P<0.05)。 MHA-FA组的肝胰脏和肠道GSH活力与DL-Met组差异不显著(P>0.05),但血清GSH活力显著低于DL-Met组(P<0.05)。MHA-FA组的血清、肝胰脏和肠道SOD、GR活力与DL-Met组无显著差异(P>0.05)。MHA-FA组的血清和肠道CAT以及肠道和肝胰脏GST、GSH-Px活力显著低于DLM et组(P<0.05),而肝胰脏CAT,血清GSH-Px、GST活力与DL-Met组无显著差异(P>0.05)。

表5 等硫添加DL-Met和MHA-FA对幼建鲤肠道吸收酶活力的影响Tab le 5 Effects of equal-sulfur supplementation w ith DL-Met and MHA-FA on absorptive enzyme activities in intestine of juvenile Jian carp(U/g)
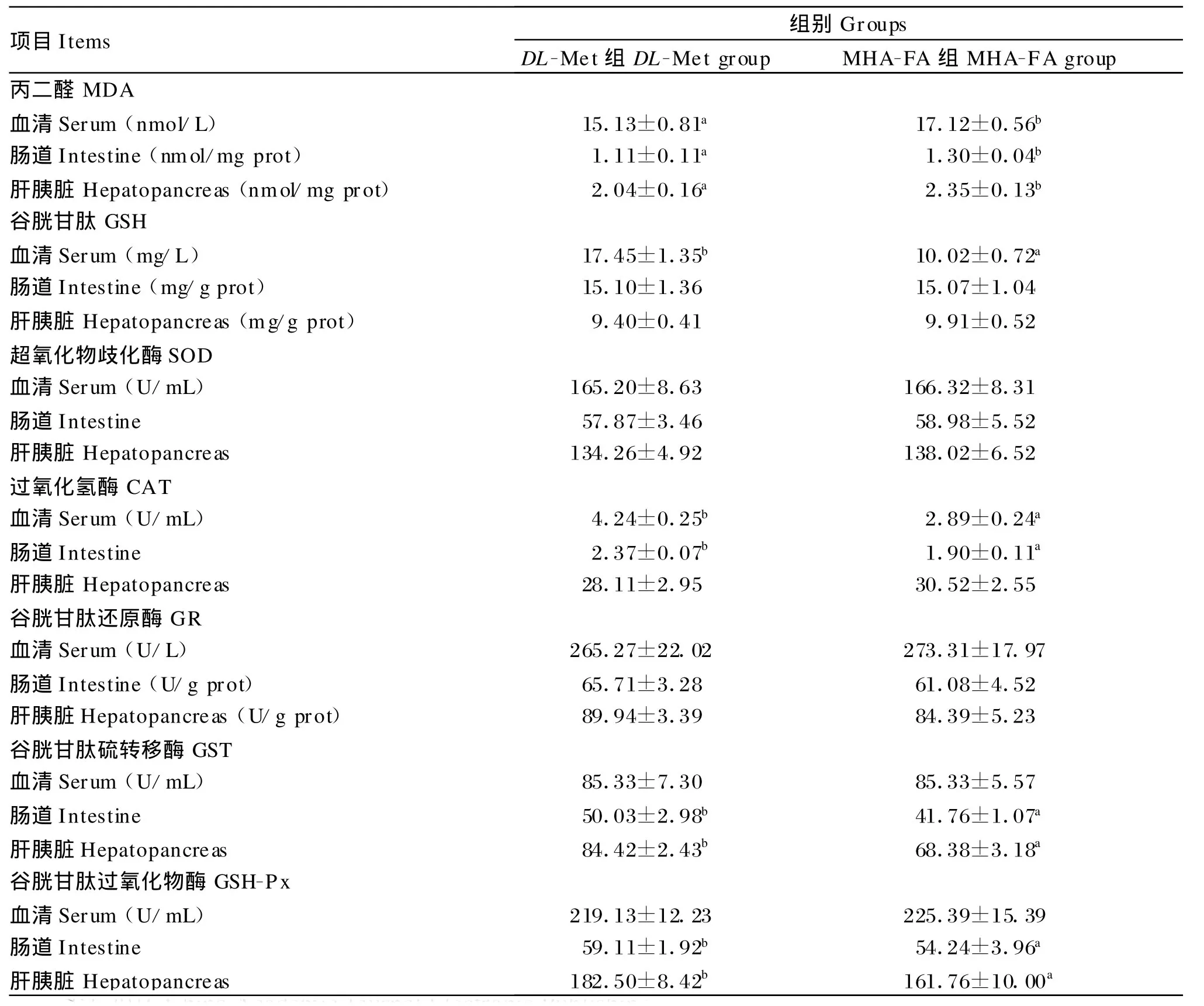
表6 等硫添加DL-M et和MHA-FA对幼建鲤血清、肠道和肝胰脏抗氧化指标的影响Table 6 Ef fec ts of equal-su lfur supp lementation w ith DL-Met and MHA-FA on antioxidation indices in the serum,intestine and hepatopancreas of juvenile Jian carp(U/mg prot)
3 讨 论
3.1 等硫添加DL-Met和MHA-FA对幼建鲤生长性能的影响
蛋氨酸是鲤鱼重要的含硫必需氨基酸,植物蛋白日粮中补充蛋氨酸可以促进鲤鱼的生长[21-22]。在本试验日粮中补充等硫水平的DL-M et和MHAFA并达到幼建鲤的蛋氨酸需要量,结果发现增重二者差异不显著。这与Keembiyehetty等[4]和Kelly[5]在条纹石鮨及Gof f等[6]在眼斑拟石首鱼上的研究得出的DL-M et的增重效果显著高于等硫的MHA-FA的结果不一致。结果不太一致的原因可能有:1)水生动物品种不同。MHA-FA进入机体需要经L-2-羟基酸氧化酶和D-2-羟基酸脱氢酶转化为2-酮-4-甲硫基丁酸,再由转氨酶转化为L-蛋氨酸才能被机体利用[23]。建鲤转化并利用MHA-FA的能力可能高于其他水生动物。2)日粮类型不同。本试验中采用实用日粮,以上研究均采用纯合或半纯合日粮。Gutteridge等[24]和Daenner等[25]在肉鸡上的研究发现,实用日粮下等硫的MHA-FA与DL-M et的增重效果相当。
摄食量和饲料转化率是影响水生动物生长的2个重要因素,而体沉积的变化在一定程度上反映了动物对饲料的利用效率。本试验结果显示,MHAFA组的幼建鲤摄食量显著低于DL-Met组,但蛋白质、脂肪和灰分的沉积率2组差异不显著,二者的饲料转化率也相当。这表明,幼建鲤利用含等硫的MHA-FA和DL-Met饲料的效率是一样的。蛋白质沉积率与机体的氨氮代谢以及体蛋白质合成的能力有关[26]。肝胰脏和肌肉是体内蛋白质代谢的主要场所,而GOT和GPT是2种主要参与氨基酸代谢的酶,其活力高低可以反映体内氨基酸被利用的情况[27]。氨是鱼类蛋白质在肝脏和肾脏分解代谢的主要终产物,血浆氨含量与日粮氨基酸含量及比例有关[28]。本研究发现,等硫的MHA-FA和DLMet组的幼建鲤的肌肉、肝胰脏中GOT和GPT活力以及血浆氨含量无显著差异。这表明,等硫的MHA-FA和DL-Met调节氨基酸的周转代谢和蛋白质合成的效率几乎相当,表现出体蛋白质沉积的效果也一样。
3.2 等硫添加DL-M et和MHA-FA对幼建鲤消化酶和吸收酶活力的影响
水生动物的生长来源于对营养物质充分的消化吸收,营养物质的消化以酶消化为主,吸收靠多种吸收酶完成,因此生长与消化酶和吸收酶的活力密切相关[8]。本研究发现,MHA-FA组的肝胰脏和肠道胰蛋白酶、糜蛋白酶以及肠道脂肪酶和淀粉酶活力与DL-Met组差异不显著,但肝胰脏脂肪酶和淀粉酶活力显著低于DL-M et组。这表明,DL-Met可能更有利于脂肪酶和淀粉酶的分泌,但由于肠道消化酶活力大多与等硫的MHA-FA相当,二者在消化能力上几乎可达到相同的效果。
Na+,K+-ATP酶是存在于多种生物膜上的一种蛋白酶,参与多种氨基酸的转运过程[29],其活力间接反映肠道的吸收能力。由本研究结果可知,投饲等硫的MHA-FA和DL-Met饲料的幼建鲤的各肠段Na+,K+-ATP酶活力差异均不显著。γ-GT是谷氨酸循环的关键酶,可促进氨基酸向细胞内转运,为蛋白质生物合成提供原料[30]。本研究发现, MHA-FA组的中肠γ-GT活力与DL-M et组差异不显著,但前肠和后肠γ-GT活力显著低于DLM et组。肠道AKP分布在肠上皮刷状缘细胞表面,与脂类、氨基酸、葡萄糖等多种物质的吸收有关,也反映肠上皮细胞的吸收能力[31]。本研究显示, MHA-FA组的前肠和中肠AKP活力与DL-Met组无显著差异,但后肠AKP活力显著低于DL-Met组。CK在能量代谢中扮演重要角色,参与多种酶与ATP的组装过程,为肠道营养物质的吸收提供能量。本研究发现,投饲等硫的MHA-FA和DL-Met饲料的幼建鲤整个肠道CK活力差异不显著。以上结果表明,等硫添加MHA-FA和DL-M et时,幼建鲤的绝大部分肠道吸收酶活力相当。
3.3 等硫添加DL-Met和MHA-FA对幼建鲤抗氧化能力的影响
蛋氨酸代谢生成的Cys可参与抗氧化物质GSH和牛磺酸的合成[2,32],且其本身的巯基具有氧化还原的特点[33],使其在机体抗氧化系统中发挥着重要作用。体内脂质中的多不饱和脂肪酸易受活力氧物质(ROS)攻击发生氧化而生成终产物MDA,因此MDA含量常用来反映体内脂质过氧化的程度[34]。本研究结果显示,DL-M et组的血清、肠道和肝胰脏MDA含量显著低于MHA-FA组,这与Li等[9]在条纹石鮨上的研究结果一致。这表明,补充DL-Met的水生动物体内脂质过氧化的程度小于等硫的MHA-FA。正常情况下,体内抗氧化系统使体内ROS的产生和清除处于动态平衡,维持在适宜水平而不会造成机体的氧化损伤。SOD主要负责清除超氧阴离子(O2-),将其转化为H2O2;CAT和GSH-Px作为SOD的下游酶类,分别在微粒体和胞浆、线粒体基质中清除H2O2,同时GSH-Px还具有清除脂质过氧化产物的能力[35];GR主要负责将氧化型谷胱甘肽转化为GSH,维持体内GSH的平衡;GSH作为体内重要的抗氧化物质,可以直接还原H2O2和过氧化脂质,还参与了维生素C的再生过程;GST的同工酶能够将脂质过氧化产物清除出细胞[36]。由本试验结果可知,MHA-FA组的血清、肠道和肝胰脏SOD、GR,肠道和肝胰脏GSH、肝胰脏CAT及血清GSH-Px和GST活力与DL-Met组差异不显著,但血清GSH、血清和肠道CAT、肠道和肝胰脏GST、GSH-Px活力显著低于DL-Met组。上述结果表明DL-M et组的多种抗氧化酶活力高于等硫的MHA-FA组,这可能是其血清、肠道和肝胰脏MDA含量较低的主要原因。DL-Met的抗氧化能力在一定程度上优于等硫的MHA-FA,可能是二者在体内参与的代谢有所不同,还有待进一步研究。
4 结 论
①在本试验日粮中添加的MHA-FA能够很好地被幼建鲤吸收利用。
②在生长性能方面,等硫的MHA-FA可以完全替代DL-M et;在消化吸收和抗氧化能力方面,等硫的MHA-FA可以部分替代DL-Met。
[1] Hansen A C.Ef fec ts o f rep lacing fish meal w ith plant p rotein in diets for A tlantic cod(Gadus morhuaL.)[D].Ph.D.Thesis.Bergen:University of Bergen,2009:13-21.
[2] Cheng Z J,H ardy R W,Blair M.Ef fects o f supp lementing methionine hydroxy analogue in soybean meal and distiller's dried grain-based diets on the performance and nutrient retention of rainbow trout(Oncorhynchus mykiss,W albaum)[J].Aquacu lture Research,2003(34):1 303-1 310.
[3] Martín-Venegas R,Geraert P A,Ferrer R.Conversion of them ethionine hydroxy analogueDL-2-hyd roxy-(4-methylthio)butanoic acid to sulfur-containing am ino acids in the ch icken small intestine [J].Poultry Science,2006,85:1 932-1 938.
[4] Keembiyehetty C N,Gatlin D M.Evaluation of different sulfur compounds in the diet of juvenile sunshine bass(Morone chrysops♀×M.saxatilis♂)[J]. Com parative Biochem istry and Physiology,1995, 112:155-159.
[5] Kelly M C.Re fined understanding o f sulfur am ino acid nutrition in hybrid striped bass(Morone chrysops×M.saxatilis)[D].Thesis.Texas:Texas A& M University,2005:5-14.
[6] Goff JB,G atlin D M.Evaluation of differentsulfur am ino acid compounds in the diet o f red d rum,Sciaenops ocellatus,and sparing value o f cystine for methionine[J].Aquaculture,2004,241:465-477. [7] Hakim Y,Uni Z,H ulata G,et al.Relationship betw een intestinal brush border enzymatic activity and grow th rate in tilapias fed diets containing 30% or 48%p rotein[J].Aquacu lture,2006,257:420-428.
[8] Métayer S,Seiliez I,Co llin A,et al.Review s: mechanism s through w hich sulfur am ino acids control protein metabolism and oxidative status[J]. Journal of Nutritional Biochem istry,2008(19): 207-215.
[9] Li P,Burr G S,Wen Q,et al.D ietary suf ficiency of sulfur am ino acid compounds in fluences p lasm a ascorbic acid concentrations and liver peroxidation of juvenile hybrid striped bass(M orone chrysops×M.saxatilis)[J].Aquaculture,2009,287:414-418.
[10] Tang L,W ang G H,Jang J,etal.Ef fect ofmethionine on in testinal enzymes activities,m icroflora and hum oral immune o f juvenile Jian carp(Cyprinus carpiovar.Jian)[J].Aquaculture Nutrition,2009 (15):477-483.
[11] Hummel BCW.A modified spectrophotometric determ ination of chymotrypsin,trypsin,and throm bin [J].Canadian Journal of Biochem istry and Physiology,1959,37:1 393-1 399.
[12] Furne M,H idalgo M C,Lopez A,et al.D igestive enzyme activities in Adriatic sturgeonAcipenser naccariiand rainbow troutOncorhynchusmykissa comparative study[J].Aquaculture,2005,250:391-398.
[13] W eng C F,Ch iang C C,Gong H Y,et al.A cute changes in gill Na+-K+-ATPase and creatine kinase in response to salinity changes in the euryhaline teleost,tilapia(Oreochrom ismossambicus)[J].Physiological and Biochem ical Zoo logy,2002,75:29-36. [14] Krogdah l A,M cKellep A M B,Baeverf jord G.Effects of graded levels ofstandard soybeanmealon intestinal struc ture,mucosal enzyme activities,and pancreatic response in A tlantic salm on(Sa lmo salarL.) [J].Aquacu lture Nutrition,2003(9):361-371.
[15] Ilenchuk T T,Davey K G.Some properities of Na+, K+-ATPase in the follicle cells o fRhodinus prolious[J].Insect Biochem istry,1982(12):675-682.
[16] Lingstone D R,Garcia M P,Michel X,et a1.Oxyrad-ical p roduc tion as a po llution-mediatedmechanism of toxicity in the common mussel,My tilus edu lisL. and other mollusks[J].Functional Ecology,1990 (4):415-424.
[17] Zhang X D,Zhu Y F,Cai L S,et a1.Effects of fasting on themeat quality and antioxidant defenses of market size farmed large yellow croaker (Pseudosciaena crocea)[J].Aquaculture,2008, 280:136-139.
[18] Aebi H.Catalasein vitro[J].M ethods in Enzymo logy,1984,105(2):121-126.
[19] Lora J,Alonsn F J,Segura JA,et a1.Antisense glutam inase inh ibition decreases g lutathione antioxidant capacity and increases apop tosis in Ehrlich ascitic tumour cells[J].European Journal of Biochem istry, 2004(21):4 298-4 306.
[20] Lushchak V I,Lushchak I P,Mota A A,et a1.Oxidative stress and antioxidant defenses in gold fishCarassius auratusduring anoxia and reoxygenation [J].American Journal of Physiology,Regulatory, Integrative and Comparative Physio logy,2001(1): 100-107.
[21] Murthy H S,Varghese T J.Total sulphur am ino acid requirement of the Indian major carp[J].Aquaculture Nutrition,1998(4):61-65.
[22] Ahmed I T,Khan M R.Dietary methionine requirementof fingerling Indian major carp[J].Methods in Enzymology,1984(2):121-127.
[23] D ibner JJ,Knight C D.Conversion o f 2-hydroxy-4-(meth ylthio)butanoic acid toL-m ethionine in the chick:a stereospecific pathw ay[J].Journal Nutrition,1984,114:1 716-1 723.
[24] Gutteridge D G A,Lew is D.Chick bio-assay ofmethionine and cystine:Ⅱ.Assay of soybean m eals, ground nut meals,meatmeals,methionine isomers and m ethionine analogue[J].British Poultry Science,1964(5):193-200.
[25] Daenner E,BesseiW.In fluence of supp lementation with liquidDL-methionine hydroxy analogue-free acid(M HA-FA)orDL-methionine on performance of broilers[J].The Journal o f Applied Poultry Research,2003(12):101-105.
[26] 彭 艳,唐 凌,帅 柯,等.蛋氨酸对幼建鲤生长及消化吸收功能的影响[J].中国畜牧杂志,2009 (13):33-38.
[27] Balogun O O,Fetuga B L.Liver glutamate-oxalate transam inase and glutam ate-pyruvate transam inase ac tivity in pigs as in fluenced by dietary methionine and lysine levels[J].Biochem istry and Experimental Biology,1980(16):42-50.
[28] Yang SD,Liou CH,Liu FG.Effects of dietary protein level on grow th perform ance,carcass composition and ammonia excretion in juvenile silver perch (Bidyanus bidyanus)[J].Aquaculture,2002,213: 363-372.
[29] K lein S,Cohn S M,A lpers D H.The alimentary tract in nutrition[M].In:ShilsM E,Shike M,eds. Modern Nutrition in Health and D isease.Baltimore, MD:LippincottW illiams&W ilkins,1998:605-630.
[30] Griffith OW,M eister A.Excretion of cycsteine andγglutamylcysteine moieties in human and experimental anim alγ-glutamyl transpeptidase deficiency[J]. Proceedings of the National A cadem y of Sciences of United States o f America,1980,77:3 384-3 387.
[31] V illanueva J,Vanacore R,Goicoechea O,et a1.Intestinalalkaline phosphatase of the fishCyprinus carpio: regional distribution and m embrane association[J]. Journal of Experimental Zoology,1997,279:347-355.
[32] W ang S T,Chen H W,Sheen L Y,et a1.Methionine and cysteine affect glutathione level,glutathione-related enzyme activities and the expression of glutathione S-transferase isozymes in rat hepatocytes [J].The Journal of Nutrition,1997(11):2 135-2 141.
[33] Hoshi T,Heinemann S H.Regulation o f cell function bymethionine oxidation and reduction[J].The Journal of Physiology,2001(1):1-11.
[34] O ruc Eö,Usta D.Evaluation of oxidative stress responses and neurotoxicity potential o f diazinon in dif ferent tissues ofCyprinus carpio[J].Environment Toxicology Pharm acology,2007(23):48-55.
[35] Ana F,Venturin O,Ana M.Ef fects o f carbary l and azinphos methyl on juvenile rainbow trout(Oncorhynchusmykiss)detoxifying enzymes[J].Pesticide Biochem istry and Physiology,2007(2):134-142.
[36] A lena S,Daniela W,Jitka P.In f luence of silym arin and its f1avonolignans on H2O2induced oxidative stress in hum an keratinocytes and m ouse fibroblasts [J].Burns,2006(8):973-979.
*Correspond ing au thor,p rofessor,E-m ail:Zhouxq@sicua.edu.cn
(编辑 菅景颖)
