抗菌肽与抗生素对革兰氏阴性菌和革兰氏阳性菌的体外协同抗菌效果研究
2010-04-17刘倚帆朱海燕张立可汪以真
刘倚帆 徐 良 朱海燕 张立可 汪以真*
(1.浙江大学饲料科学研究所,动物分子营养学教育部重点实验室,杭州 310029;2.浙江大学动物科学学院,杭州 310029)
畜产品中的抗生素残留问题越来越受到人们的重视,许多国家包括我国已经严格限制或禁止将抗生素作为保健和促生长剂添加到畜禽饲料中。由于抗生素的乱用和滥用,许多细菌产生了耐药菌株,并且其出现频率已经超过了抗生素新药的开发速度,由此给疾病的治疗带来了很大困难。因此,研制安全、高效、环保型防病、保健、促生长添加剂就显得尤为重要。抗菌肽是宿主非特异性免疫防御系统产生的一类对抗外源性病原体的肽类活性物质,是天然免疫的效应分子[1]。研究表明,抗菌肽有着与传统抗生素不同的作用机制,不易诱导耐药菌株的产生;抗菌谱广,对细菌、真菌、病毒、原虫及癌细胞均有作用;此外,还具有稳定、水溶性好,对高等动物正常细胞几乎无害,在体内无残留等特点[2-3]。由于上述优点,抗菌肽成为学术界研究与开发的热点,然而,其抗菌活性还远远不及传统抗生素。目前,有2种策略提高抗菌肽的应用价值:一是开发高效、低成本的抗菌肽及其衍生物;二是通过抗生素或其他化合物与抗菌肽的联合应用,来增强抗菌肽的活性。现在,越来越多的研究涉及到抗菌肽与几种常规抗生素的联合使用,抗菌肽与抗生素的联合使用可以提高抗生素的治疗效果,在很大程度上降低抗生素的用量,并减小因使用抗生素带来的药物残留及产生耐药菌株等副作用[4]。有研究表明,抗菌肽能够使具有疏水基的化合物最大限度地进入到细胞内部,更好地发挥抗菌作用,并且与亲脂或两性抗生素表现出一定的协同作用[5]。
本试验研究了畜禽养殖业中常用的抗生素金霉素(aureom ycin)、新霉素(neom ycin)分别与牛乳铁蛋白肽(Lactoferricin B,LFcin B)以及昆虫类抗菌肽天蚕素A(Cecropin A)联合使用对革兰氏阴性菌和阳性菌的体外联合抗菌效应,旨在通过两两联合用药的协同作用来扩大抗菌谱,提高治疗效果,同时达到降低用药量,减少药物残留,避免或减少耐药菌株产生的目的。
1 材料与方法
1.1 受试菌株
大肠杆菌ATCC25922、金黄色葡萄球菌ATCC25923、猪霍乱沙门氏菌CMCC50013和铜绿假单胞菌CMCC10014均购自中国药品生物制品检定所,-80℃暗处保存,20%甘油冻存管中备用。
1.2 主要药物和试剂
LFcin B和Cecropin A由吉尔生化(上海)有限公司合成。2种抗生素为金霉素和新霉素,购自浙江美迪康贸易公司,-80℃暗处保存。M ueller-Hinton(MH)肉汤培养基购自英国Difco公司。
1.3 药敏试验
1.3.1 LFcin B、Cecropin A、金霉素和新霉素最小抑菌浓度(M IC)和最小杀菌浓度(MBC)的测定
采用Hancock实验室改良的微量肉汤稀释法[6]测定LFcin B、Cecropin A、金霉素和新霉素等4种抗菌药物单用时的M IC。具体操作为:首先用无菌蒸馏水将抗菌肽配制成2 560μg/m L的储备液,将抗生素配制成320μg/m L的储备液,然后用无菌蒸馏水进行一系列双倍稀释,分别得到质量浓度为2 560、1 280、640…10、5μg/m L等10个系列浓度梯度的抗菌肽稀释液,以及质量浓度为320、160、80…1.25、0.625μg/m L等10个系列浓度梯度的抗生素稀释液。
将待测细菌在灭菌MH肉汤琼脂平板上过夜培养,挑取菌落接种于灭菌试管中的MH肉汤,37℃250 r/min过夜培养。将培养后的菌液取30μL转接至3m L新鲜MH肉汤液体培养基中,37℃250 r/min恒温震荡培养2~5 h至对数生长期。将上述2次活化的菌液稀释至2×105~7×105CFU/m L,向无菌96孔板(Corning,美国)中的第1~10孔依次加入90μL制备好的菌液,第11孔加入100μL菌悬液作为阳性对照,第12孔加入100μL MH肉汤培养基作为阴性对照。然后从第1~10孔逐一加入10μL相应浓度的抗菌肽稀释液或抗生素稀释液,使得待测肽的终浓度分别为256、128、64…1、0.5μg/m L,待测抗生素的终浓度分别为32、16、8…0.125、0.062 5μg/m L。将培养板震荡均匀后放在湿盒中,于37℃下静置培养18~24 h,以孔中弥散浑浊、底部有圆形或丝网状沉淀为细菌生长指标,无肉眼可见细菌沉淀的最小浓度判定为抗菌肽或抗生素的最小抑菌浓度。每种抗菌物质做3次重复。
从没有细菌生长的最高浓度的3个平板孔中各取10μL内容物滴加到MH琼脂平板上,每孔做3个重复,待完全吸收后,37℃下培养18~24 h,根据是否有菌落生长来确定抗菌物质的最小杀菌浓度。
1.3.2 LFcin B、Cecropin A、金霉素和新霉素联合药敏试验
采用肉汤稀释棋盘试验,对参考文献[7]方法进行适当改进,采取6×6棋盘,根据所测得的每种药物对每种菌株的M IC值,将每种药物的最高浓度设定为2×M IC,然后用无菌蒸馏水进行一系列双倍稀释,细菌培养方法同1.3.1。以LFcin B和Cecropin A联合使用为例,LFcin B以横行方式, Cecropin A以纵列方式,将5μL各自不同浓度的药液加入96孔板中,每孔再加菌液90μL,使96孔板的每1横行孔中Cecropin A浓度不变,LFcin B浓度则依次为2、1、1/2、1/4、1/8、1/16倍M IC;96孔板的每1纵列孔中LFcin B浓度不变,Cecropin A浓度则依次为2、1、1/2、1/4、1/8、1/16倍MIC。将培养板震荡均匀后放在湿盒中,于37℃下静置培养18~24 h。在实验室中以部分抑菌浓度指数(fractional inhibitory concentration index,FIC index)作为联合药敏试验的判断依据。FIC index= [M IC(A)/MICA]+[MIC(B)/M ICB],其中,M ICA和M ICB分别代表A药物和B药物单独使用时的MIC值,M IC(A)和MIC(B)分别代表A药物和B药物联合用药时各自的M IC值。依据联合药敏试验的判断标准判断联合用药的效果。FIC index≤0.5,为协同作用;0.5<FIC index≤1,为部分协同或相加作用;1<FIC index≤2,为无关作用;FIC index>2,为拮抗作用。各组试验重复3次。
2 结 果
2.1 LFcin B、Cecropin A、金霉素和新霉素单独使用时的M IC和MBC
抗菌肽和抗生素对所试4种菌株的M IC值及MBC值分别见表1和表2。结果表明,2种抗菌肽LFcin B、Cecropin A和2种抗生素金霉素、新霉素对革兰氏阴性菌大肠杆菌、猪霍乱沙门氏菌、铜绿假单胞菌和革兰氏阳性菌金黄色葡萄球菌均有抑制作用,但抑制效果不同。总体来说,革兰氏阴性菌对Cecropin A比对LFcin B更敏感。但革兰氏阳性菌金黄色葡萄球菌对Cecropin A不敏感,在设定浓度范围内检测不到其M IC值。金黄色葡萄球菌也是受试菌株中对抗生素表现最敏感的,其中金霉素对金黄色葡萄球菌的M IC达到0.062 5μg/m L。抗生素对所试4种菌株的抑制作用均明显强于抗菌肽。

表1 LFcin B、Cecropin A、金霉素和新霉素对4种受试菌的最小抑菌浓度Tab le 1 M ICs of LFcin B,Cecropin A,aureomycin and neom ycin against 4 strains o f tested bacteriaμg/m L
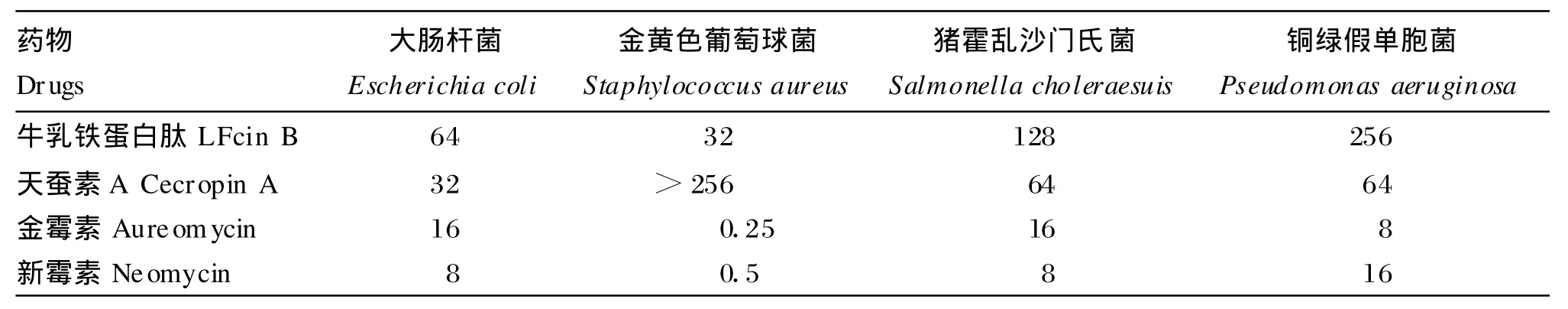
表2 LFcin B、CecropinA、金霉素和新霉素对4种受试菌的最小杀菌浓度Table 2 MBCs o f LFcin B,Cecropin A,aureom ycin and neomycin against 4 strains o f tested bacteriaμg/m L
2.2 LFcin B、Cecropin A、金霉素和新霉素联合药敏试验
由表3可知,Cecropin A与LFcin B联合使用对所试革兰氏阴性菌均表现为协同作用,LFcin B联用时的M IC是单用时的1/4,Cecropin A联用时的MIC是单用时的1/8~1/4;虽然无法计算两者联合使用对金黄色葡萄球菌的FIC指数,但可以看出LFcin B联用时的M IC是单用时的1/2,其抗菌活性增强。由表4和表5可知,金霉素与LFcin B或Cecropin A联合使用,对所试革兰氏阴性菌和革兰氏阳性菌表现为协同作用,金霉素和LFcin B或Cecropin A联用时的M IC都分别是单用时的1/8~1/4和1/8~1/2;由表6和表7可知,新霉素与LFcin B或Cecropin A联合使用时,对所试4种菌株均表现为无关作用。同样,虽然无法计算金霉素、新霉素分别与Cecropin A联合使用时对金黄色葡萄球菌的FIC指数,但可以看出联合使用后金霉素、新霉素的M IC值都是单用时的1/2。由表3至表7还可以看出,4种药物的两两合用对4种受试菌株均不表现拮抗作用。

表3 LFcin B、Cecropin A单用和联用的作用效果Tab le 3 Ef fects of LFcin B and Cecropin A alone and in combination against 4 strains o f tested bacteria
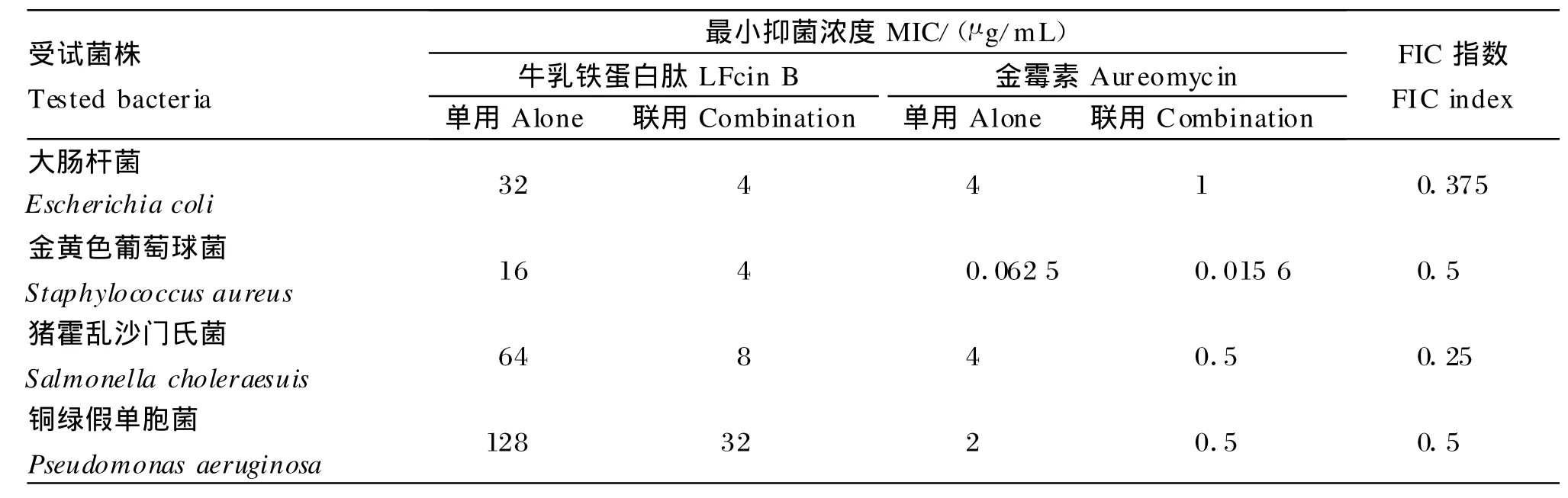
表4 LFcin B、金霉素单用或联用的作用效果Tab le 4 Ef fects of LFcin B and aureomycin alone and in com bination against 4 strains o f tested bac teria

表5 Cecropin A、金霉素单用和联用的作用效果Tab le 5 Effects o f Cecropin A and aureomycin alone and in combination against 4 strains o f tested bacteria

表6 LFcin B、新霉素单用和联用的作用效果Tab le 6 Effects o f LFcin B and neom ycin alone and in combination against 4 strains o f tested bacteria
3 讨 论
细菌感染引起的仔猪腹泻等问题已经严重影响畜牧业生产,尤其是耐药菌株的出现,更是增加了疾病治疗的难度。目前,细菌的耐药性突变是一个普遍存在的问题,在一些革兰氏阴性菌和阳性菌中存在多药耐受性。抗生素一般是通过抑制细菌细胞壁、蛋白质或DNA等的合成来达到杀菌目的,细菌耐药性产生的原因之一是由于突变产生了分解抗生素的酶基因,这种突变往往改变一个或几个基因就可以实现[8],而抗菌肽主要是通过与细胞膜作用而杀菌,细菌产生膜结构的突变比较困难,不易产生耐药性,因此,有望将抗菌肽开发成为一类新型的广谱高效抗菌药物。但天然的抗菌肽并非完美无缺,其抗菌活性还远远比不上抗生素,还有一部分抗菌肽对真核细胞具有一定的毒性,因此,如何提高抗菌肽的抗菌活性并最大限度降低毒性,使其能快速、有效地杀灭病原菌,成为人们关注与研究的热点。

表7 Cecropin A、新霉素单用和联用的作用效果Table 7 Ef fects of Cecropin A and neomycin alone and in combination against 4 strains of tested bacteria
许多研究表明,抗菌物质之间的协同作用,不仅可以提高抗菌治疗的作用,而且可以解释一些新型抗生素的抗菌机制。关于抗菌肽协同作用的研究已经有很多报道,Westerhoff等[9]发现来源于非洲爪蟾的抗菌肽magainina-2和PGLa具有显著的协同作用。Vorland等[10]报道红霉素和LFcin B联合使用对大肠杆菌具有协同抗菌作用,但LFcin B和盘尼西林G、万古霉素、庆大霉素等联合使用对金黄色葡萄球菌却没有协同抗菌作用。Wakabayashi等[7]研究表明,二甲胺四环素和单酰甘油能增强LFcin B抗金黄色葡萄球菌的抗菌活性,但甲氧苯青霉素、头孢去甲噻肟等不能增强其对金黄色葡萄球菌的抗菌活性。现在已知的4种协同抗菌机制包括:抑制一系列生化途径致细菌死亡,抑制保护性细菌酶的活性,增强对细菌细胞壁的联合作用以及增强其他抗菌物质的摄取等[11]。
本试验结果表明,Cecropin A与LFcin B联合使用对革兰氏阴性菌具有显著协同作用,联用时LFcin B的M IC是单用时的1/4,Cecropin A的MIC是单用时的1/8~1/4,其原因可能是二者的作用机制不一样。Cecropin A属于膜穿孔型抗菌肽,其抗菌机理是在微生物细胞膜上形成通道,引起细胞质溢流。Lockey等[12]利用电子显微镜和免疫胶体金技术观察到Cecropin A结合到大肠杆菌膜上,形成9.6 nm直径的病灶,其孔道直径为4.2 nm,孔洞导致细胞内容物外泄,细菌死亡。研究表明,LF-cin B可以与细胞膜结合,在膜上形成瞬时孔洞,使更多的LFcin B进入到细胞内,与胞内大分子物质结合,抑制蛋白质、DNA和/或RNA的合成[13-15]。也许正是由于Cecropin A引起的膜上通道的形成,为LFcin B进入细胞内创造了条件,从而导致联用后的抗菌活性明显增强。
金霉素与LFcin B联合使用对革兰氏阴性菌和阳性菌具有显著协同作用,两者联用时的M IC值是单用时的1/8~1/4,抗菌活性增强。金霉素属于四环素类抗生素,其抗菌机制是该药物与细菌核蛋白体30S亚基在A位特异性结合,阻止肽链延伸并抑制细菌蛋白质合成[16]。LFcin B与结合在细胞外膜脂多糖表面的2价阳离子(M g2+、Ca2+)竞争性结合细胞表面的阴离子成分,而金霉素可以吸附一部分阳离子,有利于LFcin B与细胞膜的结合。因此,两者具有相互促进作用。另外,LFcin B与细胞膜结合后,使细胞表面形成孔洞加速胞质外漏,促使更多的抗菌肽和金霉素进入胞内发挥作用。同时,有研究认为,这种协同作用是因为LFcin B干扰膜的正常生理功能,从而导致了细菌细胞壁渗透作用增强,同时使膜电势紊乱,最终造成细菌ATP依赖性传递耐药排出系统活性降低[7]。
新霉素单用时对所试4种菌株均有很好的杀菌效果,但与LFcin B或Cecropin A联合使用时,没有表现出协同作用。新霉素属于氨基糖苷类抗生素,主要抑制胞内蛋白质的合成,其杀菌作用呈浓度依赖性。有研究报道氨基糖苷类抗生素可以竞争性地取代细胞膜上的Mg2+、Ca2+,从而导致正常细胞膜屏障破坏,在细胞膜上形成瞬间孔道,破坏膜的渗透性[10]。新霉素的这种对细胞膜的作用机制,可能竞争性地阻止了Cecropin A、LFcin B与细胞膜上靶位点的结合,从而导致其不能有效地发挥抗菌作用。
4 结 论
LFcin B与Cecropin A、LFcin B与金霉素、Cecropin A与金霉素对革兰氏阴性菌及阳性菌均具有协同抑制作用,并且有效地降低了金霉素的抑菌浓度。
[1] ZASLOFFM.Antim icrobial pep tides of mu lticellular organisms[J].Nature,2002,415(6870):389-395.
[2] YEAMAN M R,YOUNT N Y.Mechanisms of antim icrobial pep tide ac tion and resistance[J].Pharm acological Reviews,2003,55(1):27-55.
[3] TOSSIA,SANDRI L,GIANGASPEROA.Amphipathic,alpha-helical antim icrobial peptides[J].Biopolymers,2000,55(1):4-30.
[4] X IONG Y Q,YEAMAN M R,BAYER A S.In vitroantibacterial ac tivities of p latelet m icrobicidal protein and neutrophil defensin againstStaphylococcus aureusare in fluenced by antibiotics differing in m echanism o f action[J].Antim icrobial Agents and Chemotherapy,1999,43(5):1111-1117.
[5] HANCOCK R E.Antibacterial peptides and the outer m embranes o f gram-negative bacilli[J].Journal of M edical M icrobiology,1997,46(1):1-3.
[6] HANCOCK R E.Hancock laboratory:methods[EB/ OL].[2001-11-27].h ttp://www.interchg.ubc. ca/both/M IC.htm.
[7] WAKABAYASH I H,TERGUCHIS,TAMURA Y.Increased staphylococcus-killing activity of an antim icrobial peptide,lac toferricin B,w ith m inocycline andm onoacylglycero l[J].Bioscience,Biotechnology,and Biochem istry,2002,66(10):2161-2167.
[8] 陈轶群,曹云鹤.抗菌肽研究进展[J].中国畜牧杂志, 2009,45(11):60-64.
[9] WESTERHOFFH V,ZASLOFFM,ROSNER J L, et al.Functional synergism o f the m againins PGLa and magainin-2 inEscherichia coli,tumor cells and liposomes[J].European Journal of Biochem istry, 1995,228(2):257-264.
[10] VORLAND L H,OSBAKK S A,PERSTOLEN T, et al.Interference of the antim icrobial pep tide lactoferricin B w ith the action of various antibiotics againstEscherichia coliandStaphylococcus aureus[J].Scandinavian Journal o f In fectious D iseases, 1999,31(2):173-177.
[11] ULVATNE H,KAROLIUSSEN S,STIBERG T,et al.Short antibacterial peptides and erythromycin act synergically againstEschierichia coli[J].Journal of Antim icrobial Chemotherapy,2001,48(2):203-208.
[12] LOCKEY T D,OURTH D D.Formation of pores inEscherichia colicellm embranes by a cecropin isolated from hemo lym ph ofHeliothis virescenslarvae [J].European Journal of Biochem istry,1996,236 (1):263-271.
[13] UMEYAMA M,K IRA A,NISHIM URA K,et al. In terac tions of bovine lactoferricin with acidic phospholipid bilayers and its antim icrobial activity as studied by solid-state NMR[J].Biochim ica et Biophysica Acta,2006,1758(9):1523-1528.
[14] ULVATNE H,HAUKLAND H H,O lSV IK O,et al.Lacto ferricin B causes depo larization of the cy toplasm ic membrane ofEscherichia coliATCC25922 and fusion of negatively charged liposomes[J]. FEBS Letters,2001,492(1/2):62-65.
[15] ULVATNE H,SAM UELSEN O,HAUKLAND H H,et al.Lactoferricin B inhibits bacterialm acromolecular synthesis inEscherichia coliandBacillus subtilis[J].FEMS M icrobiology Letters,2004,237 (2):377-384.
[16] 张兆山.病原细菌生物学研究与应用[M].北京:化学工业出版社,2007:103-104.
*Correspond ing au thor,p rofessor,E-m ail:yzw ang@zju.edu.cn
(编辑 尚彬如)
