爱拔益加肉鸡和北京油鸡脂肪代谢及其相关基因表达的比较研究
2010-04-17蒋瑞瑞赵桂苹陈继兰郑麦青刘冉冉胡耀东文杰
蒋瑞瑞 赵桂苹 陈继兰 郑麦青 刘冉冉 李 鹏 胡耀东 文杰
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
与哺乳动物相比较而言,禽肉的脂肪沉积主要为皮下脂肪和腹脂,肌内脂肪(IMF)沉积仅占体脂沉积的很小一部分。腹脂通常作为下脚料被废弃,而IMF的沉积量与肉的风味和多汁性显著相关[1]。由于沉积单位脂肪比沉积单位瘦肉要多耗3倍的能量,肉鸡腹脂和皮脂的过多沉积,一方面造成能量浪费,另一方面也不符合人们日益提高的对肉品质的要求。爱拔益加(AA)肉鸡生长速度快,生产效率高,但是肉质风味欠佳,北京油鸡生长速度慢,相对效率低,但肉质细腻、鲜美。机体脂肪代谢和调控机制的差异是造成不同品种脂肪分布与沉积量差异的内在机制之一,但是目前仍不十分明了。随着分子生物学技术的广泛应用,近年来开展了许多功能基因和候选基因的研究工作,脂肪酸结合蛋白(FABPs)、过氧化物酶体增殖物激活受体(PPARs)、甘油三酯脂酶(ATGL)、载脂蛋白A(apoA)、载脂蛋白B (apoB)等基因是被证实了的与脂肪代谢相关的基因[2-7],为进一步的研究提供了理论基础。本研究选择了生长速度和脂肪沉积存在显著差异的2个品种(AA肉鸡和北京油鸡)为研究素材,通过比较在相同日龄和不同上市日龄的体脂沉积量、血脂代谢水平、酶活以及相关基因m RNA表达量,以期在不同调控层面上探讨造成品种间脂肪沉积差异的内在调控机制,为肉鸡的选育工作提供理论基础。
1 材料与方法
1.1 试验动物与饲养管理
选用体重均一的1日龄雌性AA肉鸡60只和北京油鸡120只,每个品种随机分为6个重复(AA肉鸡每重复10只,北京油鸡每重复20只),饲养于标准鸡舍。育雏前2天室温保持35℃,从第3天开始至第28天逐渐降温至28℃,之后维持室温28℃,相对湿度为45%,24 h光照。自由采食和饮水。以《中华人民共和国农业行业标准(鸡饲养标准)》(2004)建议量配制玉米-豆粕型基础饲粮,饲粮组成及营养水平见表1。
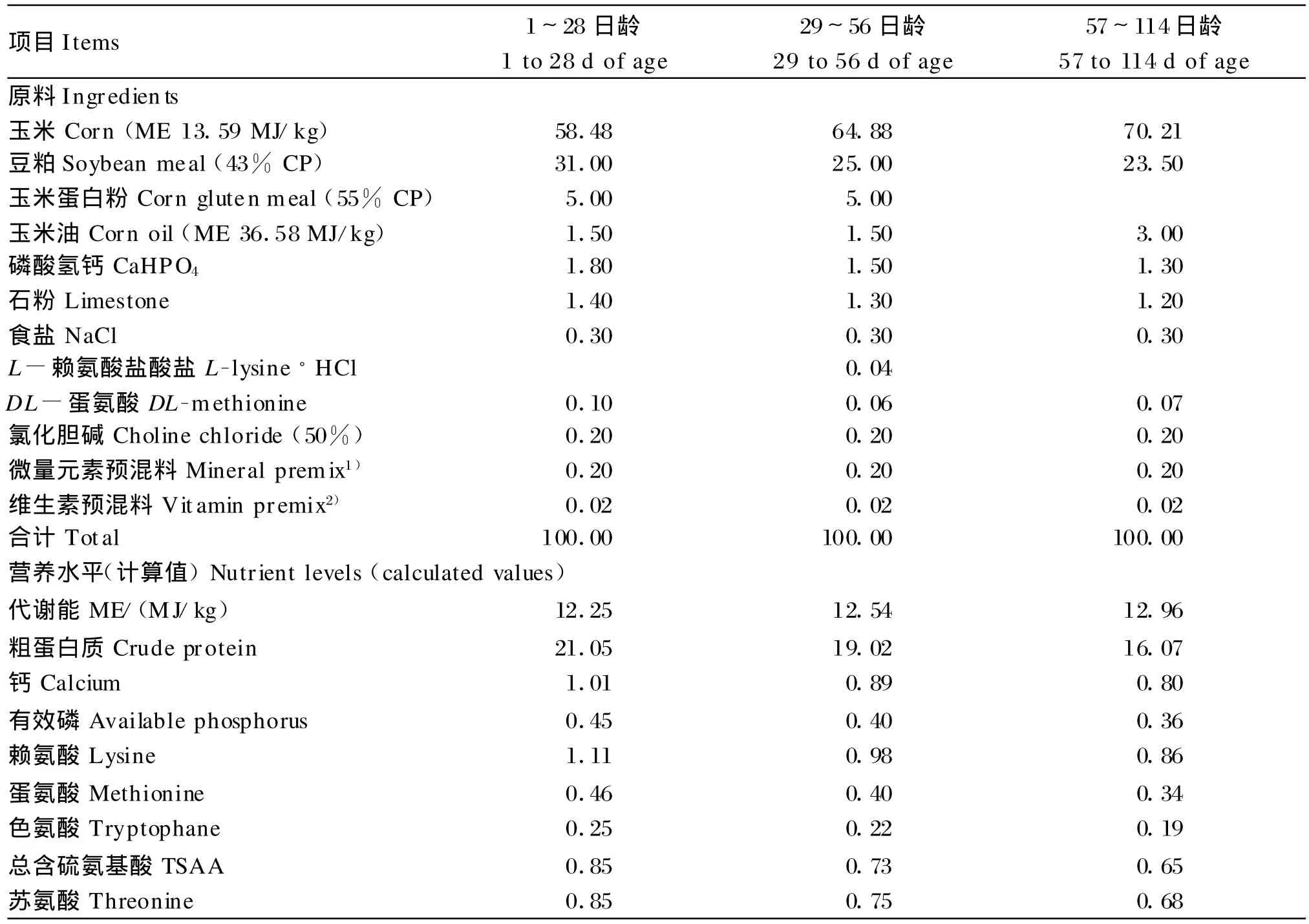
表1 饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of diets(air-d ry basis)%
1.2 样品的采集和测定
1.2.1 样品采集和屠体指标的测量
由于生长速度的差异,AA肉鸡饲养至56日龄进行屠宰,北京油鸡分别于56日龄和114日龄(上市日龄)进行屠宰。禁食12 h后,每个重复中随机选取6只鸡称量活体重并采集全血(3只/重复,翅静脉采血,分离血浆备用),颈静脉放血处死,脱毛后尽快取肝脏、胸肌和腹脂各50~100mg,速冻于液氮中,用于提取m RNA。用游标卡尺测量皮脂厚和肌间脂带宽(3只/重复)。剥离腹脂、双侧胸肌和腿肌并称重,计算胸肌率、腿肌率和腹脂率(相对于活体重的比例)。采用索氏抽提法测定胸肌IMF含量[8]。
1.2.2 血液生化指标的测定
用南京建成生物工程研究所生产的试剂盒测定血浆总甘油三酯(TG,F001)、总胆固醇(TCHO, F002)、高密度脂蛋白胆固醇(HDLC,F003)、低密度脂蛋白胆固醇(LDLC,F004)、游离脂肪酸(FFA, A 042)浓度及血浆脂蛋白酯酶(LPL,A 067)活性和肝脏苹果酸脱氢酶(MDH,A 021)活性。用鸡脂联素(adiponectin)和瘦素(leptin)ELISA试剂盒(Ad litteram Diagnostic Laboratories Inc.,USA)测定血浆中的脂联素和瘦素浓度。
1.2.3 基因表达丰度的荧光定量分析
采用Invitrogen公司的Trizol试剂盒提取总RNA,并用1%的琼脂糖凝胶电泳检测其浓度和完整性。用Promega公司的反转录试剂盒反转录,所有的cDNA用18S rRNA检测。本研究定量的基因及其引物序列见表2。采用SYBR Green荧光染料法,在ABI 7500荧光定量PCR仪上进行荧光实时定量分析。20μL反应体系中包括:10μL 2× SYBR GreenⅠRT-PCR Master M ix(App lied Biosystems,Foster City,USA),上下游引物各0.75μL(10 pmol/μL),1μL cDNA模板和7.5μL无RNA酶的去离子水。循环程序为:50℃2 m in (消除非特异扩增及遗留污染),95℃10 m in(活化Am pliTaq Gold酶),95℃变性15s,61~65℃退火(具体基因见表2)、延伸共60 s(40个循环),每次延伸结束后采集1次荧光信号。通过计算2-ΔΔCT值来衡量不同品种间基因相对表达量的差异[9]。ΔΔCT= (CT目的基因-CT18S rRNA)-(CT考察组-CT对照组)。本试验以56日龄北京油鸡的基因m RNA表达量为对照组,指定其表达水平为1。
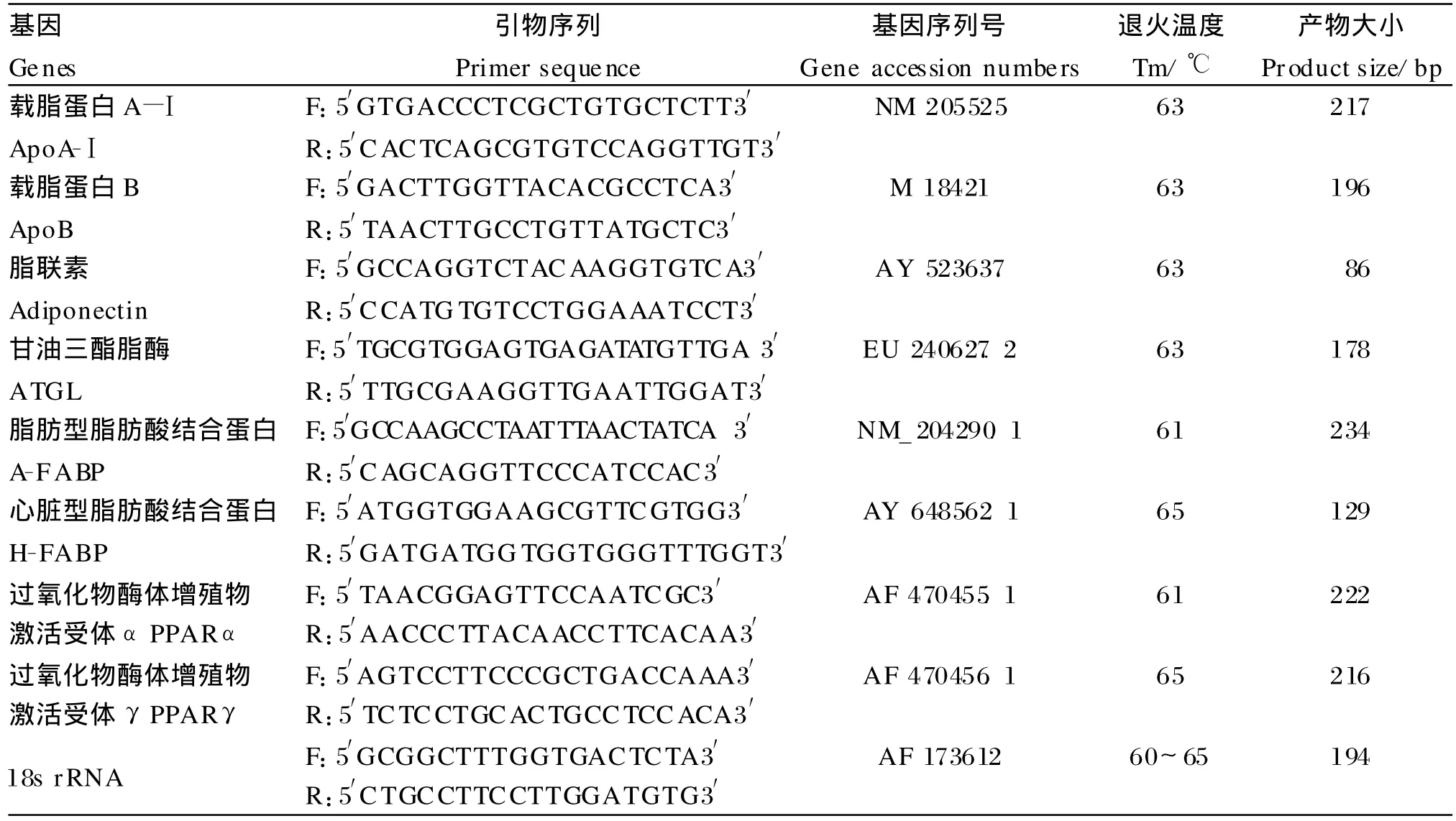
表2 基因序列号及引物序列Table 2 Gene accession numbers and p rimer sequences
1.3数据统计分析
采用SAS 9.1统计软件一般线性模型(GLM)中的ANOVA程序,对56日龄AA肉鸡、56日龄和114日龄北京油鸡的各项指标进行分析,差异显著者采用Duncan氏法进行多重比较。结果用平均值±标准误表示,以P<0.05为差异显著性标准。
2 结 果
2.1 胴体品质和脂肪沉积
由表3可知,除腹脂率和IM F含量之外,56日龄AA肉鸡的各项胴体指标均显著高于同日龄和上市日龄的北京油鸡(P<0.05)。56日龄AA肉鸡腹脂率高于同日龄的北京油鸡(P<0.05),但是低于上市日龄的北京油鸡(P<0.05)。北京油鸡的半净膛率并没有随日龄的增长发生显著变化(P>0.05),其他指标均显著增加(P<0.05)。相同日龄时北京油鸡IM F含量低于AA肉鸡(P<0.05),但上市日龄时2个品种间差异不显著(P>0.05)。
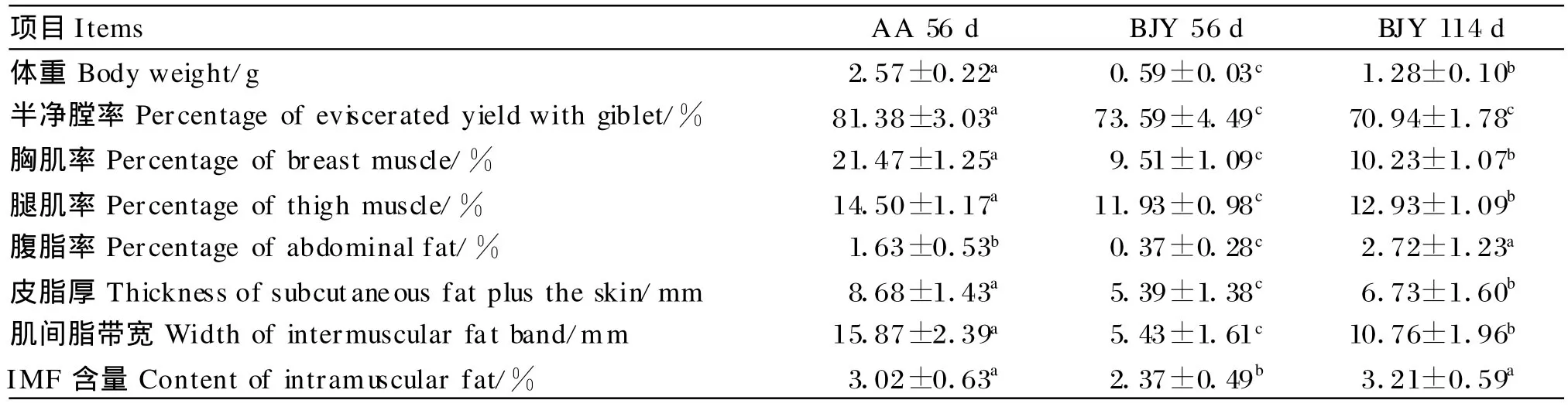
表3 爱拔益加肉鸡和北京油鸡胴体品质和脂肪沉积Table 3 Carcass characteristics and fat deposition of AA broilers and Beijing-you(BJY)chickens
2.2 血液生化指标及酶活
由表4可知,56日龄和114日龄的北京油鸡血浆TG、FFA和脂联素浓度,血浆LPL活性和肝脏MDH活性均高于56日龄AA肉鸡(P<0.05)。2个品种间HDLC浓度仅在56日龄时有显著差异,北京油鸡高于AA肉鸡(P<0.05)。品种和日龄对血浆TCHO和瘦素浓度均无显著影响(P>0.05)。品种对血浆LDLC浓度的影响没有达到显著水平(P>0.05),但114日龄北京油鸡血浆LDLC浓度低于56日龄(P<0.05)。随日龄增大,北京油鸡血浆脂联素浓度和肝脏MDH活性增加(P<0.05),血浆HDLC浓度和LPL活性减小(P<0.05)。

表4 爱拔益加肉鸡和北京油鸡血液生化指标及酶活Table 4 Blood biochem ical indices and enzyme activities of AA broilers and Beijing-you(BJY)chickens
2.3 脂肪代谢相关基因的表达
由表5可知,56日龄AA肉鸡肝脏apoA-Ⅰ基因mRNA表达量高于56日龄和114日龄北京油鸡(P<0.05),脂联素基因m RNA表达量高于114日龄北京油鸡(P<0.05),56日龄北京油鸡肝脏apoB基因m RNA表达量高于114日龄(P<0.05),但品种间差异不显著(P>0.05)。

表5 爱拔益加肉鸡和北京油鸡肝脏脂肪代谢相关基因的表达Table 5 Related genes expression in hepatic fat of AA broilers and Beijing-you(BJY)chickens
由表6可知,56日龄AA肉鸡腹脂中的ATGL和心脏型脂肪酸结合蛋白(H-FABP)基因m RNA表达量高于114日龄的北京油鸡(P<0.05),脂肪型脂肪酸结合蛋白(A-FABP)基因和脂联素基因mRNA表达量低于114日龄北京油鸡(P<0.05);56日龄AA肉鸡过氧化物酶体增殖物激活受体γ(PPARγ)基因mRNA表达量低于56日龄北京油鸡(P<0.05);随着日龄的增加,北京油鸡腹脂A-FABP基因m RNA表达量增加(P<0.05),PPARγ基因m RNA表达量降低(P<0.05)。品种和日龄对腹脂过氧化物酶体增殖物激活受体α(PPARα)基因mRNA的表达量没有显著影响(P>0.05)。

表6 爱拔益加肉鸡和北京油鸡腹脂脂肪代谢相关基因的表达Tab le 6 Re lated genes exp ression in abdom inal fat of AA broilers and Beijing-you(BJY)chickens
2.4 基因表达与体重和腹脂率的相关分析
由表7的相关分析结果表明,肝脏apoA-Ⅰ、腹脂ATGL和H-FABP基因m RNA表达量与体重显著正相关(P<0.05),腹脂A-FABP基因m RNA表达量与腹脂率显著正相关(P<0.05)。腹脂H-FABP基因m RNA表达量与腹脂ATGL基因和肝脏脂联素基因m RNA表达量显著正相关(P< 0.05)。腹脂PPARα基因m RNA表达量与腹脂ATGL、H-FABP以及肝脏apoB和脂联素基因m RNA表达量显著正相关(P<0.05)。肝脏中脂联素基因mRNA表达量与apoA-Ⅰ基因m RNA表达量显著正相关(P<0.05),而腹脂中脂联素基因m RNA表达量与A TGL基因m RNA表达量显著负相关(P<0.05)。
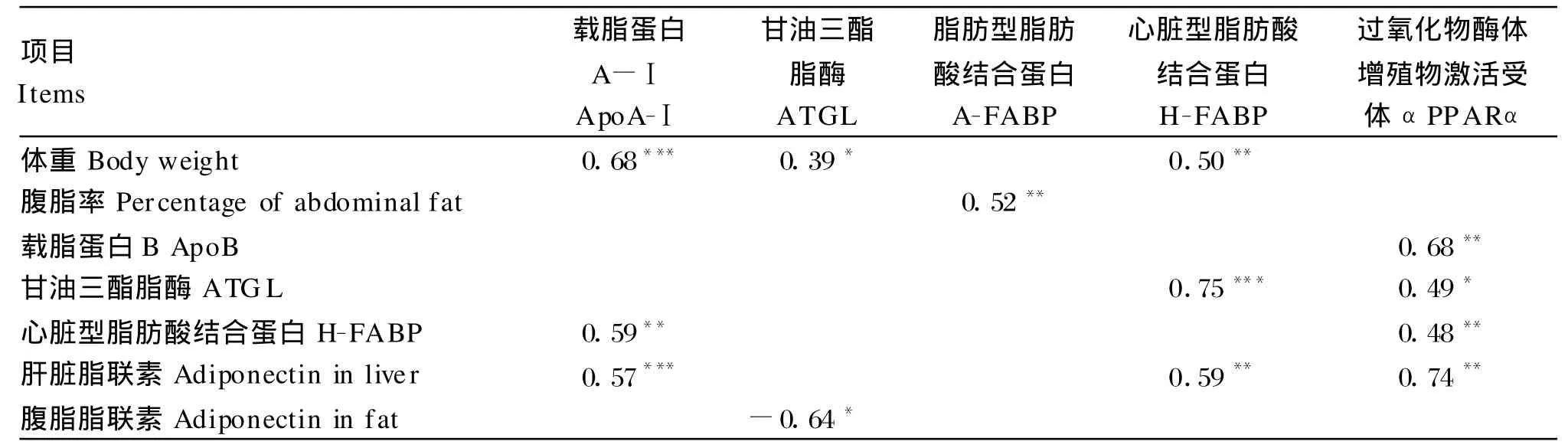
表7 基因表达相关分析Tab le 7 Correlation analysis of gene exp ression
3 讨 论
考虑到育肥期对脂肪沉积的影响和2个品种上市日龄的巨大差异,本研究将56日龄AA肉鸡分别与56日龄(相同日龄)和114日龄(上市日龄)北京油鸡各项指标进行比较。结果表明,相同日龄时AA肉鸡的体增长和脂肪沉积速度均远大于北京油鸡;但是生长后期北京油鸡脂肪沉积的潜力更大,腹脂率和IMF含量分别比AA肉鸡高66.87%和 6.29%,其中,IMF含量的差异并没有达到显著水平。
家禽肝外脂肪的沉积依赖于脂蛋白代谢的2个连续步骤:1)脂蛋白的合成和转运速率;2)脂蛋白在血管内的降解及脂肪被脂肪组织吸收和贮存速度[10]。MDH是脂肪合成的关键酶之一,主要存在于肝脏,该酶活性与肉仔鸡腹脂和体脂含量有关[11]。鸡肝脏形成的脂肪以极低密度脂蛋白(V LDL)形式释放出来,在LPL的作用下在外周组织被水解,产生的脂肪酸被外周组织吸收用于氧化或酯化并以甘油三酯的形式被贮存。56日龄和114日龄北京油鸡肝脏MDH和血浆LPL活性均高于AA肉鸡,提示北京油鸡具有更强的脂肪合成能力和水解VLDL的能力,从而使更多的FFA进入外周组织。本试验中2个日龄北京油鸡血浆TG和FFA浓度均显著高于AA肉鸡,推测与北京油鸡具有较高的肝脏MDH和血浆LPL活性有关。
apoA-Ⅰ是高密度脂蛋白(HDL)的重要组成部分,对胆固醇动态平衡起重要作用[12]。肝脏和小肠是育成鸡apoA-Ⅰ合成和分泌的主要部位[13],血浆HDL浓度与肝脏apoA-Ⅰ基因mRNA水平相关[14-15]。本研究发现,对于北京油鸡而言,肝脏apoA-Ⅰ基因mRNA表达量和HDLC浓度随日龄的增加变化趋势一致。AA肉鸡肝脏apoA-Ⅰ基因m RNA表达量远远高于北京油鸡,该结果与李文娟[16]报道一致。本研究相关分析结果表明,鸡肝脏apoA-Ⅰ基因m RNA表达量与体重有显著的正相关。apoB是VLDL的重要组成部分,肝脏分泌的apoB对脂肪的转运有重要作用[17]。Zhang等[18]发现在apoB基因第26个外显子的123位点碱基T同义突变为G,同时终止密码子500个碱基之后有9个碱基的缺失,通过单核苷酸多态性和单倍型分析,发现这2处核苷酸多态性可能与体增长和脂肪沉积相关。本研究结果表明,AA肉鸡和北京油鸡之间肝脏apoB基因mRNA表达量的差异并未达到显著水平。
脂联素是哺乳动物脂肪组织中大量表达的脂肪细胞因子[19],在脂肪和碳水化合物的代谢过程中起重要作用。与哺乳动物不同,M addineni等[20]研究发现,脂联素基因在鸡体内,除了在脂肪组织中大量表达外,在肝脏、间脑、垂体前叶、肾脏、卵巢、脾脏、骨骼肌中都有表达,并且肝脏的表达量仅次于脂肪。肝脏是禽类脂肪合成的主要器官,因此本文比较了AA肉鸡和北京油鸡肝脏和脂肪组织脂联素的表达情况。人类医学研究表明:血浆脂联素浓度与体形参数和内脏脂肪沉积负相关[21-22],肥胖病人和小鼠的脂联素基因m RNA水平均低于正常个体[23]。但是本研究结果并不能得出完全一致的结论,AA肉鸡的血浆脂联素浓度显著低于北京油鸡,与之相应的是体重显著高于北京油鸡,56日龄时腹脂率高于北京油鸡。同在上市日龄,AA肉鸡的体重是北京油鸡的将近2倍,但是腹脂率仅为北京油鸡的1/2左右,此时,AA肉鸡腹脂脂联素基因m RNA表达量显著低于114日龄北京油鸡,而肝脏脂联素基因m RNA表达量显著高于114日龄的北京油鸡。相关分析结果表明,腹脂脂联素基因表达量与体重负相关(r=-0.35,P=0.09),而与腹脂率正相关(r=0.39,P=0.07),但是均未达到显著水平。由于禽类的脂联素在多个组织中表达,体增长和脂肪沉积可能受到各个组织表达量的综合影响,在此我们仅探讨了2个品种间肝脏和脂肪组织的表达差异。
激素敏感脂酶(HSL)一直被认为是脂肪细胞脂动员过程中唯一的脂肪水解限速酶,但是HSL基因敲除鼠的出现揭示了另一个脂肪分解酶的重要作用,即ATGL是启动脂肪动员,催化甘油三酯第1步水解的关键酶,并证明了ATGL催化甘油三酯水解为甘油二酯,但不水解胆固醇或者视黄酯[7]。目前关于ATGL对鸡脂肪沉积的影响研究鲜有报道,本研究初步比较了不同品种肉鸡的腹脂ATGL基因m RNA表达量,发现AA肉鸡腹脂ATGL基因m RNA表达量显著高于北京油鸡,提示AA肉鸡腹脂脂肪动员可能比北京油鸡活跃,从而导致品种间腹脂沉积量的差异。
H-FABP基因及A-FABP基因是影响IM F含量的候选基因[5-6]。H-、A-FABP属于FABPs家族,是参与机体细胞内脂肪酸的摄取,并协助其运输的一种蛋白质。作为细胞内脂肪酸及其辅酶A的贮存库,FABPs能够在较大范围内以脂肪酸浓度的方式来调控机体内的脂类代谢过程[24-25]。本研究结果表明AA肉鸡H-FABP基因m RNA表达量显著高于北京油鸡,A-FABP基因mRNA表达量显著低于北京油鸡。体重与H-FABP基因m RNA表达量显著正相关,与A-FABP基因m RNA表达量在0.10的水平上负相关。值得注意的是,当相同日龄比较时,H-FABP基因m RNA表达量与腹脂率和IM F沉积正相关,但是与上市日龄比较时,却表现为显著的负效应。A-FABP基因m RNA表达量与腹脂率显著正相关,推测A-FABP基因是造成2个品种腹脂沉积量差异的关键基因之一。
PPARs属于激素核受体家族,可直接参与细胞脂类代谢,并能调控多种参与细胞脂类代谢的目的基因[3]。PPARα和PPARγ是PPARs家族的2个亚型,本研究中PPARα在品种间没有表现出显著的差异。PPARγ协同C/EBP(CCAAT)转录因子影响脂肪酸在脂肪组织中的贮存,能诱导脂肪前体细胞成熟为脂肪细胞,是脂肪细胞分化的一部分[16]。本研究发现,56日龄的北京油鸡PPARγ基因m RNA表达量显著高于56日龄AA肉鸡和114日龄北京油鸡,但是上市日龄的AA肉鸡和北京油鸡之间没有显著差异。
脂肪代谢是一个多基因、多途径的复杂过程。目前单个基因多态性和基因表达对脂类代谢的影响研究较多,但是代谢通路上各个基因之间的相互影响及调控机制并不明了。本研究通过相关分析发现,鸡腹脂ATGL基因、PPARα基因、肝脏apoA-Ⅰ基因和脂联素基因m RNA表达量均与腹脂H-FABP基因m RNA表达量显著正相关,同时肝脏中apoA-Ⅰ基因m RNA表达量与脂联素基因mRNA表达量显著正相关,提示H-FABP是脂类代谢通路上的关键基因。肝脏脂联素基因、apoB基因以及腹脂ATGL基因m RNA表达量与腹脂PPARα基因m RNA表达量显著正相关,也说明PPARα基因可能是代谢通路中处于调控节点的基因。这些基因表达水平之间的关系为进一步深入研究脂肪代谢的调控机制提供了一定的理论基础。
4 结 论
①北京油鸡血浆LPL和MDH活性高于AA肉鸡,从而导致较高的血浆TG和FFA浓度,可能是北京油鸡脂肪沉积较高的内在因素之一。
②A-FABP基因是造成2个品种腹脂沉积量差异的关键基因,H-FABP是脂类代谢通路上的关键基因。
[1] CH IZZOLINI R,ZANARD I E,DORIGONI V, et al.Calorific value and cholesterol content of norm al and low fatmeat and meat p roducts[J].Trends in Food Science&Techno logy,1999,10:119-128.
[2] 王洪宝,王启贵,李辉.利用基因芯片技术研究两品种鸡脂肪组织差异表达基因[J].生物工程学报,2005, 21(6):979-982.
[3] 罗永富.脂肪酸结合蛋白的功能特征[J].生命的化学,1992,12:22-25.
[4] ZHANG S,SHI H,LI H.Cloning and tissue exp ression characterization of the chicken APOB gene [J].Animal Biotechnology,2007,18:243-250.
[5] 叶满红.鸡脂肪酸结合蛋白基因的克隆及其与肌内脂肪含量关系的研究[D].博士学位论文.北京:中国农业科学院,2003.
[6] 仇雪梅.影响生长核肉质性状的主要候选基因的研究[D].博士学位论文.北京:中国农业大学,2004.
[7] ZIMMERMANN R,STRAUSS JG,HAEMMERLE G,et al.Fat m obilization in adipose tissue is p rom oted by adipose triglyceride lipase[J].Science, 2004,306(5700):1383-1386.
[8] ZERHDARAN S,VEREIJKEN A L,VAN ARENDONK JA,et al.Estimation of genetic parameters for fat deposition and carcass traits in broilers[J]. Poultry Science,2004,83(4):521-525.
[9] LIVAK K J,SCHM ITTGEN T D.Analysis of relative geneexp ression data using real-time quantitative PCR and the 2[-Delta Delta C(T)]method[J]. Methods,2001,25:402-408.
[10] 尹靖东,齐广海,霍启光.家禽脂类代谢调控机理的研究进展[J].动物营养学报,2000,12(2):1-7.
[11] DUNCAN H J,COMMON R H.G lucose oxidation by liver slices from the dom estic fow l.A ctivity of the phosphog luconate-oxidative pathw ay[J].Canadian Journal o f Biochem istry,1967,45:979-989.
[12] SILVER D L,JIANG X C,ARAI T,etal.Receptors and lipid transfer p roteins in HDL metabolism [J].Annals of the New York Academ y o f Sciences, 2000,902:103-111.
[13] SM ITH L C,POWNALL H J,GOTTO A M Jr. The p lasma lipop roteins:structure and metabolism [J].Annual Review o f Biochem istry,1978,47: 751-757.
[14] SORCI-THOMASM,HENDRICKSC L,KEARNS M W.HepG 2 cell LDL recep tor activity and the accumulation of apo lipop rotein B and E in response to docosahexaenoic acid and cholesterol[J].Journal of Lipid Research,1992,33:1147-1156.
[15] HERMANN M,FOISNER R,SCHNEIDER W J, et al.Regulation by estrogen of synthesis and secretion o f apolipoprotein A-Ⅰin the chicken hepatom a cell line,LMH-2A[J].Biochim ica et Biophysica A cta,2003,1641:25-33.
[16] 李文娟.鸡肉品质相关脂肪代谢功能基因的筛选及营养调控研究[D].博士学位论文.北京:中国农业科学院,2008.
[17] SCHUMAKER V N,PH ILLIPS M L,CHATTERTON JE.Apo lipop rotein B and low-density lipop rotein structure:implications for biosyn thesis of triglyceride-rich lipoproteins[J].Advances in Protein Chem istry,1994,45:205-248.
[18] ZHANG S,LIH,SH IH.Singlem arker and hap lotype analysis o f the chicken apolipop rotein B gene T123G and D9500 D9-polym orph ism reveals association w ith body grow th and obesity[J].Pou ltry Science,2006,85:178-184.
[19] KADOWAKI T,YAMAUCH I T.Adiponectin and adiponectin receptors[J].Endocrine Review s, 2005,26:439-451.
[20] MADD INEN I S,M ETZGER S,OCON O,et al. Adiponectin gene is exp ressed in mu ltiple tissues in the ch icken:food dep rivation in f luences adiponectin m essenger ribonucleic acid exp ression[J].Endocrinology,2005,146:4250-4256.
[21] ARITA Y,K IHARA S,OUCH IN,et al.Paradoxical decrease of an adipose-specific p rotein,adiponectin,in obesity[J].Biochem ical and Biophysical Research Comm unication,1999,257:79-83.
[22] RYO M,NAKAMURA T,KIHARA S,et al.Adiponectin as a biom arker of the metabolic synd rome [J].C irculation Journal,2004,68:975-981.
[23] HU E,LIANG P,SPIEGELMAN BM.Adipo Q is a novel adipose-specific gene dysregulated in obesity [J].The Journal o f Biological Chem istry,1996, 271:10697-10703.
[24] VEERKAMP J H,MOERKERK H T.Fatty acid binding p rotein and its relation to fatty acid oxidation[J].M olecular and Cellular Biochem istry,1993, 123:101-106.
[25] BANASZAK L,W INTER N,XU Z,et al.Lipidbinding p roteins:a fam ily of fatty acid and retinoid transport p roteins[J].Advances in Protein Chem istry,1994,45:89-151.
*Correspond ing au thor,p rofessor,E-m ail:w enj@iascaas.net.cn
(编辑 何丽霞)
