国内期刊医疗器械风险管理研究文献计量学分析
2010-04-17邝俊健邝慧马冠群彭华强容丽
邝俊健邝慧马冠群彭华强容丽
(1广西梧州市中医院药剂科,广西 梧州 543002;2广西梧州三鹤药业有限公司;3广西梧州制药(集团)股份有限公司)
国内期刊医疗器械风险管理研究文献计量学分析
邝俊健1邝慧2马冠群3彭华强1容丽1
(1广西梧州市中医院药剂科,广西 梧州 543002;2广西梧州三鹤药业有限公司;3广西梧州制药(集团)股份有限公司)
【摘要】目的:深入了解我国关于医疗器械风险管理的研究进展与实际应用。方法:利用中文期刊全文数据库(CNKI)与中文科技期刊数据库(VIP)检索出的相关文献,采用文献计量学方法对国内医疗器械风险管理文献的时间分布、期刊分布、作者分布及文献涉及的内容等方面进行研究,并就我国的药品医疗器械风险管理现状进行归纳与分析。结果:我国对医疗器械风险管理的研究呈增长趋势,现已形成核心作者群,各级医疗机构和药监部门是文献的主要来源;具体的研究内容基本可以分为四大类,以问题和建议类、论著类居多。结论:我国在该领域的相关工作刚刚起步,尚缺乏系统化,法规和技术等亟待完善。
【关键词】医疗器械;风险管理;不良事件;文献计量分析
风险管理最早起源于航空工业,医疗器械也是较早开展风险管理活动的工业产品门类之一。世界上最早对医疗器械提出风险管理应用要求的标准是EN1441:1997,国际标准化组织ISO/TC 210工作组和国际电工委员会IEC/SC 62A工作组联合将该标准进行更新,发布了ISO14971-1:1998标准,在2000年后又进行了修订,相继发布了2000版、2007版,成为国际医疗器械风险管理活动的公认准则。我国在2000年等同转化ISO14971-1:1998,发布了YY/T0316-2000《医疗器械—风险管理:风险分析对医疗器械的应用》。2003年等同转化ISO14971:2000,发布了YY/T0316-2003《医疗器械—风险管理对医疗器械的应用》。2008年4月,国家食品药品监督管理局(SFDA)发布了YY/T0316-2008《医疗器械—风险管理对医疗器械的应用》,该标准等同转化自ISO14971:2007,代替YY/T0316-2003,自2009年6月1日起实施[1]。医疗器械风险管理是用于医疗器械风险分析、评价和控制工作的管理方针、程序及其实践的系统,是一个循环反馈的完整体系,包括风险分析、风险评价和风险控制;风险评价是在风险分析的基础上进行的,风险控制是风险管理中最重要的一项活动。一个医疗器械的批准上市,仅仅表明该产品的风险可以接受,或者收益大于风险。因此积极有效的风险管理,是保障成品安全、有效的重要措施。本文运用文献计量学方法,对医疗器械风险管理研究文献进行分析,深入了解目前我国医疗器械风险管理的研究现状和发展方向。
1 文献来源
以“医疗器械”or“风险”or“管理”为关键词,对中文期刊全文数据库(CNKI)与中文科技期刊数据库(VIP)的相关文献进行检索。共检索文献78篇,剔除20篇信息通报等报道类文献、重复文献之后,得到有效文献58篇。
2 文献分析
2.1 文献的发表时间分布
文献检索未限定时间,截至2010年8月,共检索有效文献58篇。其中,CNKI和VIP中首次出现以“医疗器械”和“风险管理”为关键词的文献时间为2003年,具体文献分布时间如图1。因我国医疗器械风险管理的研究工作起步较晚,相关研究文献最早出现在2003年[2],该文通过介绍美国、欧盟和有关国际组织在该领域的有关进展,分析医疗器械上市后风险管理可采取的主要措施,阐述了我国在该领域的相关工作刚刚起步,尚缺乏系统化,法规和技术体系等亟待完善。随着医疗器械风险管理概念的深入以及国外医疗器械风险管理的工作效果,我国对此的相关研究也逐渐展开,尤其在2008~2010年的文献量达到最高,占全部文献的50%。充分显示了医疗器械风险管理的研究越来越得到重视。
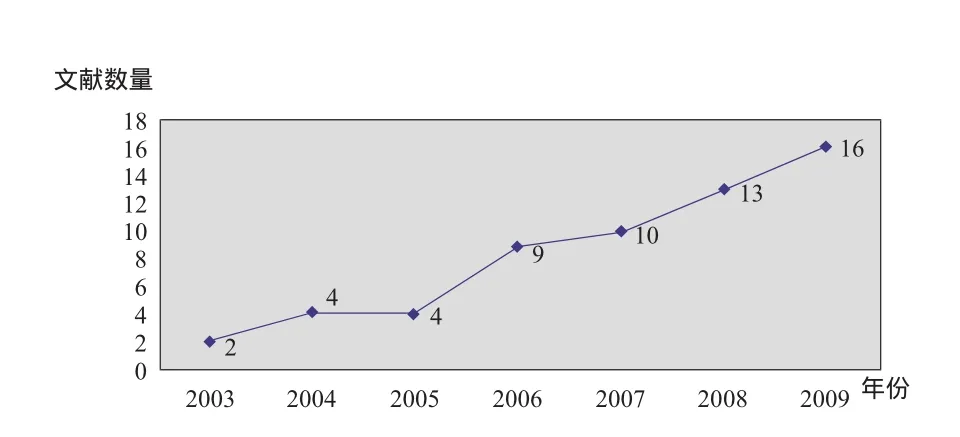
图1 文献数量及发表的时间分布
2.2 文献的期刊分布
收集到的58篇文献分别刊登在23种期刊杂志上,其中10种期刊共刊登了2篇以上的相关文献,其余刊物仅刊登1 篇(图2)。医疗器械风险管理的系列研究文献主要集中发表于《中国医疗器械信息》、《中国药物警戒》、《中国医学设备》、《中华医院管理杂志》,表明这几类期刊对医疗器械风险管理研究领域的关注度较高,但另一方面也反映出我国医疗器械风险管理系列研究还处于起步阶段,研究成果并不多。
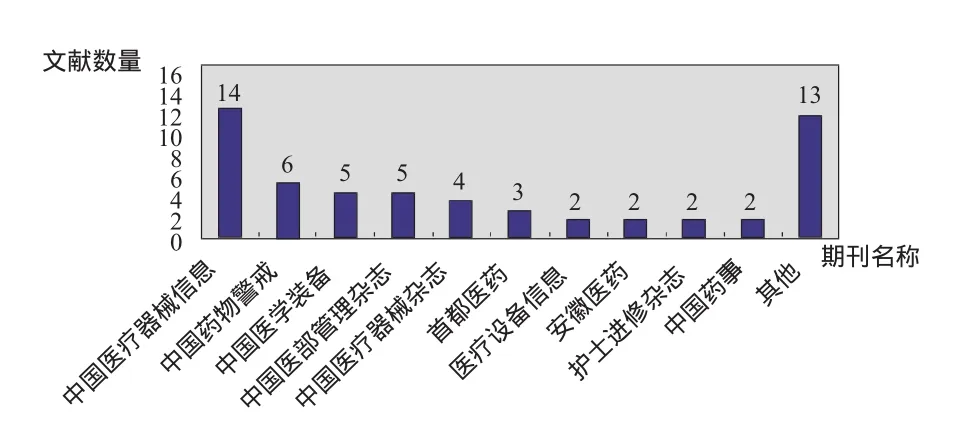
图2 2003~2010年医疗器械风险管理文献量的分布
2.3 文献的作者分布
从表1可以看出,尽管文献的作者分布相对比较分散,但已形成主要的研究学者。欧阳昭连、池慧[3-7]等通过对国内外医疗器械的风险管理发展的系统性回顾,阐述了将风险管理引进在用医疗器械管理的重要意义,同时通过对比国内外医疗器械风险管理的现状及存在问题,重点分析制约医疗器械风险管理发展的因素,探寻我国与国外的一些国家对医疗器械风险管理手段的差异,从中为我国医疗器械风险管理提出可行性建议。
2.4 文献的来源机构
统计发现,所发表文献主要来源于各级医疗机构、药监部门、不良反应监测中心、学校、医疗器械企业、医疗信息研究,约占总文献量的81.30%。从机构性质来看,各级医院和药监部门是文献的主要来源,占文献总数的50%(见图3),其他机构文献研究数量较为平均。从图表中可以发现,对医疗器械风险管理研究较为关注的为各级医疗机构,其次为执行医疗器械标准的药监部门。一方面反映了医疗机构和药监部门对于医疗器械风险管理的重视程度,另一方面也暴露出了社会其他部门的参与度不高,尤其是医疗器械企业,文献发表比例仅为7%。医疗器械风险管理是一个系统工程,需要社会各个部门的积极参与,尤其是直接参与器械生产、销售的医疗器械企业的积极配合是我国医疗器械风险管理不可或缺的重要力量。

表1 2003~2010年刊登2篇以上医疗器械风险管理文献的主要作者分布
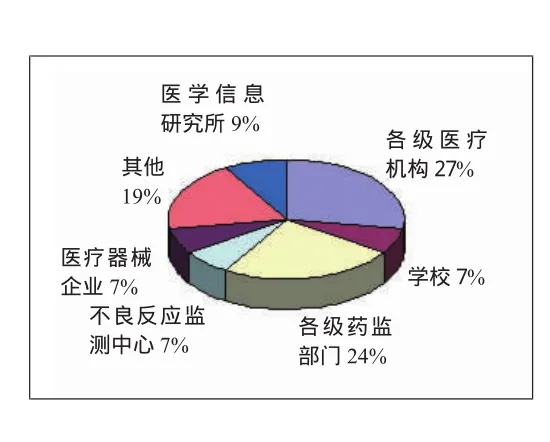
图3 文献的来源机构分布
2.5 文献涉及的研究内容分布
由于各国医疗器械风险管理的发展历程和管理体制等方面存在不同,因此研究的侧重点存在差异。根据我国医疗器械风险管理研究的文献分析,我国目前医疗器械风险管理的研究内容大体分为四大类。研究方向主要是针对医疗器械风险管理中出现的问题,结合我国医疗器械风险管理的实际情况,提出相应的问题和建议;通过对医疗器械风险管理研究的认识、分析方法及其应用方面的内容,探讨如何加强医疗器械风险管理的研究著作;有关医疗器械风险管理的法律法规问题研究以及医疗器械风险管理的适用标准介绍等都是关注的重点(见图4)。
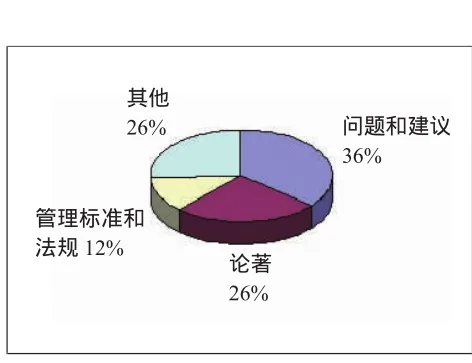
图4 文献的来源机构分布
2.5.1 问题和建议类 《基层医疗器械不良事件监测及风险管理探讨》[8]、《基于风险管理的我国医疗器械不良事件监测政策优化理论分析》[9]、《医疗器械不良事件监测与风险管理》[10]、《试论医疗器械不良事件监测与管理》[11]主要分析了医疗器械产品研发、生产、使用过程中的风险来源,提出了风险控制的措施,并就如何进一步加强医疗器械不良事件监测,提高风险管理能力提出了建议。《现代医院在用医疗器械风险管理的现状与思考》[12]则是一篇通过对医疗器械不良事件的介绍,分析了在用医疗器械风险管理的现状,提出了控制医疗器械风险的措施。
2.5.2 论著类 《加强医疗器械管理降低医疗风险》[13]、《加强高风险医疗器械的管理》[14]、《如何做好医疗器械的管理》[15]探讨了医疗器械与医疗风险的关系,提出了一些在实践中行之有效的加强高风险医疗器械管理的措施和方法。《医疗器械临床应用质量管理》[16]、《风险管理在医疗器械中应用的探讨》[17]、《风险管理及其对医疗器械的应用》[18]阐述了医疗器械在生产过程、应用过程都可能会出现临床风险,国家应该加强医疗器械上市前的准入管理和上市后的监督,医院应该加强器械的临床准入管理以及操作人员和医学工程保障人员的准入管理,并将医疗器械应用纳入医疗质量管理,构建涵盖医疗器械采购、临床使用和医学工程保障等各相关部门的质量管理体系,从而确保医患安全,促进医院综合效益的提高。杨丽君等[19]通过对“珠海体外循环管道事件”进行剖析,阐述我国医疗器械不良事件监测与风险管理的现状,探讨我国实施医疗器械不良事件监测与风险管理的模式和发展方向。《借制度之“眼”监视器械使用——浅议植入人体的高风险医疗器械监管思路》[20]根据高风险医疗器械经营使用的特点,对这些医疗器械监管方法进行了探索,认为关键应建立、完善并执行各种使用制度,以实现对高风险植入器械的跟踪监管。
2.5.3 管理标准和法规类 《学习贯彻YY/T0316-2008/IS014971:2007风险管理标准》[21]、《〈医疗器械风险管理对医疗器械的应用〉第二版标准的主要变化》[22]概述了旧版与新版的医疗器械风险管理标准的基本思想、特点。徐凤玲等[23-24]在分析我国医疗器械风险管理标准和医疗器械监管法规中风险管理要求的基础上,对在医疗器械监督管理中进一步推进实施风险管理进行了讨论。
3 讨论
本文对检索得到的相关文献,在时间分布、期刊分布、来源机构及文献涉及的研究内容等方面进行了对比研究。结果表明,尽管我国的医疗器械风险管理研究工作起步较晚,但研究发展迅速。各级医疗机构、药监部门及相关部门都在积极参与该领域的研究与建设,整体发展趋势较好。然而从统计分析我们不难看出,目前我国医疗器械风险管理研究从整体上还存在一些不足:①从文献研究的内容来看,主要是单一性研究较多,虽然近年来医疗器械风险管理研究文献数量较多,也提出了一些改善的建议和意见,但没有从我国医疗器械风险管理的整体性出发,多数是通过研究国外的风险管理体系提出构建我国药品风险管理体系的指导性建议,并未结合我国医疗器械风险管理现状进行探索研究,对我国医疗器械风险管理制度的研究非常少,特别是综合性、系统性的研究论著还较为少见。此外,文献的作者分布也相对比较分散,系列研究的集中度和参与度欠佳;文献研究主要集中于少数杂志;从机构性质来看,各级医疗机构和药监部门是文献的主要来源,而医疗器械企业的参与度较低,仅有少数文献来源于医药企业。②医疗器械风险管理法律法规不完善,由于医疗器械风险管理概念较新、研究起步晚、缺少系统化,使得现阶段与我国医疗器械风险管理相配套的法律法规不多。在已检索到的文献中与法律相关的研究报道仅有2篇,在医疗器械风险管理体系建设中,法律法规建设是非常重要的一环,它的完善与发展关系到我国医疗器械风险管理标准法律地位的确定以及实现医疗器械风险管理标准有法可依等非常实际的内容。为此,我们应该针对具体问题有步骤有计划地进行立法及法律法规完善工作,使其成为医疗器械风险管理系统的有力支撑。
综上所述,医疗器械作为用于预防、诊断、治疗和康复人体疾患的特殊产品,普遍存在可能造成对人体伤害的风险。这种风险存在于医疗器械设计研发、生产、流通、使用等各个环节,其重要性不言而喻。近几年频发的医疗器械不良事件,提醒我们要想从源头控制医疗器械的质量,就必须有一套行之有效的风险管理体制与方法。因此。我们需要在与国外先进管理经验的对比研究中,取其精华,同时结合我国医疗器械风险管理发展的现状,建设和完善我国的医疗器械风险管理体系,促进医疗器械质量的提高,保障公众安全。
参考文献:
[1]中华人民共和国医药行业标准.医疗器械—风险管理对医疗器械的应用,YY/T0316-2008.
[2]王兰明.医疗器械不良事件监测与风险管理浅议[J].中国药房,2003,14(9):516-519.
[3]欧阳昭连,池慧.国内外在用医疗器械风险管理问题初探[J].中国医疗器械信息,2007,13(4):42-47.
[4]欧阳昭连,池慧,杨国忠.在用医疗器械风险管理问题及对策研究(一)[J].中国医疗器械信息,2007,13(2):43-47.
[5]欧阳昭连,池慧,杨国忠.在用医疗器械风险管理问题及对策研究(二)[J].中国医疗器械信息,2008,14(1):55-57.
[6]欧阳昭连,池慧,杨国忠.在用医疗器械风险管理问题及对策研究(三)[J].中国医疗器械信息,2008,14(2):51-59.
[7]欧阳昭连,池慧,杨国忠.在用医疗器械风险管理问题及对策研究(四)[J].中国医疗器械信息,2008,14(3):59-69.
[8]方涛.基层医疗器械不良事件监测及风险管理探讨[J].中国药物警戒,2009,(5):302-304.
[9]崔佳.基于风险管理的我国医疗器械不良事件监测政策优化理论分析[J].中国药物警戒,2009,(2):96-99.
[10]焦灵利.医疗器械不良事件监测与风险管理[J].中国医疗器械信息,2008,14(12):37-40.
[11]黄少玉.试论医疗器械不良事件监测与管理 [J].安徽医药,2005,9(1):66-67.
[12]李伟.现代医院在用医疗器械风险管理的现状与思考[J].中国医学装备,2009,6(6):26-28.
[13]李雪原,李铁玲.加强医疗器械管理降低医疗风险[J].医疗设备信息,2006,21(9):74-76.
[14]刘贻早.加强高风险医疗器械的管理 [J].中国医学装备,2006,3(3):20-21.
[15]谭丹华.如何做好医疗器械的管理 [J].中国医疗器械信息,2008,14(9):59-60.
[16]曹德森,吴昊.医疗器械临床应用质量管理[J].中华医院管理杂志,2007,23(8):505-509.
[17]徐凤玲.风险管理在医疗器械中应用的探讨[J].中国医疗器械杂志,2006,30(2):123-128.
[18]尉可道.风险管理及其对医疗器械的应用 [J].中国医学装备,2004,1(1):14-17.
[19]杨丽君,邓剑雄.从“珠海体外循环管道事件”看我国医疗器械不事件监测与风险管理 [J].中国药物警戒,2009,(8):453-457.
[20]俞金芳.借制度之“眼”监视器械使用——浅议植入人体的高风险医疗器械监管思路[J].医疗保健器具:医疗器械版,2003,(11):57-58
[21]王兰明.学习贯彻YY/T0316-2008/IS014971:2007风险管理标准[J].中国医疗器械信息,2009,15(2):37-41,46.
[22]武俊华.《医疗器械风险管理对医疗器械的应用》第二版标准的主要变化[J].中国医疗器械信息,2007,13(12):52-56,79.
[23]徐凤玲.浅析ISO13485:2003版《医疗器械质量管理体系用于法规的要求[J].中国医疗器械杂志,2004,28(3):208-209.
[24]王兰明.谈我国医疗器械风险管理的法规要求[J].中国医疗器械杂志,2009,33(1):46-50.
作者简介:邝俊健,男,硕士在读,药师。研究方向:临床药学。E-mail:89570353@qq.com
Bibliometrics Analysis on Medical Device Risk Management in Chinese Journals
Kuang Junjian1,Kuang Hui2,Ma Guanqun3,Peng Huaqiang1,Rong Li1(1 Department of pharmacy,Wuzhou hospital of Traditional Chinese Medicine,Wuzhou 543002,China;2 Guangxi Wuzhou Sanhe pharmacy Co.,LTD;3 Guangxi Wuzhou pharmaceutical(group)Co.,LTD)
ABSTRACTTo find out the research advances in the field of medical device risk management in China.Methods:We searched Chinese journal full-text database(CNKI database)and Chinese science and technology periodical database(VIP information)using medical device and risk management as the keyword.We analyzed and inducted the actual medical device risk management researches in China as well as reported the distributions of related literature in time,periodical,actor and content.Results:The research on medical device risk management is increasing year by year and the core authors have been formed.The literatures are mostly from pharmaceutical supervision bureaus as well as hospitals.And all the literatures can be divided into four kinds in the content.Conclusion:The medical device risk management in China is only beginning to formulate,there are a lot of work about regulations and technical system to be planned and accomplished.
KEY WORDSMedical Device;Risk Management;Adverse Event(ADE);Bibliometrics Analysis
