以品种为单元的药品GMP实施模式分析
2010-04-08李海剑宋丽丽
李海剑,高 洁,宋丽丽
(河南大学药学院,河南 开封 475001)
我国于1998年开始强制推行实施药品生产质量管理规范(GMP),取得了丰硕的成果,但同时也暴露出生产管理粗放、生产质量控制关键岗位监控不到位,制定的文件缺乏针对性、可操作性不强,以及质量管理体系权责不明等诸多问题[1-2],其根源应是当前药品GMP实施模式存在弊端。目前,药品GMP实施模式以药品生产车间和剂型为关注的焦点,而与具体品种脱节,因此造成药品GMP认证合格企业不断出现质量问题,如2006年至2007年间相继发生的“齐二药”、“欣弗”、“广东佰易”等药害事件。为有效解决当前药品GMP实施过程中遇到的问题,将药品GMP融入到具体品种的每个生产环节中,实现药品生产全过程的标准化操作和质量控制,河南省食品药品监督管理局于2007年4月提出了“以品种为单元的药品GMP实施模式(以下简称新模式)”,并在全省范围内按初步实施、深化拓展和全面提高3个阶段逐步推行实施。新模式得到了国家食品药品监督管理局的充分肯定,吴浈副局长指出:积极探索实施以品种为单元的药品GMP,符合科学监管理念的要求,抓住了保证药品生产质量的关键点和突破口。笔者现对河南省两年来新模式的实施状况进行初步分析,旨在探求适合我国国情的药品GMP实施模式,为我国药品GMP的有效实施提供参考。
1 新模式的实质内涵
1.1 新模式是药品GMP精髓的体现
药品GMP的中心思想是“药品的质量是生产出来的,而不是检验出来的”,其中质量应包括具体品种、规格的质量,而生产则包含从原料购进到成品销售的全过程。每种剂型可以有多个品种,每个品种在生产中又存在着许多个体化差异。如果仅关注车间和剂型层面,只能使该剂型品种在生产中的共性部分达到有关要求,而其个性化差异并不一定能够满足要求。新模式将关注的焦点由剂型层面深化到具体品种,建立了针对品种的工艺标准和管理体系,促进其生产过程的标准化,从而可以真正有效地保证药品生产质量。
1.2 新模式是监管理念的创新
新模式的实质是引导企业建立以品种为单元、以岗位为基点,完整真实地的将药品GMP全部条款落实到每个具体品种生产全过程和具体岗位,有效保障药品生产的质量和安全为目的的药品生产质量管理体系[3]。新模式针对具体品种、具体岗位进行靶向监管,实现了由剂型监管向品种监管的转变,实现了由监督企业通过药品GMP认证向监督企业严格按照药品GMP组织生产的转变,这是对监管理念的大胆创新。
2 新模式的实现形式
2.1 企业层面
针对品种进行全过程质量控制:新模式的实施重点是针对具体品种的全程监控。针对具体品种,企业建立物料采购、检验、库存管理、发放使用等管理制度,对其物料的质量参数和供应商进行相对的固定,从源头上控制产品质量;配置并验证生产所需的设备、设施;建立具体工艺中工序质量控制点,对该品种的生产、清场、清洗、消毒、灭菌等各环节进行质量控制;制定、细化相应的物料、中间产品和成品的内控质量标准,保证该品种在生产、贮存、销售和使用过程中的质量。
针对品种建立工艺标准:以具体品种的注册工艺为轴线,对工艺规程中各工序的关键控制点、操作要求及技术参数进行细化;通过小试、中试的方式,筛选、优化工艺参数,通过大生产进行验证并固化工艺参数的可控范围,实现工艺标准化和工艺参数刚性化,以提高药品质量的可控性和重现性,使其达到均一、稳定。
针对品种优化文件系统:对原有文件系统进行修订、细化和完善,使其对具体品种的生产和质量管理具有指导意义;将操作性不强、缺乏针对性的文件予以废除,制订具有针对性的工艺规程、岗位操作法、记录等;通过试用、反馈和完善,对修订后的文件予以确定,形成符合具体品种个性化要求的药品GMP文件系统。
目的 探求适合我国国情的药品生产质量管理规范(GMP)实施模式,为引导我国药品GMP的有效实施提供参考。方法 采用内容分析方法,对以品种为单元的药品GMP实施模式的内涵和实现形式进行分析,并以问卷调查、实地调研的方法,初步总结分析该模式在河南省的实施状况。结果与结论 以品种为单元的药品GMP实施模式,是实施药品GMP的深入、细化和完善,是完整真实地将药品GMP条款落实到具体品种和岗位、实现药品生产过程标准化的有效途径。
2.2 监管层面
以品种和岗位为监管的关注点:药监部门对企业监督检查的关注点,应由剂型、车间深入到品种、岗位。针对具体品种制订日常监督检查方案,编制“品种监督检查项目表”;在检查中重点对照具体品种的岗位操作规程与验证情况,对照药品GMP文件对品种的覆盖程度;对照操作人员理解本岗位操作规程的程度与实际操作行为等。
以工艺处方核定为监管的切入点:药监部门应针对具体品种,核查注册申报的处方、工艺规程与实际生产的一致性;核查具体品种工艺的优化情况,考察是否能够达到工艺质量控制参数的稳定、固化、可控;核查由于物料变更、设备更新、工艺细化所引起具体品种处方和工艺变化时,是否按照规定进行验证并依法提交注册补充申请、履行审批程序等。
3 对河南省新模式实施状况的初步分析
选择河南天方药业股份有限公司和河南羚锐药业股份有限公司、天津药业焦作分公司和平顶山华利药业公司、洛阳新春都生物制药有限公司5家药品生产企业分别作为大型企业、中型企业和小型企业的代表性样本企业(以下简称样本企业),采用实地调研方法,对其新模式实施状况进行初步调查分析。调查发现,样本企业对新模式的实施持积极态度,总体实施状况较好。
新模式覆盖品种情况:由于企业规模及实际生产状况不尽相同,样本企业新模式实施品种情况也略有不同。其中天津药业焦作分公司对所有注册品种统一进行小试、中试,筛选优化工艺参数,明确具体岗位职责,建立相应的文件体系,由大生产逐一品种进行验证,而其他样本企业则结合实际生产情况对在制品种进行细化。样本企业平均注册品种数143个,平均实施新模式品种数70个,平均覆盖率为48.95%,具体情况见表1。
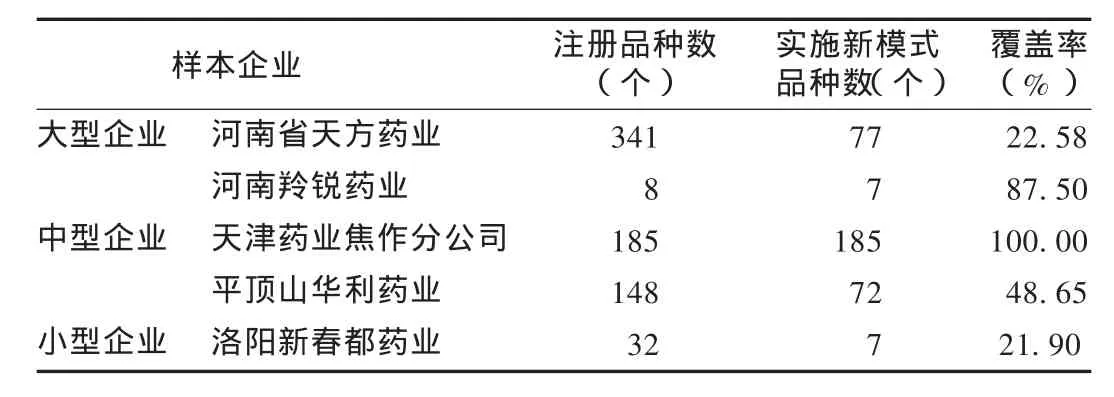
表1 样本企业新模式覆盖品种情况统计
细化完善文件系统情况:依据不同的企业规模,对3家代表性样本企业文件细化完善情况进行分析。3家企业原有文件平均2 202个,平均修订、细化文件1 282个,修订细化率58.22%;平均废除操作性不强、缺乏针对性的文件222个,废除率10.08%;平均文件变更率达68.30%。样本企业文件系统变化情况见表2。
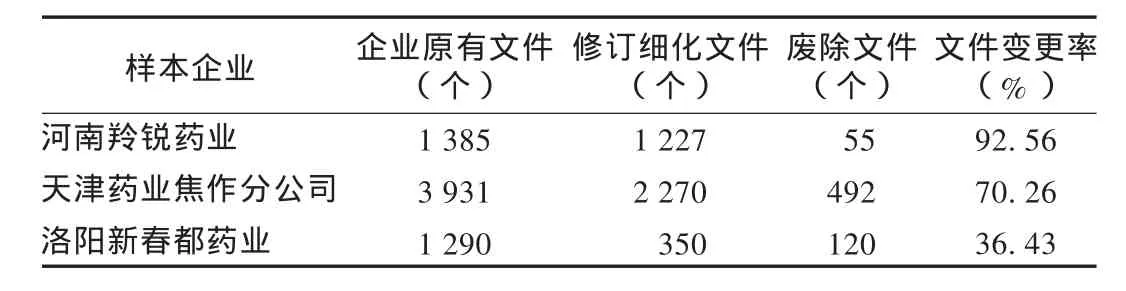
表2 部分样本企业文件系统变化情况
工艺标准建立情况:为了解企业产品工艺标准建立情况,分别抽取样本企业片剂、胶囊剂和小容量注射剂3类常见剂型各3个品种,对其主要工序工艺参数的变化情况进行对比分析。结果表明,上述品种工艺参数均进行了不同程度的细化和固化,工艺参数细化率平均为28.6%(见表3)。如天津药业焦作分公司某小容量注射剂品种的灌封工序,工艺参数由原来的13个细化为21个,增加了灌封用具的清洗最终淋洗水pH值、电导率、可见异物,灌封用具灭菌温度、时间,灌封初、中、终半成品微生物限度检测等8项规定参数,从根本上保证了产品的质量稳定性和可控性;如配液工艺,工艺参数由8个细化为10个,增加了静置时间及药液高度;又如灭菌工艺,工艺参数由11个细化为13个,增加了F0值、冷点无菌取样。
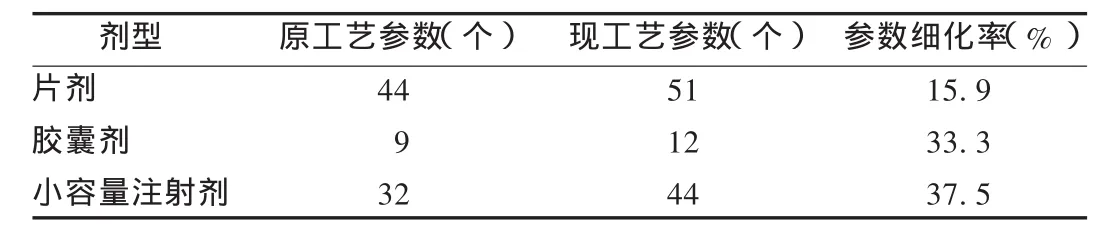
表3 样本企业新模式实施前后产品工艺参数变化情况(n=3)
产品质量变化情况:企业通过推行、实施新模式,针对具体品种细化工艺、固定参数、建立工艺标准,将药品GMP的精神实质落实到具体品种生产的各个环节、各个岗位,有效地保证了药品质量。对样本企业片剂、胶囊剂和小容量注射剂共9个品种的质量变化情况进行了统计,结果发现,上述品种质量指标明显提高且趋于稳定。如天津药业焦作分公司某小容量注射剂品种,新模式实施前后连续10批次产品含量测定值范围分别为96.5%~98.7%和98.5%~99%,其含量变化情况见图1。

图1 实施新模式前后某小容量注射剂品种连续10批的含量变化情况
利润变化情况:为了解新模式实施对企业成本和利润的影响情况,对2006年至2008年间样本企业利润变化情况进行了对比,结果样本企业实施新模式后利润增长率均有所提高,说明新模式的实施可以降低成本、提高效益。样本企业利润变化情况见图2。

图2 实施新模式前后样本企业利润增长率变化情况
文通讯作者,(电子信箱)sl@henu.edu.cn。
[1]胡谦谦,梁 毅,黄湘萌.无菌药品参数放行的优势及实施方法[J].中国药业,2008,17(8):17-18.
[2]王闻珠.执行新修订的《药品GMP认证检查评定标准》应重视的几个问题[J].中国药事,2008,22(8):649-651.
[3]SFDA.吴浈在河南湖北督查药品专项整治工作时要求查漏补缺打好攻坚战[EB/OL].[2007-10-30].http://www.sda.gov.cn/WS01/CL0398/ 26048.html.
