对二甲苯氧化用钴锰溴铪催化体系研制
2010-04-05成有为
张 军,成有为,李 希
(1.中国石化仪征化纤股份有限公司技术中心,江苏 仪征 211900;2.浙江大学化工系,浙江 杭州 310027)
研究论文
对二甲苯氧化用钴锰溴铪催化体系研制
张 军1,成有为2,李 希2
(1.中国石化仪征化纤股份有限公司技术中心,江苏 仪征 211900;2.浙江大学化工系,浙江 杭州 310027)
以氧氯化铪为原料,实验制备了PX氧化反应用醋酸铪、溴化铪催化剂;并在PX氧化性能实验装置中评价了催化剂性能,比较了醋酸铪、溴化铪所形成钴锰溴铪催化剂的性能及铪浓度对催化性能的影响;实验表明醋酸铪与溴化铪的性能相当,铪浓度增加,反应速度加快,铪对PX氧化反应各步的催化幅度不同,在工业生产条件下,加入60 μg/g铪,PX消失速度增加了36%,关键组分PT酸速度增加了7%。
钴锰溴铪;催化剂;PX氧化
PTA(精对苯二甲酸)是聚酯工业的主要原料,工业上采用对二甲苯(PX)为原料,在醋酸溶液中空气液相氧化法生产。自MC(Mid-century)公司开发了PX氧化用钴锰溴三元复合催化体系以来,工业生产中一直沿用至今[1]。然而该体系存在以下两方面的不足:a)在高钴锰催化剂浓度下,反应速度不随着催化剂浓度的增加而增加;b)溴催化剂浓度的增加会造成设备腐蚀加重,氧化尾气中溴甲烷浓度增加,污染大气环境。为了满足国内日益增长的PTA需求,国内PTA装置都进行了增容工作,催化剂浓度处于高位运行,在目前工艺条件下反应器的能力已达到极限。如何进一步增容及缓和氧化反应条件就成为了PTA企业所面临的挑战之一。
PX氧化催化剂的研究一直是研究的重点,目前对钴锰溴催化体系的催化机理已有较广泛的研究[2~4],在现有钴锰溴催化体系中引入第4种组分,提高主反应的活性,抑制副反应,已成为近期的一个研究热点。专利文献报道在钴锰溴催化体系中加入过渡金属元素Mo、Zr、Hf、Ce等[5~8],三星化学公司的Jhung在钴锰溴体系中引入碱金属及碱土金属元素[9~10],而国内尚无此方面的研究报道,也没有文献研究比较这些金属盐的最佳加入形式及对PX氧化反应各步之间的影响。笔者以工业生产装置为背景,制备醋酸铪、溴化铪助催化剂,研究新型的钴锰溴铪催化剂体系催化性能。
1 实 验
1.1 原 料
氧氯化铪,纯度大于99.99%,北京有色金属研究总院生产;
氨水、醋酸,试剂级;
醋酸钴、醋酸锰、氢溴酸,工业级,仪征化纤大康公司生产;
对二甲苯、醋酸,工业级。
1.2 钴锰溴铪催化剂的制备
1.2.1 铪催化组分制备
a)将氧氯化铪溶于水得到澄清水溶液;
b)加氨水于氧氯化铪溶液使生成Hf(OH)4沉淀;
c)将Hf(OH)4用去离子水洗涤多次;
d)将Hf(OH)4溶于醋酸或氢溴酸水溶液,挥发除去溶剂得四水醋酸铪或溴化铪,四水醋酸铪或溴化铪再配成醋酸溶液,标定后待用。
1.2.2 钴锰溴铪催化剂制备
实验前将醋酸钴、醋酸锰、铪催化组分醋酸溶液及氢溴酸按照元素配比比例配成醋酸溶液待用。
1.3 催化剂性能评价
催化剂性能评价实验在笔者设计建立的PX氧化反应动力学实验装置[12]上进行。表1是催化剂性能评价实验条件,评价实验采用与工业装置相同的反应温度(191℃)、压力(14 kg/cm2),钴350 μg/g、锰326 μg/g、溴474 μg/g,PX与醋酸的质量比为10∶1,空气连续加入,其它物料一次性加入。考虑到间歇反应过程中生成水的累积,反应初始含水量为0。样品中的轻组分(醋酸、PX、对甲基苯甲醛、对甲基苯甲酸)采用毛细管气相色谱分析,高效液相色谱分析高沸点组分(对羧基苯甲醛和对苯二甲酸),分析方法与文献[12]相同。

表1 催化剂性能评价实验条件
假设铪催化剂引入后,并没有改变PX氧化反应的主要反应途径,从氧化反应的中间过程取样分析中也未发现其它组分,进一步说明新催化体系下的PX反应网络与钴锰溴催化氧化相同,因此采用文献报道的图1简化的反应网络来表示[13~14],在不同的实验条件下,实验比较了对二甲苯(PX)、对甲基苯甲醛(TALD)、对甲基苯甲酸(PT)及对羧基苯甲醛(4-CBA)等组分浓度随时间的变化,并用文献[12]反应组分抑制动力学模型回归得到各步反应速率常数。

图1 简化的PX氧化反应网络
2 结果与讨论
2.1 醋酸铪与溴化铪的性能比较
图2~图5是在表1的反应条件下,加入30 μg/g的醋酸铪和溴化铪后,PX和主要反应中间组分的浓度随时间的变化图。图2及图3分别是采用两种形式的催化剂,PX及中间组分对甲基苯甲醛(TALD)浓度随时间的变化,从图中可以看出,溴化铪状态下,PX浓度的减少速度要稍大于醋酸铪,而TALD的浓度上升及下降速度相当。从图4PT酸浓度变化看,醋酸铪状态下,PT酸浓度的上升和下降速度要稍快于溴化铪。图5中4-CBA浓度随时间变化图也未发现明显的差异,反应中后期4-CBA浓度的差异是由于固体TA中的4-CBA未能完全溶解及取样时固体TA会结壁所致。从上述分析可以看出,在小试实验范围内,醋酸铪与溴化铪未发现明显的活性差异。考虑到醋酸铪不会引入溴离子,实际使用中醋酸铪的使用更方便且制备时不需要采用高腐蚀性氢溴酸,因此下述实验中采用醋酸铪。
2.2 铪浓度对催化活性的影响
实验考察了铪催化剂浓度对反应速度的影响。比较了加入30 μg/g、60 μg/g醋酸铪催化剂与不加铪催化剂的反应速度对比,如图6~图9所示。
从图6可以看出,加入铪催化剂后,PX浓度随时间减少的速度加快,说明PX的反应速度得到了加快,且铪催化剂增加,反应速度增加的幅度加大,此外,从图7~9 TALD、PT、4-CBA的浓度随时间变化图也可以看出,在反应前半期,加入铪催化剂后,中间组分浓度上升速度快,图形前移,反应速度加快,且60 μg/g要比30 μg/g铪催化剂浓度的更快;同样在反应的后半期,加铪催化剂后,中间组分浓度下降速度更快,且随催化剂浓度的增加而增加。

图2 PX浓度随时间变化

图3 TALD浓度随时间变化
上述实验数据采用图1反应网络,并采用文献[12]反应组分抑制动力学模型,Matlab编程拟合得到各步反应速率常数列于表2中。从拟合得到的速率常数和计算得到的速率常数增加幅度(表3)看,加入铪催化剂后各步反应速率常数均增加,其中PX的反应速率常数增加的幅度最大,加入60 μg/g的铪,PX的反应速率常数增加了36%,其它各步的反应速率常数的增加也均超过5%,关键组分PT酸的反应速率常数增加了7%。

图4 PT浓度随时间变化

图5 4-CBA浓度随时间变化

图6 不同铪催化剂浓度下PX浓度随时间变化
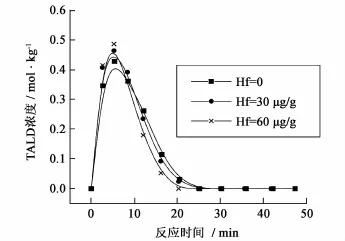
图7 不同铪催化剂浓度下TALD浓度随时间变化

图8 不同铪催化剂浓度下PT浓度随时间变化

图9 不同铪催化剂浓度下4-CBA浓度随时间变化

表2 拟合得到各步反应速率常数

表3 加入铪催化剂后反应速率常数增加的幅度
3 结 论
a)在钴锰溴催化体系中加入铪,能增加PX的氧化反应速度,醋酸铪与溴化铪的催化性能相近,从综合比较看,醋酸铪稍好于溴化铪。
b)在实验范围内,PX氧化反应速度的增加幅度随铪催化剂加入量的增加而增加。
c)铪催化剂对PX氧化各步反应速度增加的幅度不同,其中原料PX消失速度增加幅度最大,加入60 μg/g铪,反应速率常数增加了36%,其它各步的反应速率常数的增加均超过5%,关键组分PT酸的反应速率常数增加了7%。
1 施祖培.对苯二甲酸生产技术现状及展望[J].合成纤维工业,1994,5(17):29~34
2 Partenheimer W.A Chemical Model for the Amoco“MC”Oxygenation Process to Produce Terephthalic Acid[J].Chem Ind(Deckker),1990,40(Catal Org React):321~346
3 Roger A.Metal-Catalyzed Oxidations of Organic Compounds,Acdemic Press,New York,1981
4 Chavan S A,Hallligudi S B,Srinivas D,et al.Formation and Role of Cobalt and Manganese Cluster Complexes in the Oxidation of p-Xylene[J].J Molecular Catalysis A:Chemical,2000,161:49~64
5 Partenheimer W(to Amoco).Production of Polycarboxylic Acids with a Molybdenum-Activated Cobalt Catalyst[P].US:4992580,1991-02-12
6 Broeker,et al(to Amoco).Process for the manufacture of aromatic dicarboxylic acids utilizing cerium to facilitate a low bromine to metals catalyst ratio[P].US:5453538,1995-09-26
7 Belmonte,F G,etal(to Amoco),Production of Polycarboxylic Acids with Hafnium-Activated Cobalt Catalyst[P].US:5110984,1992-05-05
8 June R L,Potter M W,Simpson E J,et al.Method of Producing Aromatic Dicarboxylic Acids Using Cobalt and Zirconium Catalysts[P].US:6153790,2000
9 Jhung S H,Lee K H,Park Y S.Appl Catal A:General,2002,174:31~40
10 Yoo J S,Jhung S H,Lee K H.Appl Catal.A:General,2002,223:239~251
11李希,徐锦龙,张军.高温高压在线取样装置[P].中国专利:012446807,2002-03
12张军,程明权.PX氧化反应动力学模型研究[J].合成技术及应用,2003,2(18):5~8
13 Cao G.,et al.,A Lumped Kinetic Model for Liquid-Phase Catalytic Oxidation of p-Xylene to Terephthalic Acid[J].Chem Eng Sci,49:5775~5783
14周国华.对二甲苯液相催化氧化动力学的研究[A].研究生毕业论文[C].天津:天津大学,1988.1
Preparation and research of cobalt-manganese-bromine-hafnium catalyst system for oxidation of PX
Zhang Jun1,Cheng Youwei2,Li Xi2
(1.Yizheng Chemical Fibre Co.,Ltd.,SINOPEC,Yizheng Jiangsu 211900,China;2.Qepartment of Chemical and Biological Engineering,Zhejiang University,Hangzhou Zhejiang 310027,China)
Hafnium acetate and hafnium bromide have been prepared from hafnium oxychloride in the laboratory.A semicontinuous experimental unit and a method have been used for the evaluation of catalyst for the oxidation of PX at a high temperature and pressure.The catalyst activity of Cobalt-Manganese-Bromine-Hafnium Catalyst System made from Hafnium acetate and hafnium bromide and the effect of hafnium concentration have been studied.It is found that Hafnium acetate and hafnium bromide have similar activity and the activity increases with the concentration of hafnium.The hafnium has a varied activity on the different steps of PX oxidation with a 36%increase for the rate of PX consumption and a 7%increase for the rate of PT reaction at 60 μg/g hafnium addition.
cobalt-manganese-bromine-hafnium;catalyst;PX oxidation
TQ314.242
:A
:1006-334X(2010)04-0001-04
2010-08-26
张军(1967-),江苏江都人,高级工程师,主要从事化工及高分子聚合研究工作。
