IFN-γ上调MHC-Ⅱ分子表达对KC免疫原性的影响
2010-03-27宋仁刚宋任强柳大烈
宋仁刚 宋任强 柳大烈
IFN-γ上调MHC-Ⅱ分子表达对KC免疫原性的影响
宋仁刚 宋任强 柳大烈
目的观察在炎症因子IFN-γ的作用下,角质形成细胞(Keratinocyte,KC)免疫原性的变化情况。方法KC体外传代培养,按不同的INF-γ浓度分组后作用于传代的KC。将高表达MHC-Ⅱ分子的KC与异体淋巴细胞混合培养后,观察淋巴细胞的增殖情况;同时,将KC植入异体小鼠皮下,观察免疫排斥迹象。结果在6 000 U/mL IFN-γ的作用下,MHC-Ⅱ+的KC超过90%。高表达MHC-Ⅱ分子的传代KC无明显刺激异体淋巴细胞增殖的作用,植入异体小鼠皮下后也无明显淋巴细胞浸润现象。结论传代后的KC在IFN-γ作用下高表达MHC-Ⅱ分子,表达MHC-Ⅱ分子的KC无明显免疫原性。
干扰素-γ主要组织相容性复合体-Ⅱ角质形成细胞免疫原性
组织工程化皮肤是目前治疗难治性溃疡、大面积烧伤等皮肤缺损性疾病最具前景的方法之一。但是,以异体皮肤细胞为种子细胞构建的组织工程化皮肤,移植后是否引起免疫排斥反应,却一直存在争议[1-3]。目前主要使用角质形成细胞(Keratinocyte,KC)、成纤维细胞等作为种子细胞来构建组织工程化皮肤。正常情况下KC表面仅表达MHC-Ⅰ类抗原,不表达MHC-Ⅱ类抗原及共刺激分子,本身不具备抗原递呈能力。但有实验显示,在炎症因子(如IFN-γ)的作用下,KC能诱导MHC-Ⅱ的表达。MHC-Ⅱ是专职抗原递呈细胞(Antigen presenting cell,APC)呈递抗原的重要结构之一[4]。因此,KC能否成为APC,从而激活T细胞需要实验证明。本实验模拟体内炎症状态下,用IFN-γ作用KC,观察MHC-Ⅱ分子表达情况,随即将表达MHC-Ⅱ分子的KC与异体淋巴细胞混合培养,观察淋巴细胞的增殖程度,并将表达MHC-Ⅱ分子的KC植入异体小鼠皮下组织,观察是否发生免疫排斥现象。
1 材料与方法
1.1 实验动物及分组
雄性6~8周龄BALB/c小鼠30只,体重20~25 g,随机平均分为3组。取皮组:小鼠背部常规消毒后,手术刀取约1 cm×1 cm的全层皮肤组织,培养表皮细胞;实验组:将培养的含有1×105个KC的培养基0.5 mL注入小鼠腹部皮下组织;对照组:将单纯培养基0.5 mL注入小鼠腹部皮下组织。
1.2 细胞培养
小鼠KC:小鼠皮肤标本加入0.25%Dispase(Sigma公司)浸没,消化16~18 h,眼科镊揭下表皮,加0.25%胰蛋白酶消化30 min,用吸管小心反复吹打,200目筛网过滤,离心后用含10%胎牛血清的DMEM培养基(Gibco公司)重悬,按1×106cells/mL密度接种于培养瓶中,置于37℃、5%CO2培养箱中。当细胞约80%融合后,加0.125%胰蛋白酶和0.01%EDTA混合消化液消化后传代,细胞培养至第2代用于实验。
小鼠脾淋巴细胞:对照组小鼠处死后取脾脏,反复剪碎后,200目筛网过滤,小鼠淋巴细胞分离液分离(天津TBD公司),培养2 h后取悬浮细胞即淋巴细胞RPMI 1640培养基(Gibco公司)继续培养。
1.3 IFN-γ诱导MHC-Ⅱ分子的表达
配制含1×106U/mL IFN-γ(Sigma公司)的DMED培养基。以1×106cells/mL浓度接种第2代对数生长期KC于24孔板中,培养6 h后给药,各孔药物终浓度分别为1 000 U/mL、2 000 U/mL、4 000 U/mL、6 000 U/mL、8 000 U/mL、10 000 U/mL,设不含IFN-γ的培养基为阴性对照,继续培养48 h。部分细胞采用爬片法培养,拟行细胞免疫组化染色,方法如下:4%多聚甲醛/PBS固定,0.1%Triton X-100处理5 min,3%H2O25 min,正常山羊血清室温封闭10 min,加大鼠抗小鼠MHC-Ⅱ(I-A/I-E)单抗(天津三箭公司)4℃过夜,生物素标记山羊抗大鼠二抗(二抗试剂盒购自北京中杉公司)37℃孵育10 min,辣根过氧化物酶标记的链霉卵白素工作液37℃孵育10 min,DAB显色5 min,冲洗后封片,显微镜下观察。
1.4 流式细胞仪检测MHC-Ⅱ分子的表达
第2代KC经IFN-γ处理后,100 μL PBS重悬1×105个细胞,加FITC-抗小鼠MHC-Ⅱ(I-A/I-E)抗体,同型对照管中加入FITC-大鼠IgG2b(eBioscience公司),4℃放置30 min,PBS 2 000 r/min洗涤,重悬于0.4 mL PBS中,流式细胞仪(Beckman公司)分析。
1.5 混合淋巴细胞反应
分别将原代和第2代KC以1×102个、1×103个、1×104个细胞加入96孔板中,经8 000U/mL IFNγ培养48 h后,加入含25 μg/mL丝裂霉素C的DMEM培养基,继续培养细胞45 min,吸出培养基后各孔分别加入1×105个淋巴细胞,继续培养3 d。其余步骤按BrdU-ELISA试剂盒(Roch)说明书进行,即:各孔加10 μL BrdU孵育2 h;离心后加入200 μL固定液,室温下30 min;甩干固定液后加100 μL anti-BrdU-POD工作液,室温孵育90 min;反复冲洗3遍后加100 μL底物液,室温下10 min;分光光度计在370 nm波长处测量吸光度。设5 μg/ mL PHA处理的第2代KC为阳性对照,不经IFNγ处理的第2代KC为阴性对照,RPMI 1640培养基为空白对照。
1.6 小鼠体内观察淋巴细胞浸润
腹部皮下植入KC 2周后,处死实验组、对照组小鼠。取小鼠注入细胞处皮肤全层组织,中性福尔马林固定,行HE染色:石蜡切片常规脱蜡,苏木素染色,盐酸乙醇分色,淡氨水蓝化,伊红染色,系列乙醇脱水,入二甲苯,中性树胶封片;免疫组化:石蜡切片脱蜡,其余步骤同前述。
1.7 统计学处理
实验结果采用SPSS 11.0软件进行分析,各组数据均以均数±标准差(x±s)表示,各组间两两比较采用单因素方差分析,P<0.05为差异有显著性。
2 结果
2.1 培养细胞的生长情况
刚分离的小鼠KC呈圆形,活力较好,活细胞数均超过80%。2 h后细胞开始贴壁生长。细胞逐渐连接成片,似铺路石样生长。一个小鼠脾脏能分离约1×107个淋巴细胞。分离的小鼠脾脏淋巴细胞镜下观察为圆形,呈悬浮生长。细胞活力好,活细胞数均超过90%。
2.2 流式细胞仪分析
随着INF-γ浓度的增高,KC的MHC-Ⅱ表达逐渐增高(图1)。IFN-γ为1 000 U/mL时MHC-Ⅱ表达即明显增高;IFN-γ为6 000~10 000 U/mL时,MHC-Ⅱ达到峰值(IFN-γ在6 000 U/mL、8 000 U/mL和10 000 U/mL时无显著差异,P>0.05)(图2)。

图1 小鼠KC MHC-Ⅱ在IFN-γ处理后的表达

图2 MHC-Ⅱ的表达趋势
2.3 淋巴细胞增殖实验
在不同KC刺激下,增殖的淋巴细胞吸光度不同。原代KC刺激淋巴细胞增殖非常显著(与阴性对照组比较,P<0.05;与阳性对照组比较,P>0.05),且淋巴细胞增殖程度随刺激细胞数量增多而增高。第2代KC无明显刺激淋巴细胞增殖效应(与阴性对照组比较,P>0.05;与阳性对照组比较,P<0.05)(图3)。

图3 异体淋巴细胞增殖吸光度
2.4 组织学及免疫组化检测
免疫组化染色显示第2代KC的MHC-Ⅱ分子表达于细胞膜(图4)。经不同浓度的IFN-γ处理后KC均明显表达MHC-Ⅱ分子,且随IFN-γ浓度增高,MHC-Ⅱ分子表达加强。

图4 KC在IFN-γ的作用下表达MHC-Ⅱ分子(IH,400×)
植入小鼠KC 2周后,HE染色清晰可见小鼠皮下隆起的KC团块(图5),与周围组织区别明显。原代KC团周围及其细胞间可见较多单个核细胞浸润,第2代KC团未见单个核细胞浸润;原代KC团浸润的细胞免疫组化染色显示CD3、CD4阳性,CD8未见阳性染色(图6);第2代KC免疫组化染色未见CD3、CD4和CD8阳性细胞。
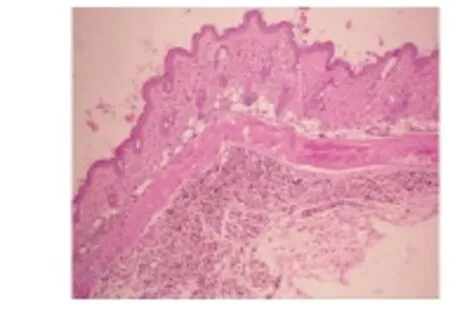
图5 植入小鼠皮下的异体KC(HE,100×)
图6 植入小鼠皮下的异体KC中含有浸润的CD3+细胞(IH,100×)
3 讨论
大面积烧伤、慢性皮肤溃疡等皮肤缺损性疾病一直是临床治疗的难题。组织工程基本原理是将体外培养的细胞与生物材料结合,移植到病损部位,种植的细胞增殖分化形成具有功能的活性组织。商品化的组织工程皮肤产品均采用异体细胞进行构建,但异体细胞经体外培养,与细胞外基质共同构建组织工程皮肤后,是否引起免疫排斥,一直存在争议。
KC是皮肤的重要的结构和功能细胞,正常情况下其表面仅表达MHC-Ⅰ类抗原,不表达MHC-Ⅱ类抗原及共刺激分子,本身不具备抗原递呈能力。但在体外培养条件下,KC经纯化结核菌素刺激后,能表达MHC-Ⅱ分子。某些异常情况下,如银屑病皮损、尖锐湿疣皮损中,KC高表达MHC-Ⅱ分子,并且与疾病活动密切相关[5]。另外,IFN-γ也能诱导KC表达MHC-Ⅱ分子。IFN-γ主要由活化T细胞产生,在抗原、PHA或ConA刺激下,T细胞分泌IFN-γ,通常与IL-2的产生相一致。IFN-γ能诱导单核细胞、树突状细胞、血管内皮细胞等表达MHCⅡ类抗原,使其参与抗原递呈和特异性免疫的识别过程。实验中加入IFN-γ后,KC均表达MHC-Ⅱ分子,表达的MHC-Ⅱ分子位于细胞膜。随着IFN-γ的浓度增高,MHC-Ⅱ分子的表达量也逐渐增高。当IFN-γ为6 000 U/mL时,MHC-Ⅱ分子的表达量达到峰值,超过90%的细胞表达MHC-Ⅱ分子。
MHC-Ⅱ分子抗原,是抗原递呈细胞和单核细胞表面糖基化的跨膜蛋白,表达MHC-Ⅱ分子对于向CD4 T细胞递呈肽段,启动特异性免疫反应非常必要。因此,有观点认为MHC-Ⅱ(+)的KC有可能成为非专职的APC,直接激活T细胞或可摄取和降解抗原向T细胞呈递抗原[6]。我们将不同比例的KC与小鼠脾脏淋巴细胞混合培养后发现:原代KC和PHA能明显刺激淋巴细胞増殖。经过IFN-γ处理后,第2代KC在不同比例下均未能有效刺激淋巴细胞増殖。原代KC能刺激淋巴细胞增殖,可能与其中混杂的细胞有关。表皮中除KC外,还有朗格汉斯细胞(Langerhans cells,LC)、黑色素细胞等多种细胞。LC是表皮中专职APC,表达MHC-Ⅱ抗原及共刺激分子。有实验证明皮肤中刺激异源性T细胞反应并启动移植物排斥反应的是LC。同种异体皮肤移植物是否被排斥与移植物内的LC密度相关,密度越高,越易被排斥,清除供体皮肤的LC将延长同种异体移植物的存活时间[7]。KC经传代后去除混杂细胞尤其是LC,是降低其免疫原性的主要原因。经IFN-γ处理的第2代KC高表达MHC-Ⅱ,但未能明显刺激淋巴细胞增殖,提示表达MHC-Ⅱ并不是KC刺激淋巴细胞增殖的前提条件。同样,有研究者认为在某些特殊的炎症条件下,KC高表达MHC-Ⅱ分子可能是炎症后的继发反应,而不是KC作为APC向T细胞递呈抗原的标志[8]。KC表达MHC-Ⅱ可能更利于其在炎症情况下易于分泌前炎症细胞因子,从而参与炎症反应[9]。
T细胞活化必须有双信号介导:第一信号是指T细胞表面受体与APC上MHC-抗原肽间的相互识别;第二信号是来自APC上的共刺激分子,其中CD80、CD86是目前研究最多的两个共刺激分子[10]。我们的实验中,流式细胞仪未检测到第2代KC表达CD80、CD86,虽然有实验显示小鼠表皮干细胞表达CD80[1],但KC在分化过程中是否表达共刺激分子,目前仍无定论。有研究表明,KC能向幼稚CD4 T细胞递呈抗原,但因缺乏共刺激分子,递呈的抗原可能导致T细胞的失活而不是激活。通过转基因技术可以使小鼠KC表达CD80,同时给予IFN-γ,KC表达MHC-Ⅱ分子。表达CD80和MHC-Ⅱ的KC虽然能刺激异体T细胞增殖反应,但反应明显弱于专职APC(如单核细胞、树突状细胞)引起的刺激反应,提示非专职APC即使表达共刺激因子还不足以触发免疫反应,仅能扩大宿主的免疫反应[11]。
异体皮肤细胞移植后的转归目前还存在争论。有学者认为,异体表皮细胞移植后,最终将被宿主的免疫系统逐渐排斥,取而代之的是自体细胞。另有学者认为,移植的异体细胞能够长期存活。在实验中我们将原代KC、经过IFN-γ处理和不经过IFN-γ处理的第2代KC植入异体小鼠皮下。不同时间活检发现:随着时间延长,原代KC周围单个核细胞逐渐增多,免疫组化染色显示浸润的细胞CD3阳性,提示浸润的细胞主要以T淋巴细胞为主。相反,无论是否经过IFN-γ处理,第2代KC周围均未见明显的单个核细胞浸润,免疫组化染色未见CD3染色阳性细胞。上述结果提示:原代KC引起淋巴细胞浸润的原因可能与混杂的免疫原性较强细胞有关;KC仅表达MHC-Ⅱ分子还不足以趋化淋巴细胞浸润。深入研究组织工程化皮肤Apligraf移植后的临床表现,发现Apligraf不含LC、真皮树突状细胞、内皮细胞或淋巴细胞等抗原递呈细胞,临床试验显示移植Apligraf类似于移植自体皮肤,可以很好地愈合伤口并且迅速在其内部生成血管,其形态、生化及代谢特征与人体皮肤相仿,几乎无免疫原性,也未发生免疫排斥反应[12]。Phillips等[13]在研究Apligraf治疗下肢静脉溃疡的安全性和免疫学影响时也证实了上述观点,研究中没有发现明显的免疫排斥征象,也未检测出对KC异体抗原产生应答。Guerret等[14]将Apligraf移植于裸鼠,1年后用免疫组化的方法发现了存活的异体KC,上述证据进一步支持移植异体KC不存在排斥反应或排斥反应较弱。
综上所述,异体KC经体外传代培养后,去除了免疫原性较强的细胞。KC本身免疫原性较弱,不表达共刺激分子,虽然在炎症因子IFN-γ的作用下能表达MHC-Ⅱ分子,但仍无刺激异体淋巴细胞增殖的能力。体内实验也进一步证实,传代后的KC免疫原性较低,不是趋化淋巴细胞浸润的主要原因。本实验初步证明了传代后的KC免疫原性较低,为组织工程化皮肤的临床应用提供了实验支持。但体内免疫反应非常复杂,多种因素参与其中,包括各种细胞间的相互作用、细胞与基质间的作用以及多种炎症因子和细胞因子的作用,都不同程度地影响着免疫应答反应的发生、发展和结局。移植的异体细胞最终转归如何,仍需更长期的实验观察。
[1]Lei J,Cheng J,Li Y,et al.CD80,but not CD86,express on cultured murine keratinocyte stem cells[J].Transplant Proc,2005,37(1): 289-291.
[2]Villarroel DM,Whawell SA,Speight PM,et al.Transfection of CD40 in a human oral squamous cell carcinoma keratinocyte line upregulates immune potency and costimulatory molecules[J].Br J Dermatol,2006,154(2):231-238.
[3]Byrna B,Madrigal EL,Mcevoy A,el al.Human duodenal epithelial cells constitutively express molecular components of antigen presentation but not costimulatory molecules[J].Hum Immunol, 2002,63(11):977-986.
[4]Sara EP,Sobhy MM,Richard W,et al.HLA-DR regulation and the influence of GM-CSF on transcription,surface expression and shedding[J].Int J Med Sci,2004,1(3):126-136.
[5]Schonefuss A,Wendt W,Schattling B,et al.Upregulation of cathepsin S in psoriatic keratinocytes[J].Exp Dermatol,2010,19(8):e80-88.
[6]Danielyan L,Tolstonog G,Traub P,et al.Colocalization of glial fibrillary acidic protein,metallothionein,and MHC II in human, rat,NOD/SCID,and nude mouse skin keratinocytes and fibrob lasts[J].J Invest Dermatol,2007,127(3):555-563.
[7]Banchereall J,Steinman RM.Dendritic cells and the control of immunity[J].Nature,1998,392(6673):245-252.
[8]Kim BS,Miyagawa F,Cho YH,et al.Keratinocytes function as accessory cells for presentation of endogenous antigen expressed in the epidermis[J].J Invest Dermatol,2009,129(12):2805-2817.
[9]Travers JB,Hamid QA,Norris DA,et al.Epidermal HLA-DR and the enhancement of cutaneous reactivity to superantigenic toxins in psoriasis[J].J Clin Invest,1999,104(19):1181-1189.
[10]Clarkson MR,Sayegh MH.T-cell costimulatory pathways in allograft rejection and tolerance[J].Transplantation,2005,80(5):555-563.
[11]Nengwen K,Li F,Li X,et al.B7-1 induces immunosuppression when expressed in cultured neonatal mice keratinocytes[J].Immunobiology, 2009,214(8):653-63.
[12]Curran MP.Plosker Bilayered bioengineered skin substitute(Apligraf): a review of its use in the treatment of venous leg ulcers and diabetic foot ulcers[J].BioDrugs,2002,16(6):439-455.
[13]Phillips TJ,Manzoor J,Rojas A,et al.The longevity of a bilayered skin substitute after application to venous ulcers[J].Arch Dermatol, 2002,138(8):1079-1081.
[14]Guerret S,Govignon E,Hartmann DJ,et al.Long-term remodeling of a bilayered living human skin equivalent(Apligraf)grafted onto nude mice:immunolocalization of human cells and characterization of extracellular matrix[J].Wound Repair Regen,2003,11(1):35-45.
The Effect of IFN-γ Increasing MHC-ⅡExpressing to the Immunogenicity of Keratinocytes
SONG Rengang1, SONG Renqiang2,LIU Dalie3.
1 Department of Plastic Surgery,Shenzhen People′s Hospital,Shenzhen 518020,China;2 Jiamusi Municipal Center for Disease Control and Prevention,Jiamusi 154002,China;3 Department of Plastic Surgery, Zhujiang Hospital,Southern Medical University,Guangzhou 510282,China.Corresponding author:LIU Dalie.
ObjectiveTo observe changes of immunogenicity of keratinocytes(KC)under the influence of interferon-γ (IFN-γ).MethodsKC were cultured and passaged in vitro.Different dose of IFN-γ stimulated KC to express MHC-Ⅱmolecules.KC with highty expressed MHC-Ⅱmolecules were mixed with allogenic lymphocytes to observe their proliferation.Simultaneously,MHC-Ⅱ+KC were implanted subcutaneously into allogenic mice to observe the sign of immunological rejection.ResultsUnder the influence of 6 000 U/mL IFN-γ,the percentage of MHC-Ⅱ+KC exceeded 90%.MHC-Ⅱmolecules highly expressed KC had no effects to stimulate proliferation of allogenic lymphocytes significantly. There were no obvious lymphocytes infiltration when MHC-Ⅱmolecules highly expressed KC were implanted subcutaneously into allogenic mice.ConclusionPassaged KC could express MHC-Ⅱmolecules highty in the influence of IFN-γ,KC expressed MHC-Ⅱmolecules has no obvious immunogenicity.
IFN-γ;MHC-Ⅱ;Keratinocyte;Immunogenicity
R392.12
A
1673-0364(2010)05-0248-05
2010年7月21日,
2010年8月18日)
10.3969/j.issn.1673-0364.2010.05.003
国家自然科学基金(30570517)。
518020广东省深圳市深圳市人民医院(宋仁刚);154002黑龙江省佳木斯市佳木斯市疾病控制中心(宋任强);510282广东省广州市南方医科大学珠江医院整形科(柳大烈)。
柳大烈
