胚胎干细胞标志CD31、SSEA-1在小鼠胚胎发育和成体组织中表达的初步研究
2010-03-27王书军张文杰
王书军 付 炜 张文杰
·论著·
胚胎干细胞标志CD31、SSEA-1在小鼠胚胎发育和成体组织中表达的初步研究
王书军 付 炜 张文杰
目的观察胚胎干细胞表面标志CD31、SSEA-1在小鼠胚胎发育过程中不同阶段的表达及在新生鼠、成体骨髓、睾丸中的表达情况,为进一步利用它们作为分子标志从胚胎及成体组织中分离多潜能性干细胞奠定基础。方法本实验选用129/SV系小鼠。孕10.5天、14.5天、18.5天的胚胎各取3例,新生鼠、6周龄成年鼠骨髓、成体睾丸各取3例,0.3%胶原酶消化获得单细胞悬液,经抗体染色标记后,通过流式细胞仪分析CD31、SSEA-1的表达情况。结果胚胎第10.5天、14.5天、18.5天和新生鼠中均有CD31、SSEA-1的表达,阳性细胞量随胚胎发育呈下降趋势。成年鼠骨髓和睾丸组织中也有CD31、SSEA-1阳性细胞存在,含量低于胚胎中的数量。结论CD31、SSEA-1在小鼠个体发育过程以及成体组织中都有不同程度的表达,阳性细胞比率随个体发育而降低。
血小板内皮细胞粘附分子-1时相专一性胚胎抗原-1胚胎骨髓睾丸
具有分化全能性的干细胞(Pluripotent stem cell)可以从胚胎发育早期甚至成体组织中分离获得,如从囊胚中可以获得胚胎干细胞(Embryonic stem cell),从成体睾丸中可以获得精原干细胞(Spermatogonial stem cell)等[1]。如何找到合适的细胞表面标志物,以利于从组织中高效地分离全能干细胞是研究的热点。以往研究表明,血管内皮粘附分子(Plaletetendothelial cell adhesion molecule,PECAM-1/CD31)和时相专一性胚胎抗原-1(Stage specificembryonicant-1,SSEA-1)在小鼠的胚胎干细胞中有很高的表达[2-3]。研究证实,CD31和SSEA-1可以作为分子标志从长期分化的拟胚体(Embryonic bodies,EBs)和畸胎瘤组织中分离培养得到全能干细胞[4],提示它们可能是合适的全能干细胞标记。
本研究拟观察CD31、SSEA-1在小鼠胚胎发育不同时间点、新生鼠、成体鼠骨髓和睾丸中的表达及变化过程,以期揭示它们作为分子标志分选全能干细胞的可能性。
1 材料和方法
1.1 实验动物
本实验所用动物取自我院SPF饲养的129/SV小鼠。雌雄鼠合笼第二天检查阴栓,记为0.5天,分别取怀孕10.5 d、14.5 d、18.5 d孕鼠各3例,新生鼠、成体骨髓、成体睾丸各取3只用于实验。
1.2 试剂及仪器
主要试剂:一抗兔抗鼠CD31(BD公司,美国);SSEA-1小鼠单克隆抗体IgM(Santa Cruz公司,美国);二抗PE-Cy5(BD公司,美国);FITC(eBioscience公司,美国);0.3%胶原酶(SERVA,德国)、胎牛血清(GIBCO公司,美国)、红细胞裂解液(BD公司,美国)、PBS缓冲液。主要仪器与设备:超净工作台(上海博讯实业有限公司)、EpicsAltra流式细胞分析仪(Beckman Coulter,美国)、恒温摇床(上海一恒科技有限公司)、普通台式离心机((Beckman Coulter,美国)、50 mL离心管(BD公司,美国)。
1.3 细胞获得
颈椎脱臼法处死小鼠,75%乙醇溶液浸泡3 min;于超净工作台内用眼科剪、眼科镊取胚胎、新生鼠及成体鼠骨髓、睾丸并剪碎;加入0.3%胶原酶,37℃恒温摇床5~10 min,加入适量血清终止消化,通过单细胞滤网获取所需细胞;37℃、1 500 r/min离心5 min,吸去上清液,红细胞裂解液重悬离心管内细胞(9份裂解液∶1份细胞),将离心管放置冰盒内10 min;4℃、2 000 r/min离心5 min,收集细胞准备染色。
1.4 流式细胞分析
吸去上清液,加入适量PBS缓冲液重悬细胞,吹打均匀,平均移至EP管中;加入一抗(1∶200),4℃孵育30 min,含2%羊血清的PBS漂洗3遍,加入二抗(PE-Cy5,1∶1 000;FITC,1∶200)4℃孵育30 min,含有2%胎牛血清的PBS漂洗3遍,上流式细胞仪分析。
2 结果
细胞经抗原抗体染色标记后,可经流式细胞仪观察到4个亚群,包括CD31+SSEA-1-、CD31+SSEA-1+、CD31-SSEA-1+和CD31-SSEA-1-细胞群,在发育的胚胎或成体骨髓、睾丸组织中均存在(图1)。
各时间点的胚胎、新生鼠以及成年鼠骨髓、睾丸样本均重复3例。分析结果显示,CD31在10.5 d、14.5 d、18.5 d胚胎中的表达率分别为37.0%、20.7%和15.7%;SSEA-1在10.5 d、14.5 d、18.5 d胚胎中的表达率分别为4.1%、1.5%和1.2%(图2)。CD31的表达随着胚胎发育过程有下降的趋势;SSEA-1表达量在胚胎发育过程中均维持在较低水平。CD31在新生鼠中的表达率为8.4%,低于在胚胎中的表达;SSEA-1在新生鼠中的表达率为1.3%,略高于在晚期胚胎中的表达。CD31在成体小鼠骨髓中表达率为10.3%,低于在胚胎中的表达,但高于在新生鼠中的表达;SSEA-1表达率2.2%。成体小鼠睾丸中CD31及SSEA-1的表达率均较低,分别为3.2%和1.4%。
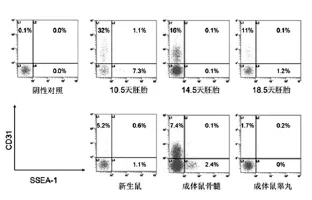
图1 流式细胞仪检测CD31、SSEA-1在胚胎发育过程和新生鼠以及成体鼠骨髓、睾丸中的表达

图2 CD31、SSEA-1在不同时间胚胎和新生鼠及成体鼠、睾丸中的表达
在胚胎和成体组织中均发现CD31+SSEA-1+细胞,除早期胚胎(E10.5)含量较高外(2.8%),其他组织均维持在较低水平(0.2%~0.7%)。
3 讨论
近年来的研究发现,除了从囊胚中分离获得的胚胎干细胞具有分化全能性以外,成体组织中也发现了具有3个胚层分化能力的干细胞[5-6]。因此,Ratajczak等[7]提出多潜能性干细胞分化残留的设想。他们认为,在个体发育过程中,可能有极少量的多潜能性干细胞始终保持原始的未分化状态,且在发育过程中迁移至不同的组织中并保留至成体。但迄今尚无证据证实该假说。我们的前期研究证实,小鼠胚胎干细胞在体内外分化过程中残留有未分化的全能性细胞,为发育过程中干细胞残留提供了间接的证据。为了找到直接证据,寻找合适的干细胞标志是关键。我们推测,残留细胞可能表达胚胎干细胞的标志。通过胚胎干细胞分化残留实验,我们发现残留细胞表达CD31和SSEA-1,进一步推测这两个细胞表面分子可能是发育过程中残留干细胞的标志,因此我们对胚胎及成体中这两个分子的表达进行了分析。
CD31最早表达于囊胚的内细胞团,形成外胚层(Epiblast)后表达降低,在E6.5 d左右血管和血液系统形成时再次出现,之后表达广泛存在于内皮细胞、血小板、巨噬细胞、肝Kupffer细胞、淋巴细胞等类型的细胞中,通常被当作是内皮细胞和成血管细胞的表面分子标志[8]。SSEA-1最早表达于8细胞后期,在桑椹胚的表达最为显著,随后在囊胚的内细胞团内有少量表达,胚胎着床后SSEA-1从滋养外胚层消失,以后又出现于原始生殖细胞表面。成年小鼠中,生殖系统中的子宫内膜、输卵管、肾小管、精子均能检测到少量的SSEA-1表达。另外,小脑和神经干细胞中也能检测到它的少量表达[9]。SSEA-1一直被认为是小鼠胚胎干细胞的分子标记,其在小鼠的胚胎干细胞中高度表达,并且在胚胎植入到子宫之前的细胞迁移和细胞黏附中起着重要作用。小鼠胚胎干细胞表达CD31和SSEA-1,在体外类胚体分化过程中CD31表达迅速下降而SSEA-1下降缓慢,分化第二天时可见CD31-SSEA-1+细胞,这群细胞与从胚胎植入后外胚层分离的外胚层干细胞(Post-implantation epiblast-derived stem cells)相似。进一步分化后,SSEA-1的表达也降低,而CD31的表达重新上升,这与血液和血管细胞分化有关[10]。本研究中,我们发现CD31的表达随胚胎发育阳性细胞比率逐渐减少,而在成体骨髓中仍有高表达,推测与骨髓中血液细胞有关。SSEA-1的表达随胚胎发育阳性细胞比率逐渐减少这与预期的结果一致。
本研究证实,在胚胎和成体组织中均有CD31+SSEA-1+细胞存在,除早期胚胎(E10.5)含量较高(2.8%)外,其他组织均维持在较低水平(0.2%~0.7%)。如果CD31+SSEA-1+细胞代表或富含分化残留的全能干细胞,那么这一比率是比较符合的,有待细胞分选实验进一步证实。前期我们对胚胎不同阶段的细胞作了分选和培养,没有获得胚胎干细胞样的细胞,可能与培养方法和条件有关。Guan等[11]发现,睾丸细胞如果直接在胚胎干细胞培养条件下培养,并不能获得胚胎干细胞样细胞,只有首先在精原干细胞培养条件下培养获得克隆,才能进一步在胚胎干细胞培养条件下扩增。因此,培养成体组织中的干细胞方法有待于继续探索。
CD31+SSEA-1+细胞在胚胎和成体组织中的存在,提示它们有可能作为分子标志,来证实Ratajczak等提出的多潜能性干细胞分化残留的假说。
[1]Ogawa T,Ohmura M,Tamura Y,et al.Derivation and morphological characterization of mouse spermatogonial stem cell lines[J].Arch Histol Cytol,2004,67(4):297-306.
[2]Bao S,Tang F,Li X,et al.Epigenetic reversion of post-implantation epiblast to pluripotent embryonic stem cells[J].Nature,2009,461 (7268):1292-1295.
[3]Abaskharoun M,Bellemare M,Lau E,et al.Expression of hyaluronan and the hyaluronan-binding proteoglycans neurocan,aggrecan,and versican by neural stem cells and neural cells derived from embryonic stem cells[J].Brain Res,2010,1327:6-15.
[4]付炜,皮庆猛,石伦刚,等.类胚体中残留未分化胚胎干细胞的初步研究[J].上海交通大学学报(医学版),2009,29(7):808-812.
[5]Jiang Y,Vaessen B,Lenvik T,et al.Multipotent progenitor cells can be isolated from postnatal murine bone marrow,muscle,and brain[J].Exp Hematol,2002,30(8):896-904.
[6]Seandel M,James D,Shmelkov SV,et al.Generation of functional multipotent adult stem cells from GPR125+germline progenitors [J].Nature,2007,449(7160):346-350.
[7]Ratajczak MZ,Machalinski B,Wojakowski W,et al.A hypothesis for an embryonic origin of pluripotent Oct-4(+)stem cells in adult bone marrow and other tissues[J].Leukemia,2007,21(5):860-867.
[8]Watt SM,Gschmeissner SE,Bates PA.PECAM-1:its expression and function as a cell adhesion molecule on hemopoietic and endothelial cells[J].Leuk Lymphoma,1995,17(3-4):229-44.
[9]Fox N,Damjanov I,Martinez-Hernandez A,et al.Immunohistochemical localization of the early embryonic antigen(SSEA-1)in postimplantation mouse embryos and fetal and adult tissues[J]. Dev Biol,1981,83(2):391-398.
[10]Yue W,Pi QM,Zhang WJ,et al.PECAM-1,SSEA-1 and Flk-1 mark distinct populations of mouse embryonic stem cells during differentiation towards hematopoietic/endothelial cells[J].Stem Cells Dev,2010,[Epub ahead of print]
[11]Guan K,Nayernia K,Maier LS,et al.Pluripotency of spermatogonial stem cells from adult mouse testis[J].Nature,2006,440(7088): 1199-1203.
Primary Study of the Expression of Embryonic Stem Cell Markers CD31 and SSEA-1 in Developing Embryos and Adult Tissues
WANG Shujun,FU Wei,ZHANG Wenjie.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People′s Hospital,Shanghai Jiaotong University School of Medicine,National Tissue Engineering Center,Shanghai 200011,China.Corresponding author:ZHANG Wenjie.
ObjectiveTo detect the expression of CD31 and SSEA-1 at different stages of developing embryos,as well as their expressions in neonates,adult bone marrow and testis.Methods129/SV mice were mated.Embryos at 10.5 postcoitus(E10.5),14.5 and 18.5 days were collected.In addition,neonatal mice,bone marrow and testis from 6-week-old mice were also collected.Single cell suspension was achieved by digestion with collagenase.After anti-CD31 and anti-SSEA-1 antibody labeling,cells were analyzed by flow cytometry.ResultsCD31 and SSEA-1 were expressed in E10.5, E14.5 and E18.5.The expression levels were decreased with the development of embryos.Meanwhile,both markers were observed in neonates,adult bone marrow and testis,but the level was lower than in embryos.ConclusionA certain amount of CD31 and SSEA-1 expressing cells are existing in developing embryos as well as in adult tissues.
CD31;SSEA-1;Embryo;Bone marrow;Testis
Q813.1+1
A
1673-0364(2010)05-0241-03
2010年8月3日,
2010年9月25日)
10.3969/j.issn.1673-0364.2010.05.001
国家重点基础研究发展计划(2005CB522705);国家自然科学基金(30571925,30671051);上海市曙光人才计划(06SG22);上海交通大学博士点创新基金(BXJ0920)。
200011上海市上海交通大学医学院附属第九人民医院整复外科;组织工程国家工程中心。
张文杰。
