Taqman-MGB探针RT-PCR方法检测食品中脊髓灰质炎病毒
2010-03-25潘良文卢钟山张舒亚刘月明
李 想,黄 一,2,潘良文,*,卢钟山,张舒亚,吕 蓉,刘月明,高 琴
(1.上海出入境检验检疫局,上海 200135;2.华东理工大学生物工程学院,上海 200237)
Taqman-MGB探针RT-PCR方法检测食品中脊髓灰质炎病毒
李 想1,黄 一1,2,潘良文1,*,卢钟山1,张舒亚1,吕 蓉1,刘月明1,高 琴1
(1.上海出入境检验检疫局,上海 200135;2.华东理工大学生物工程学院,上海 200237)
目的:建立食品中脊髓灰质炎病毒Taqman-MGB探针实时荧光RT-PCR检测方法。方法:在脊髓灰质炎病毒基因组2A区设计引物和探针,对3种血清型脊髓灰质炎病毒进行单独和同时检测。通过参照分子建立标准曲线,对人工接种病毒的牡蛎、蓝莓、生菜和水食品样品进行检测。结果:建立的检测体系分别高度特异于相应血清型病毒检测,对3种血清型脊髓灰质炎病毒进行单独和同时检测的下限均为2拷贝参照分子DNA。基于参照分子建立的4条标准曲线具有很好线性关系(R2=0.999)和较高反应效率(1.01~1.04)。对4种食品样品的分析表明,建立的实时荧光RT-PCR方法可稳定检测到各添加浓度脊髓灰质炎病毒。结论:建立的Taqman-MGB探针实时荧光RT-PCR检测体系适于食品中脊髓灰质炎病毒的检测。
脊髓灰质炎病毒;实时荧光RT-PCR;Taqman-MGB探针;食品;参照分子
近年来,由于食用受病毒污染食品而引起的疾病爆发已成为国际上重点关注的食品安全事件之一,其中源于肠道病毒而引发的疾病占67%以上。作为一种致病性肠道病毒,脊髓灰质炎病毒(polioviruses,PVs)虽然已在全世界基本消灭,但由于脊髓灰质炎病毒疫苗的广泛使用,其突变株近几年在多个国家引发了疫苗衍生脊髓灰质炎病毒感染事件[1-3]。据世界卫生组织统计,2009年1至11月间疫苗衍生脊髓灰质炎病毒感染病例已升至151例,野生型病毒感染病例近1500例[4-5]。为了加强PVs的监控,防止“病从口入”至关重要。由于PVs
主要在人类排泄物和污水中存活,贝类及某些即食性水果和蔬菜存在受病毒污染的风险[6-7]。因此建立食品中PVs快速高效检测方法是保障食品安全的重要技术手段之一。
近几年国内外相继报道了检测PVs的巢式PCR、常规PCR及ELISA等方法[8-10],这些检测技术多以患儿的粪便或分泌物样本为检测目标。与人类排泄物相比,食品中病毒含量更低,干扰因子更加复杂,因此需要针对性和灵敏度更高的检测方法。随着分子生物学技术的发展,实时荧光PCR技术已广泛应用于特征性DNA的检测。其中近年发展起来的Taqman-MGB探针由于具有特异性好、灵敏度高、稳定性好、优化步骤简单、结果精确、分辨率高等优点而逐步应用于检测中[11-13]。本研究基于Taqman-MGB探针建立分别检测血清Ⅰ、Ⅱ和Ⅲ型脊髓灰质炎病毒的快速、高灵敏度方法。
1 材料与方法
1.1 材料、试剂与仪器
血清Ⅰ、Ⅱ、Ⅲ型PVs灭活疫苗悬浮液由美国加州大学学者惠赠,A9、A16、B2、B3和B5型灭活柯萨奇病毒和含GⅡ型诺如病毒粪便样品购自中国疾病预防控制中心病毒预防控制研究所。
PBS缓冲液(0.14mol/L NaCl,0.003mol/L KCl,0.00175mol/L KH2PO4,0.01mol/L Na2HPO4,pH 7.5) 上海生工生物工程有限公司;甘氨酸缓冲液(0.1mol/L甘氨酸,0.3mol/L NaCl,pH9.5);PEG 8000溶液(16% PEG 8000,0.525mol/L NaC1);TIANamp病毒RNA提取试剂盒(产品序列号SD101) 天根生物科技有限公司;Prime ScriptTM反转录试剂盒(产品序列号DRR037A) 、Premix Ex TaqTM实时荧光扩增试剂盒(产品序列号 DRR039A) 宝生物工程有限公司;醋酸/硝酸混合纤维素滤膜(产品序列号R7SN20186) 密理博贸易有限公司;5810R型台式离心机、Mastercycler Gradient PCR仪、Thermomixer comfort型恒温混匀器 Eppendorf公司;ABI PRISM 7300型序列分析系统 Applied Biosystems公司。
1.2 引物与探针
对GenBank数据库中已公布的PVs 各病毒株cDNA序列进行比对和分析,寻找各血清型间相对保守,与其他肠道病毒株同源性较低的区域,选择PVs基因组2A区设计引物和探针。由于简并引物对实时荧光PCR反应效率影响较大,对Ⅰ、Ⅱ和Ⅲ型PVs分别设计了一套特异性引物和探针FP1/RP1/Probe1、FP2/RP2/Probe2和FP3/RP3/Probe3(表1),3对引物扩增区域在3种血清型中所处位置相近。进行Blast比对后,设计的引物和探针仅与脊髓灰质炎病毒相关序列匹配。
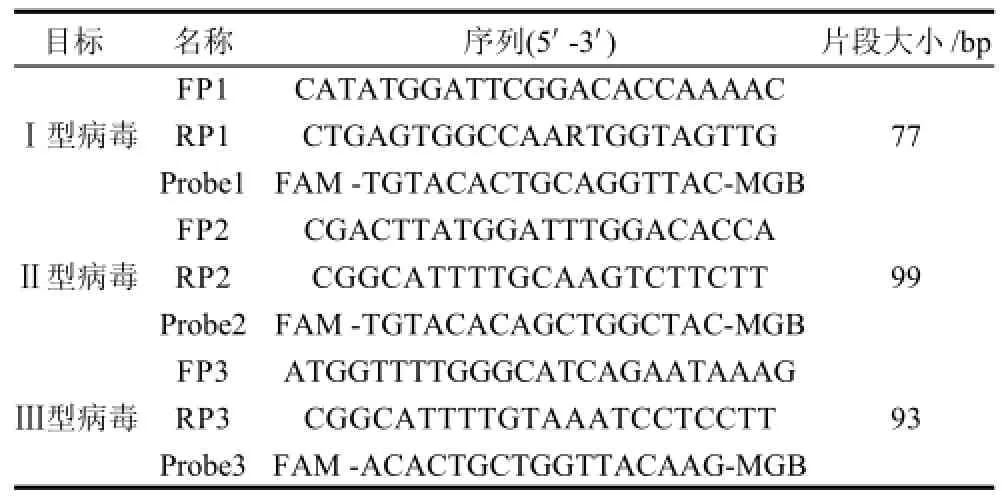
表1 3种血清型脊髓灰质炎病毒实时荧光RT-PCR检测引物和探针Table 1 Primer and probe sets used for real-time RT-PCR detections of serotypes 1, 2 and 3 of polioviruses
1.3 病毒灭活疫苗、粪便样品中病毒RNA提取
PVs灭活疫苗、含诺如病毒粪便、灭活柯萨奇病毒样品使用TIANamp病毒RNA提取试剂盒进行RNA提取和纯化。
1.4 脊髓灰质炎病毒灭活疫苗悬浮液中病毒拷贝数测定
分别取140μLⅠ、Ⅱ、Ⅲ型PVs灭活疫苗悬浮液(每种血清型取10-4、10-5和10-63个稀释液)进行病毒RNA提取,采用本研究建立的实时荧光检测体系进行扩增,重复3次,通过建立的标准曲线计算样品病毒拷贝数。经计算Ⅰ、Ⅱ、Ⅲ型PVs悬浮液浓度分别为2.52×106、5.36×106拷贝/μL和6.55×106拷贝/μL。
1.5 食品样品中病毒的人工接种
1.5.1 贝类和果蔬样品
称取5g牡蛎肠腺组织,将140μL分别为2700、270和54拷贝Ⅰ型脊髓灰质炎病毒悬浮液注入牡蛎肠腺组织中,匀浆后转移至50mL离心管中。
称取15g 新鲜蓝莓或生菜样品,将140μL分别为2700、270和54拷贝Ⅰ型脊髓灰质炎病毒悬浮液均匀点种于蔬果外表面,室温放置30min,使病毒悬浮液完全被蔬果表面吸附并干燥。
分别取一份不含脊髓灰质炎病毒污染的贝类或蔬果样品作为阴性对照。Ⅱ型、Ⅲ型脊髓灰质炎病毒的接种方法同上。Ⅰ、Ⅱ、Ⅲ型病毒同时添加的样品中每种血清型病毒分别占总量的1/3,接种方法同上。
1.5.2 水样
分别取140μL为2700、270和54拷贝Ⅰ型脊髓灰质炎病毒悬浮液加入100mL自来水中,充分混匀,室温放置60min。同时制备一份不含脊髓灰质炎病毒的100mL水样作为阴性对照。Ⅱ型和Ⅲ型脊髓灰质炎病毒接种方法同上。Ⅰ、Ⅱ、Ⅲ型病毒同时添加的水样中每种血清型病毒分别占总量的1/3,接种方法同上。
1.6 食品中脊髓灰质炎病毒富集和RNA提取与纯化
1.6.1 贝类样品
采用参考文献[14]的方法。
1.6.2 果蔬样品
将样品放入50mL离心管中,加入35mL甘氨酸缓冲液,37℃振荡30min。4℃ 9703r/min离心30min。转移上清液至一新离心管,加入等体积PEG8000溶液,4℃放置过夜。4℃ 10629r/min离心30min,弃上清液。向沉淀中加入140μL PB S缓冲液使沉淀悬浮均匀。采用TIANamp病毒RNA提取试剂盒提取病毒RNA。
1.6.3 水样
将100mL水样分次通过直径为47mm,孔径为0.45μm的醋酸/硝酸混合纤维素滤膜进行过滤;取出滤膜,平整放于聚乙烯薄膜袋中,加入113 1.2μL Buffer RL-carrier RNA混合液(TIANamp病毒RNA提取试剂盒),剧烈振荡30s;室温浸泡滤膜20min,将液体完全转移到15mL离心管中。采用TIANamp病毒RNA提取试剂盒提取病毒RNA。
1.7 反转录反应
反应体系为10μL,包括1×缓冲液,0.5μL反转录酶混合液,0.5μL Oligo (dT) (0.125μmol/L),5μL RNA溶液。反应条件为:37℃,15min;85℃,5s。
1.8 实时荧光RT-PCR反应和标准曲线制备
反应体系为20μL,包括1×Premix Ex Taq,上下游引物各0.2μmol/L,探针0.2μmol/L,1×ROX荧光染料,2μL病毒cDNA或参照分子DNA溶液。实时荧光扩增条件为:95℃,10s;95℃,5s;60℃,31s;45个循环。
为了建立标准曲线,将实验室前期工作构建的3种参照分子DNA分别稀释至106、105、104、103、102、10拷贝/μL。进一步稀释至5、2和1拷贝/μL用于检测下限分析。对3种血清型病毒同时检测的标准曲线制备,则采用含有等量3种参照分子的稀释液,进行10倍梯度稀释,将3对引物和探针混合后进行扩增。反应均重复3次。在荧光扩增曲线对数期选择域值,获得Ct值。以Ct值为横坐标,DNA拷贝数对数值为纵坐标作图即得到标准曲线。PCR反应效率通过以下公式计算:E= 10-1/曲线斜率-1。对人工接种的食品样品中脊髓灰质炎病毒的检测,则通过上述获得的标准曲线和方程计算拷贝数,并对3次重复间的拷贝数相对标准偏差(RSD)进行计算。
2 结果与分析
2.1 实时荧光RT-PCR检测体系特异性测试
为了鉴定建立的检测体系的特异性,以Ⅰ、Ⅱ、Ⅲ型PVs, B2、B3、B5、A9和A16型柯萨奇病毒及GⅡ型诺如病毒cDNA为模板,分别采用设计的3套引物和探针进行RT-PCR扩增。采用引物和探针FP1/RP1/ Probe1进行扩增时,仅有Ⅰ型脊髓灰质炎病毒cDNA模板产生明显的扩增曲线,以其他病毒或血清型cDNA(包括诺如病毒、柯萨奇病毒、Ⅱ、Ⅲ型PVs)为模板时均未出现荧光信号增幅(表2)。同样地,利用引物和探针FP2/RP2/Probe2和FP3/RP3/Probe3进行扩增时,只有分别以Ⅱ型和Ⅲ型脊髓灰质炎病毒cDNA为模板才可见显著的荧光增幅。因此,针对Ⅰ、Ⅱ和Ⅲ型PVs建立的Taqman-MGB探针实时荧光检测体系分别高度特异于对应血清型脊髓灰质炎病毒检测。

表2 实时荧光RT-PCR检测体系特异性测试Table 2 Specificity tests of real-time RT-PCR detection systems for serotypes 1, 2 and 3 of polioviruses
2.23 种血清型脊髓灰质炎病毒的单独检测
2.2.1 标准曲线制备
分别以106、105、104、103、102、10拷贝/μL 6个水平的参照分子pMD18-PV1、pMD18-PV2和pMD18-PV3 DNA为外标准品构建标准曲线。扩增曲线、标准曲线和对应方程见图1A~1C。结果显示,针对Ⅰ、Ⅱ和Ⅲ型PVs检测建立的标准曲线PCR反应效率分别为1.04、1.01和1.03,均接近1,说明扩增反应基本未受抑制因子影响。Ct值与模板拷贝数对数的相关系数(R2)均为0.999。对实时荧光PCR体系可重复性分析表明,Ct值标准偏差(s)均小于0.25,介于0.025至0.211之间(表3),在可接受范围内,说明建立的检测体系具有较好的可重复性。因此针对Ⅰ、Ⅱ和Ⅲ型PVs建立的实时荧光检测体系适于进一步对食品样品的检测。
2.2.2 检测下限分析
分别以5、2和1拷贝/μL三个参照分子DNA溶液为模板测试检测体系灵敏度,每个浓度DNA重复检测10次。结果显示包括最低1拷贝/μL模板(2拷贝/反应)
在10次检测中均可被稳定检出。因此,建立的3种实时荧光检测体系的检测下限均为2拷贝参照分子DNA。
2.33 种血清型脊髓灰质炎病毒的同时检测
2.3.1 标准曲线制备和检测下限分析
为了满足口岸快速检测的要求和简化检测流程,实现3种血清型病毒的同时检测,本研究对建立的3个检测体系进行混合用于检测。将上述针对3种血清型病毒分别设计的3套引物和探针进行混合,对反应体系和反应条件优化后,建立了一个反应管内同时检测3种血清型PVs的实时荧光体系。
通过制备的标准曲线(图1D)可以看出,PCR反应效率达1.01,相关系数为0.999。3次平行重复的标准偏差值介于0.004至0.244之间(表3)。对体系的检测下限分析表明,与对3种血清型病毒分别检测的灵敏度相似,对3种血清型病毒同时检测可扩增到的最低模板量亦为2个拷贝参照分子DNA。
2.3.2 同时检测与单独检测体系的比较

表3 基于参照分子的Ⅰ、Ⅱ和Ⅲ型PVs检测体系可重复性分析Table 3 Repeatability of Ct values for serotypes 1, 2 and 3 of PVs detection based on the reference molecules

图1 基于参照分子建立的适于3种血清型PVs单独和同时检测的扩增曲线和标准曲线Fig.1 Standard curves and amplification plots for three serotypes of PVs detections based on the reference molecules

表4 对Ⅰ、Ⅱ、Ⅲ型PVs实施单独检测和同时检测的比较Table 4 Comparison of separate and simultaneous detection of serotypes 1, 2 and 3 of PVs
本研究对3种血清型脊髓灰质炎病毒实施单独检测和同时检测的PCR扩增反应进行了比较。以3个水平样品cDNA为模板,通过单独与同时检测体系对Ⅰ、Ⅱ和Ⅲ型PVs的分析表明,平均Ct值差值平均值分别介于-0.11~0.043,-0.043~0.32,以及0.093~0.226之间;标准偏差值分别小于等于0.32,0.27和0.34(表4)。对3种血清型病毒实施单独检测与同时检测的Ct值差异未达显著水平,扩增曲线基本重合。由此可见,对3种血清型PVs进行同时检测与单独检测效果无显著差异。
2.4 食品样品中脊髓灰质炎病毒的检测

图2 食品样品中添加3个浓度PV3病毒的扩增曲线Fig.2 Amplification plots of four food samples inoculated with PV3
为了鉴定建立的检测体系对食品样品中脊髓灰质炎病毒的实际检测效果,本研究选择了易受病毒污染的4类食品,包括牡蛎、蓝莓、生菜和水进行病毒人工接种。结果如图2和表5所示,在4种食品样品中分别添加I、II或III型2700、270和54拷贝病毒,扩增曲线均可稳定出现荧光增幅。拷贝数的RSD在1.8%至45.0%之间,相比较而言,较大的3个RSD值(42.8%、42.8%、45.0%)出现在添加浓度最低的54拷贝病毒的水样中。同时添加3种血清型病毒的食品样品检测结果与单独添加的结果相似,即当病毒添加量低至54拷贝时,仍可稳定获得有荧光增幅的扩增曲线,RSD值在3.8%至40.3%之间。因此,建立的脊髓灰质炎病毒Taqman-MGB实时荧光RT-PCR检测方法适于食品中脊髓灰质炎病毒的检测。
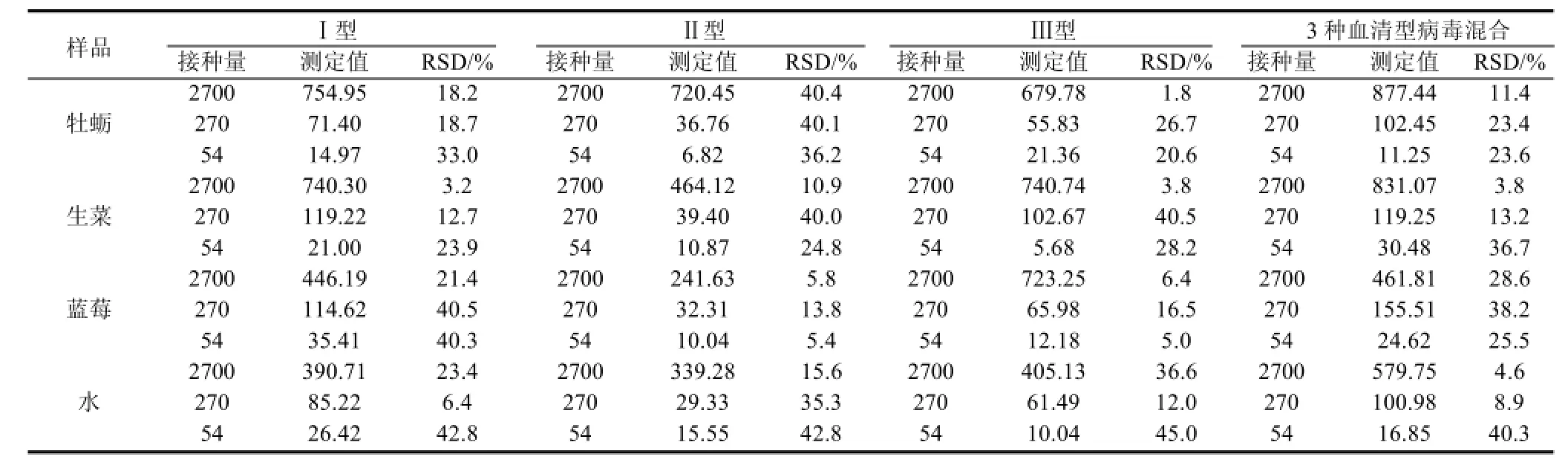
表5 食品样品中脊髓灰质炎病毒的检测Table 5 Detection of polioviruses in four inoculated food samples拷贝数
3 讨 论
近年来,包括中国在内的很多国家均发现了野生型和疫苗型PVs感染病例[1-3]。降低食源性PVs感染和扩散是防控病毒流行的一个重要方面。由于贝类、果蔬和水样等食品样品中病毒含量较低,建立特异性好、灵敏度高的检测方法至关重要。基于此,本研究建立了Taqman-MGB探针实时荧光RT-PCR方法用于食品中PVs检测。Taqman-MGB探针能分辨出模板与探针结合区一个碱基的差别,检测特异性高[16],且MGB探针长度在13~19个碱基[11],对于突变度较高的病毒株间寻找适宜的检测区域十分有利。
鉴于Taqman-MGB探针应用的诸多优点,本研究针对3种血清型PVs设计了3套引物和探针,每套引物和探针均高度特异于对应血清型病毒检测。3套引物和探针既可用于3种血清型病毒单独检测,也可混合用于3种血清型病毒的同时检测,使用更加灵活,并且单独检测与同时检测效果没有显著差异。以参照分子为外标准品的检测下限分析表明建立的单独和同时检测体系可检
测到的最低模板量为2拷贝,较前人建立的脊髓灰质炎病毒RT-PCR检测方法灵敏度提高至少一个数量级[8-9]。对4类易受病毒污染的人工接种食品样品分析表明,无论实施单独检测还是同时检测,对添加低至54拷贝病毒的样品均可稳定检测到荧光信号增幅。
因此本研究建立的脊髓灰质炎病毒Taqman-MGB探针实时荧光检测方法适用于贝类、水果、蔬菜和水等食品样品中PVs的检测。
[1]KEW O, MORRIS-GLASGOW V, LANDAVERDE M, et al. Outbreak of poliomyelitis in Hispaniola associated with circulating type I vaccinederived poliovirus[J]. Science, 2002, 296(5566): 356-359.
[2]ROUSSET D, RAKOTO-ANDRIANARIVELO M, RAZAFINDRATSIMANDRESY R, et al. Recombinant vaccine-derived poliovirus in Madagascar[J]. Emerg Infect Dis, 2003, 9(7): 885-887.
[3]许文波, 张勇, 严冬梅, 等. Ⅰ型疫苗衍生脊髓灰质炎病毒循环的发现和基因特点[J]. 中国计划免疫, 2005, 11(4): 252-259.
[4]Circulating vaccine-derived poliovirus[EB/OL].(2009-11-24.)[2009-12-4].http://www.polioeradication.org/content/general/cvdpv_count.pdf.
[5]Wild poliovirus[EB/OL].(2009-12-01)[2009-12-04]. http://www. polioeradication.org/content/general/casecount.pdf.
[6]DOWDLE W R, WOLFf C. Post-eradication poliovirus facility-associated community risks[J]. Biologicals, 2006, 34: 127-132.
[7]GREENING G E, DAWSON J, LEWIS G. Survival of poliovirus in New Zealand green-lipped mussels, Perna canaliculus, on refrigerated and frozen storage[J]. J Food Prot, 2001, 64: 881-884.
[8]CHEZZI C. Rapid diagnosis of poliovirus infection by PCR amplification [J]. J Clin Microbiol, 1996, 34(7): 1722-1725.
[9]De MEDICI D, BENEDUCEB F, FIOREA A, et al. Application of reverse transcriptase-nested-PCR for detection of poliovirus in mussels [J]. Int J Food Microbiol, 1998, 40: 51-56.
[10]ANDREOLETTI L, HOBER D, BELAICH S, et al. Rapid detection of enterovirus in clinical specimens using PCR and microwell capture hybridization assay[J]. J Virol Methods,1996, 62(1): 1-10.
[11]KUTYAVIN I V, AFONINA I A, MILLS A, et al. 3'-Minor groove binder-DNA probes increase sequence specificity at PCR extension temperatures[J]. Nucleic Acids Res, 2000, 28 (2): 655-661.
[12]黄东东, 翁少萍, 吕玲, 等. TaqMan MGB实时荧光PCR对转基因大豆定量检测的研究[J]. 中山大学学报: 自然科学版, 2008, 47(3): 140-142.
[13]闻伟刚, 谭钟, 张吉红, 等. 应用TaqMan MGB探针技术检测菜豆荚斑驳病毒[J]. 植物保护学报, 2009, 36(1): 7-10.
[14]KINGSLEY D H. Detection of hepatitis a virus and Norwalk-like virus in imported clams associated with food-brone illness[J]. Appl Environ Microbiol, 2002, 68(8): 3914-3918.
[15]KOJIMA S, KAGEYAMA T, FUKUSHI S, et al. Genogroup-specific PCR primers for detection of Norwalk-like virus[J]. J Virol Methods, 2002, 100: 107-114.
[16]COCKERILL F R. Application of rapid-cycle real-time polymerase chain reaction for diagnostic testing in the clinical microbiology laboratory[J]. Arch Pathol Lab Med, 2003, 127(9): 1112-1120.
Detection of Polioviruses in Foodstuffs by Real-time RT-PCR Based on Taqman-MGB Probe
LI Xiang1,HUANG Yi1,2,PAN Liang-wen1,*,LU Zhong-shan1,ZHANG Shu-ya1,LIU Yue-ming1,GAO Qin1
(1. Shanghai Entry-Exit Inspection and Quarantine Bureau, Shanghai 200135, China;2. School of Bioengineering, East China University of Science and Technology, Shanghai 200237, China)
This study was aimed to develop three sero-specific real-time RT-PCR detection systems based on Taqman-MGB probes for the assay of polioviruses in foodstuffs. Primer and Taqman-MGB probe sets based on the 2A region of poliovirus genome were designed to detect three serotypes of polioviruses separately and simultaneously. Four artificially inoculated food samples, including oyster, blueberry, lettuce and water were analyzed based on the established standard curves using three reference molecules as calibrators. Sensitivity tests suggested that at least 2 copies of the reference molecule DNA could be stably detected both in the separate and simultaneous detection systems. Good linearity with the correlation coefficient above 0.999 and high reaction efficiency (1.01-1.04) were observed in four standard curves employing serially diluted reference molecule DNA as the calibrator. Three serotypes of polioviruses in four inoculated samples were successfully detected using the established real-time RT-PCR detection systems. The developed real-time RT-PCR detection systems based on Taqman-MGB probes are most suitable for polioviruses detection in foodstuffs.
polioviruses;rea1-time RT-PCR;Taqman-MGB probe;foodstuffs;reference molecule
TS201.6;R155.5
A
1002-6630(2010)10-0200-06
2009-08-05
上海技术标准专项(07DZ05026);国家质检总局科研项目(2007B150);科技部世博科技专项(2009BAK43B31);上海市科委创新平台服务项目(10DZ2294102)
李想(1978—),女,工程师,博士,研究方向为分子生物学。E-mail:idealne@163.com
*通信作者:潘良文(1966—),男,研究员,博士,研究方向为食品安全检测。E-mail:pan888@126.com
