富贵菜功能成分多糖提取纯化工艺优化
2010-03-25邱细敏姜曼花陆艳艳杨小红李丽立
邱细敏,姜曼花,谭 敏,陆艳艳,杨小红,冯 星,李丽立
(1.湖南师范大学医学院,湖南 长沙 410008; 2.中国科学院亚热带农业生态研究所,湖南 长沙 410125)
富贵菜功能成分多糖提取纯化工艺优化
邱细敏1,姜曼花1,谭 敏1,陆艳艳1,杨小红1,冯 星1,李丽立2
(1.湖南师范大学医学院,湖南 长沙 410008; 2.中国科学院亚热带农业生态研究所,湖南 长沙 410125)
目的:研究富贵菜多糖提取纯化工艺,为有效开发利用功能性食品——富贵菜提供方法学基础。方法:通过正交试验,优化提取方案;采用Sevag法脱蛋白,双氧水和活性碳脱色,蒽酮-硫酸法测定多糖含量。结果:在温度100℃,固液比1:7(富贵菜:水,g/mL),提取时间3.5h,提取次数2次的条件下,所得多糖含量最高。以氯仿:正丁醇的体积比4:1为脱蛋白剂,加入0.15g/mL的活性炭溶液,80℃脱色45min,脱色2次或加入多糖供试液体积70%的双氧水试液于60℃脱色120min效果最佳。结论:该工艺条件简单可行,多糖提取率高,稳定性好,可作为富贵菜多糖的提取纯化工艺。
富贵菜;多糖;提取纯化工艺;含量测定
富贵菜[Gynura divaricata(L.)DC.],别名白子草、白(百)子菜、鸡菜、大肥牛、叉花土三七、菊三七、白背菜等,中药名为富贵菜(或白三七草),为菊科三七草属多年生宿根草本植物,分布于台湾至华南、西南一带[1]。喜生长于村旁、山坡等地,20世纪90年代中后期逐渐从自然野生发展为人工栽培,现已被广大消费者所接受,是一种名优特保健野菜[2]。食用部位为嫩梢茎、叶,可作汤、凉拌或炒食。富贵菜味淡、性寒,富含多种维生素和矿物质,具有降血糖[3]、清热解毒、止血、凉血等功效。新鲜的富贵菜翠嫩爽口,滚汤方便快捷、营养丰富,且可作为夏日清润的汤水。另外可辅助治疗急性结膜炎、小儿高热、心肺积热等症,对肝热、烟酒过多引起的上火作用明显,对糖尿病有一定的辅助治疗作用[4]。采用适宜的烹制方法,不但可获得良好的口感,也可取得较好的食疗效果。
富贵菜作为一种名优特保健野菜,目前对其研究多见于栽培技术的改进[2,5]。对其功能性成分的研究极少,化学活性成分仅见该植物吡咯啶生物碱[6]、黄酮类成分[7-8]及脂肪酸成分分析[9]的报道,尚未见有关主要功能性成分之一的多糖提取工艺的研究报道。多糖
(polysaccharide)是构成生命的四大基本物质之一,多糖在增强免疫力、降血糖、抗肿瘤、抗炎、抗病毒、抗衰老、抗凝血等方面发挥着生物活性作用。本实验研究富贵菜及功能性成分多糖的提取工艺,旨在为这一野菜资源的研究开发提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
富贵菜 市购。
无水乙醇、浓硫酸、蒽酮、氯仿、正丁醇(均为分析纯)、葡萄糖标准品 国药集团化学试剂有限公司。
UV-2501 PC紫外分光光度计 日本岛津公司。
1.2 方法
1.2.1 多糖提取率的测定
用蒽酮-硫酸法测定多糖含量[10],按照下式计算多糖提取率。

式中:c为测定质量浓度(用蒽酮-硫酸法测吸光度与标准溶液对照所得);D为稀释倍数;V为测定体积;m为药材质量。
1.2.2 富贵菜多糖的提取试验设计
1.2.2.1 单因素试验
取切碎干燥富贵菜15g,石油醚脱脂后分别进行如下不同的单因素试验制得粗多糖。
1)在不同提取温度条件下,固液比1:9(富贵菜:水,g/mL),提取2次,每次2h;2)在不同固液比条件下,90℃,提取2次,每次2h;3)90℃,固液比1:9,提取不同次数,每次2h;4)采用不同提取时间,90℃,固液比1:9,提取2次。
1.2.2.2 正交试验

表1 因素与水平Table 1 Factors and levels in orthogonal array design
根据单因素试验结果确定正交水平,即提取时间、提取温度、固液比、提取次数,通过正交试验结果选择最佳提取条件。
1.2.3 脱蛋白条件优化
将粗多糖用适量蒸馏水加热溶解,加入乙醇至乙醇体积分数为75%,静置过夜,抽滤得浅褐色多糖,按照无水乙醇→丙酮的顺序依次洗涤3遍,至蒸发皿中,真空冷冻干燥备用。
取上述多糖3份加水溶解,分别加入不同比例除蛋白试剂(氯仿-正丁醇体积比分别为5:1、4:1、3:1),剧烈振摇10min,静置分层。除去交界处变性蛋白质,重复处理2次,得脱蛋白处理液,测定波长280nm处蛋白吸收峰,比较除蛋白效果,计算多糖提取率。
1.2.4 脱色条件优化
1.2.4.1 活性炭脱色条件优化
脱蛋白富贵菜多糖加入乙醇至其终体积分数为75%,静置过夜抽滤,按照无水乙醇→丙酮的顺序依次洗涤3遍,真空冷冻干燥。将上述多糖加适量水定容作为富贵菜多糖供试液。取活性炭适量溶解抽滤后,加水配制成不同质量浓度的悬浮液,作为活性炭试液。
1)取5份20mL富贵菜多糖供试液,分别加入10mL 0.1g/mL的活性炭试液,并不断振摇,使活性炭充分分散。分别于40、50、60、70、80℃水浴恒温30min,过滤,观察滤液脱色效果,计算多糖提取率。2)取4份20mL富贵菜多糖供试液,各加10mL 0.1g/mL的活性炭试液,摇匀后,8 0℃水浴中,分别恒温1 5、3 0、45、60min后,过滤,观察滤液脱色结果,计算多糖提取率。3)取4份20mL的富贵菜多糖供试液,各加10mL质量浓度分别为0.05、0.10、0.15g/mL和0.20g/mL的活性炭试液,80℃水浴恒温30min,过滤,观察滤液脱色结果,计算多糖提取率。4)取4份20mL的富贵菜多糖供试液,各加10mL 0.1g/mL的活性炭试液,80℃水浴恒温30min,过滤,滤液分别重复脱色操作0、1、2、3次,观察滤液脱色效果,计算多糖提取率。
1.2.4.2 双氧水脱色条件优化
取脱蛋白多糖加水溶解、定容,作为供试液。取双氧水配成50%的双氧水溶液,作为双氧水试液。
1)取10mL富贵菜多糖供试液5份,各加10mL双氧水试液,分别于50℃水浴中恒温1、1.5、2、2.5、3h,观察脱色效果,计算多糖提取率。2)取10mL富贵菜多糖供试液4份,各加多糖供试液体积30%、50%、70%、100%(即3、5、7、10mL)的双氧水试液,在50℃水浴中恒温2h,观察脱色效果,计算多糖提取率。3)取10mL的富贵菜多糖供试液5份,各加10mL 体积分数50%的双氧水试液分别在40、50、60、70、80℃恒温2h,观察脱色效果,计算多糖提取率。
2 结果与分析
2.1 单因素试验结果
2.1.1 不同温度对多糖提取率的影响

表2 不同温度对多糖提取率的影响Table 2 Effect of extraction temperature on polysaccharide yield
由表2可知,当提取温度为90℃时,提取率已达6.31%,与100℃的提取率差别不大。因此选取90℃为宜。确定正交试验的提取温度水平为80、90、100℃。2.1.2不同固液比对多糖提取率的影响

表3 不同固液比对多糖提取率的影响Table 3 Effect of solid/liquid ratio on polysaccharide yield
由表3可知,当固液比为1:9时,提取率达到最高为5.32%,且1:7、1:8的提取效果均好于1:10,所以确定正交试验的固液比水平为1:7、1:8、1:9。
2.1.3 不同提取时间对多糖提取率的影响

表4 不同提取时间对多糖提取率的影响Table 4 Effect of extraction time on polysaccharide yield
由表4可知,当提取时间为3.0h时,提取率为最高5.80%,所以确定正交试验的提取时间水平为2、3、3.5h。
2.1.4 不同提取次数对多糖提取率的影响

表5 不同提取次数对多糖提取率的影响Table 5 Effect of extraction times on polysaccharide yield
由表5可知,当提取次数为2次时,提取率为最高6.33%,所以确定正交试验的提取次数水平为1、2、3次。
2.2 正交试验结果

表6 L9(34)正交试验结果Table 6 Orthogonal array design matrix and corresponding experimental values of polysaccharide yield and purity

表7 方差分析Table 7 Variations analysis for polysaccharide yield with various extraction conditions
表6、7为富贵菜多糖提取正交试验结果数据及方差分析表。方差分析中,定偏差最小的C项为误差来源项。由表6、7可知:提取温度、提取次数、提取时间对所得多糖提取率影响较大。在加水浸泡后,固液比对多糖提取率影响较小。综合分析得提取最佳条件为A3B1C3D2,即提取温度温度100℃,固料比1:7,提取时间3.5h,提取次数2次时,提取效果较好。
2.3 脱蛋白条件优化结果
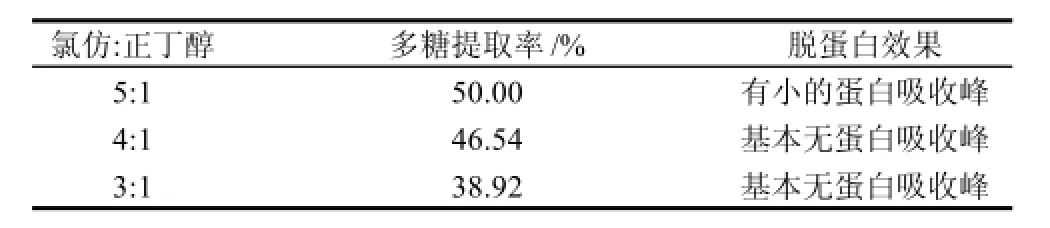
表8 氯仿-正丁醇比例对除蛋白效果的影响Table 8 Effect of chloroform/butanol volume ratio on protein removal
由表8可知,氯仿与正丁醇的体积比对于脱蛋白效果具有一定的影响,随着正丁醇比例的增高,脱蛋白效果也随之变佳(通过紫外图谱扫描作为依据),多糖得率降低。

图1 脱蛋白多糖紫外扫描图(氯仿:正丁醇=4:1)Fig.1 UV-Vis absorption spectrum of crude Gynura divaricata (L.) DC. polysaccharides after the removal of protein
由图1可知,在波长260~280nm处无蛋白吸收峰,表明脱蛋白完全。综合考虑氯仿:正丁醇体积比为4:1时脱蛋白效果最佳。
2.4 脱色效果
2.4.1 活性碳脱色
2.4.1.1 不同脱色温度的脱色效果

表9 脱色温度与多糖溶液的脱色效果Table 9 Effect of treatment temperature on color removal with activated carbon
由表9可知,随着脱色温度升高,多糖颜色明显改善,但多糖得率降低,综上选择80℃为最佳脱色温度。
2.4.1.2 不同脱色时间的脱色效果

表10 加热脱色时间与多糖溶液的脱色效果Table 10 Effect of heating time on color removal with activated carbon
由表10可知,随着时间延长,脱色效果变佳,但多糖提取率降低,综合考虑故选择脱色时间为45min。
2.4.1.3 不同活性炭溶液质量浓度的脱色效果
由表11可知,活性炭溶液质量浓度越大,脱色效果越好,多糖提取率降低,故选择活性炭溶液质量浓度为0.15g/mL为最佳。

表11 活性炭溶液质量浓度与多糖溶液的脱色效果Table 11 Effect of activated carbon concentration in aqueous suspension on color removal
2.4.1.4 不同脱色次数的脱色效果

表12 脱色次数与多糖溶液的脱色效果Table 12 Effect of treatment times on color removal with activated carbon
表12表明,粗多糖经活性炭脱色2次就基本脱色完全了,随着脱色次数的增加,多糖提取率明显降低,故选择脱色2次为佳。
2.4.2 双氧水脱色
2.4.2.1 不同脱色时间的脱色效果

表13 加热脱色时间与多糖溶液的脱色效果Table 13 Effect of heating time on color removal with hydrogen peroxide
表13表明,随着脱色时间的延长,脱色效果变好。2h后,脱色效果基本无明显变化,加热时间对多糖提取率影响不大,故选择2 h为宜。
2.4.2.2 不同双氧水加入量的脱色效果

表14 双氧水加入量与多糖溶液的脱色效果Table 14 Effect of hydrogen peroxide concentration on color removal
表14表明,双氧水试液加入量增多,脱色效果变好,多糖提取率无明显影响。从试剂成本角度考虑脱
色时加入多糖供试液体积70%的双氧水试液即可获得较好的脱色效果。
2.4.2.3 不同脱色温度的脱色效果

表15 脱色温度与多糖溶液的脱色效果Table 15 Effect of heating temperature on color removal with hydrogen peroxide
表1 5表明,温度增高,脱色效果变佳,多糖提取率无明显影响。60℃以后脱色效果变化不明显。
3 结 论
3.1 富贵菜多糖提取工艺优化
富贵菜多糖提取中,提取温度、提取次数是主要影响因素,其次是提取时间,固液比影响不显著。因此在提取时应注意控制提取温度和提取次数,富贵菜多糖提取拟采用100℃,固料比1:7,提取时间3.5h,提取次数2次时,所得多糖含量最高。该工艺条件简单,稳定可行,多糖提取率高,稳定性好,可作为该植物活性成分之一——总多糖的提取条件,为有效开发利用富贵菜提供方法学基础。
3.2 富贵菜多糖脱蛋白、脱色工艺优化
氯仿与正丁醇的比例影响脱蛋白效果,增加正丁醇比例,除蛋白效果提高,但多糖提取率降低。综合考虑除蛋白试剂最佳配比:氯仿:正丁醇体积为4:1。
活性碳脱色:温度升高、活性炭质量浓度增加,脱色次数增加,多糖脱色效果越好,但同时多糖提取率降低;随着加热时间延长,脱色效果变佳,但随着时间的延长,还原性多糖易被氧化。活性炭脱色最优条件:温度80℃、脱色45min、活性炭溶液质量浓度0.15g/mL、脱色2次。
双氧水脱色:双氧水加入量增多,温度增高,脱色时间延长,对多糖提取率无明显影响,脱色效果增加,但时间增加至2h,温度增加到60℃后脱色效果趋于稳定,温度进一步升高可能引起多糖链发生变化。双氧水脱色最优条件:加入多糖供试液体积70%的双氧水试液,60℃脱色2h。
3.3 富贵菜的开发利用
富贵菜适应性广,耐旱、耐寒 、抗病虫害,产量高,具有特殊香味,脆嫩可口。可经简单配制、浸制等手段加工成有独特风味传统食品或饮品,或配上其他药材经蒸煮、打浆、酶处理、均质等工艺流程加工制成能促进人体新陈代谢、增强体力、滋补强身、延年益寿的营养液饮料;尤其是利用现代分离分析技术,如本实验的研究方法,将富贵菜中的生理活性成分提取后作原料或添加剂,用于各种药品和食品中,可提高科技含量,增加综合利用价值。
[1]广东植物研究所. 海南植物志[M]. 北京: 科技出版社, 1974: 416-417.
[2]梁萍. 时尚野菜: 富贵菜高产栽培技术[J]. 广西农学报, 2006, 23(3): 27-28.
[3]胡勇, 李维林, 林厚文. 白背三七地上部分降血糖作用研究[J]. 西南林学院学报, 2007, 27(1): 55-58.
[4]姜曼花, 胡剑卓, 邱细敏, 等. 白背三七多糖和黄酮降血糖及耐缺氧作用[J]. 中国医院药学杂志, 2009, 29(13): 1074-1076.
[5]陈德春, 刘红昌, 杨文钰. 四川地区富贵菜栽培技术[J]. 长江蔬菜, 2005(1): 19-20.
[6]ROEDER E, ECKERT A, WIEDENFELD H. Pyrrolizidine alkaloids from Gynuradivaricata[J]. Planta Medica, 1996, 62(4): 386-389.
[7]黄骐, 林荣华, 郑钊. 白子菜总黄酮含量的测定[J]. 福建师范大学学报: 自然科学版, 2006, 22(2): 118-120.
[8]胡勇, 李维林, 林厚文. 白背三七地上部分的化学成分[J]. 中国天然药物, 2006, 4(2): 156-158.
[9]郭巨先, 杨暹. 华南主要野生蔬菜的脂肪酸成分分析[J]. 中国野生植物资源, 2004, 23(2): 47-50.
[10]谭敏, 邱细敏, 陆艳艳, 等. 植物多糖分析方法综述[J]. 食品科学, 2009, 30(21): 420-423.
Extraction and Purification of Polysaccharides from Gynura divaricata (L.) DC.
QIU Xi-min1,JIANG Man-hua1,TAN Min1,LU Yan-yan1,YANG Xiao-hong1,FENG Xing1,LI Li-li2
(1.The Medical College, Hunan Normal University, Changsha 410008, China;2. Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125, China)
The extraction yield of Gynura divaricata (L.) DC. polysaccharides affected by extraction temperature, time and times and solid/liquid ratio was optimized by single factor and orthogonal array design methods. In addition, the removals of protein by the Sevag method and of color with hydrogen peroxide or activated carbon from the crude polysaccharide extract obtained were investigated. The anthranone-sulphuric acid method was used for polysaccharide determination. Result showed that a maximum polysaccharide yield was achieved through the optimal twice extraction for 3.5 h each time at 100 ℃ at 1:7 solid/ liquid ratio (g/mL). The optimal solvent for the removal of protein was a mixture of chloroform and n-butanol (4:1, V/V). The addition of 0.15 g/mL activated carbon aqueous suspension for twice treatment for 45 min at 80 ℃ or the addition of 70% (V/V) hydrogen peroxide for 120 min treatment at 60 ℃ gave an optimal removal of color. The procedure proved to be simple, feasible, effective and stable so as to be most suitable for the extraction and purification of polysaccharide from Gynura divaricata (L.) DC..
Gynura divaricata (L.) DC.;polysaccharide;extraction and purification;determination
Q539
A
1002-6630(2010)10-0117-05
2009-07-04
湖南省自然科学基金项目(08jj3024);长沙市科技管理局项目(K069062-12);湖南省医药卫生科研资助项目(B2007119)
邱细敏(1954—),女,教授,本科,主要从事植物多糖分离分析研究。E-mail:qiuximin@tom.com
