化学发光酶免疫分析法检测食品中赭曲霉毒素
2010-03-24邱云青李凤琴
邱云青,王 伟,李凤琴*
(中国疾病预防控制中心营养与食品安全所,北京 100021)
化学发光酶免疫分析法检测食品中赭曲霉毒素
邱云青,王 伟,李凤琴*
(中国疾病预防控制中心营养与食品安全所,北京 100021)
目的:建立检测食品中赭曲霉毒素(OA)快速灵敏化学发光酶免疫方法。方法:采用棋盘滴定法确定OABSA抗原的包被质量浓度、包被量以及一抗和二抗的工作稀释度,建立间接竞争抑制曲线,确定线性范围、检出限和回收率。结果:确定的检测工作条件为:OA-BSA最佳包被质量浓度60ng/mL,抗OA单克隆抗体的最佳工作稀释度1:400,校正曲线线性范围6~400ng/mL,赭曲霉毒素的检出限为0.02ng/mL,50%抑制质量浓度145ng/mL,在100~2000ng/g添加水平的回收率范围为83.6%~105.8%。用所建方法对质控样品进行了分析,检测结果符合率达到100%。结论:所建方法准确、灵敏,适用于食品中OA的筛选。
赭曲霉毒素;化学发光酶免疫分析;检测
赭曲霉毒素(ochratoxin A,OA)是由曲霉属和青霉属的某些种产生,以污染小麦、玉米、大麦、燕麦、黑麦、大米和咖啡等农作物为主的一种无色结晶化合物。可溶于极性有机溶剂和稀碳酸氢钠溶液,微溶于水,对热稳定。动物摄入受OA污染的饲料后可引起急慢性中毒。OA主要侵害动物肝脏与肾脏,引起肝脏、肾脏损伤,大剂量时可引起动物的肠黏膜炎症和坏死。此外,OA还具有致畸作用[1]。
目前检测粮食和食品中OA的方法有薄层色谱法(TLC)[2]、液相色谱法(LC)[3-5]、酶联免疫吸附测定法(ELISA)[6]、液相色谱-质谱联机(LC-MS-MS)[7]等。上述方法虽都有一定优点,但尚存在不足。仪器法虽准确,但技术要求较高、所需仪器设备昂贵、样品前处理繁琐且对净化结果的要求较高、不适应于现场检测。普通ELISA法所需分析时间长,灵敏度不能满足痕量检测的要求,由此限制了方法的普及推广[8]。而近几年新发展的以发光氨(鲁米诺)-过氧化氢-增强剂为基质的辣根过氧化物酶(horseradish peroxidase,HRP)系统[9-10]为代表的化学发光酶免疫分析法(chemiluminescent immunoassay,CLIA)是免疫检测方法中最灵敏的代表,是近十年来发展迅速的非放射性免疫分析,具有高通量检测、灵敏度高、检测范围宽、分析速度快、价廉经济等优点,是免疫分析的重要发展方向,并被逐渐引入食品安全领域有毒有害物质的检测[11-12],与HPLC检测结果相比差异无显著性,但灵敏度比普通ELISA方法提高20倍[13]。本实验旨在建立一种CLIA检测食品中OA的灵敏方法。
1 材料与方法
1.1 试剂
OA标准品、OA-BSA偶联物、牛血清白蛋白(bovine serum albumin,BSA)、辣根过氧化物酶(HRP)标记羊抗鼠IgG 美国Sigma公司;小鼠抗OA单克隆抗体(本所自制);CL发光底物增强系统(鲁米诺-过氧化氢-增强剂) Pierce公司; 磷酸氢二钠、磷酸二氢钠、磷酸二氢钾、氯化钾、氯化钠、氢氧化钠、无水碳酸钠、碳酸氢钠(以上试剂均为化学纯)、甲醇(色谱纯)北京化工厂。
1.2 仪器与设备
1507520型化学发光分析仪 美国Thermo Scientific公司;BS110S型电子分析天平(感量0.001g) 北京赛多利斯科学仪器有限公司;微量可调移液器(量程1μL~1000mL) Eppendorf公司;96孔不透明聚苯乙烯微孔板美国Thermo公司;LTI-601SD型恒温振荡培养箱 日本Sanyo公司;Allegra X-22R型离心机 美国Sigma公司;OA-SYSTMheating system氮吹仪 美国Organomation公司。
1.3 方法
1.3.1 溶液系统的配制
0.01mol/L pH7.4的磷酸盐缓冲液(PBS);包被缓冲液:0.05mol/L pH9.6的碳酸钠-碳酸氢钠缓冲溶液;封闭液:含2g/100mL BSA pH7.4的0.01mol/L PBS;抗体稀释液:含0.1g/100mL BSA pH7.4的0.01mol/L PBS;抗原稀释液:20%甲醇-PBS(pH7.4,0.01mol/L)(V/V);洗液:含0.05%(V/V)吐温-20的PBS。
OA标准溶液:将OA标准粉末溶于甲醇溶液中,配成1.0mg/mL标准储备液,检测时,用抗原稀释液将该标准储备液稀释至所需质量浓度,4℃保存。CLIA标准曲线使用的标准溶液是将上述OA标准储备液稀释成800、400、200、100、20、2、0.2ng/mL标准工作液,工作液现用现配。
1.3.2CLIA检测OA工作条件的确定
1.3.2.1OA-BSA抗体偶联物最佳包被量确定
经过多次实验,微孔板的包被量确定为100μL/孔。
1.3.2.2OA-BSA抗体偶联物最佳包被质量浓度及抗体最佳工作稀释度的确定
采用棋盘滴定法确定包被抗原、抗体的最佳工作质量浓度。将OA-BSA抗原偶联物用0.1mol/L碳酸盐 (pH9.6)缓冲液稀释成质量浓度分别为50、60、70、80ng/mL的溶液包被酶标板,100μL/孔,每个质量浓度包被1列。于4℃孵育过夜,次日用含0.05%吐温-20的PBS洗涤3× 3min次后, 每孔加入含2g/100mL BSA的PBS封闭液120μL/孔,37℃封闭1h后,加入梯度稀释的抗OA抗体(1:50、1:100、1:200、1:400及1:800),50μL/孔,37℃反应2 h后, 洗涤4次。加入l:10000 HRP标记羊抗鼠IgG,50μL/孔,37℃反应 1h后加入CLIA发光底物增强系统,发光2min测定其发光强度。按照优选法实验设计组合配比,选择发光最大值所对应的最低包被抗原、最大抗体稀释度作为判定标准,优选出OA-BSA最佳包被质量浓度(60ng/mL)和抗OA抗体的最佳工作稀释度为1:400。
1.3.2.3 辣根过氧化物酶(HRP)标记羊抗鼠IgG工作效价的确定
用OA-BSA抗体偶联物(60ng/mL)包被酶标板,100μL/孔,每个质量浓度包被1列。于4℃孵育过夜,次日用洗液洗涤3×3min次后,每孔加入2g/100mL BSA封闭液120μL,37℃封闭1h。加入抗OA抗体(稀释度为1:400),50μL/孔,37℃反应2h后,洗涤4次。加入梯度稀释(1:10000、1:15000、1:20000、1:25000及1:30000,V/V) HRP标记的羊抗鼠IgG,50μL/孔,37℃反应1h,洗涤4次后加入发光底物并测定其发光强度。
1.3.2.4 标准曲线
酶标板经OA-BSA偶联物包被、封闭后,加入抗原抗体反应液(25μL OA标准工作液+25μL 1:200的抗OA抗体),50μL/孔,同时设阴性对照(25μL抗OA抗体+25μL抗原稀释液)50μL/孔,37℃反应2h后, 洗涤4次。加入l:10000 HRP标记羊抗鼠IgG,50μL/孔,37℃反应1h,经洗涤4次后加入发光底物,测定其发光强度。以发光强度(B)与阴性对照发光强度(B0)比值(B/B0)为纵坐标,以OA标准溶液浓度的常用对数值为横坐标作图绘制标准曲线。
1.3.2.5 检出限(LOD)和检测范围
根据国际纯粹与应用化学联合会、国际标准协会和美国官方分析化学家协会的协调准则,用标准曲线插入法计算OA的LOD。即将6个阴性对照发光强度(B0)均值所对应的被测物质量浓度减去其标准差(s)3倍的值,即为LOD,同时根据曲线线性区间确定线性范围。
1.3.3CLIA检测OA方法的建立
1.3.3.1 样品提取
样品粉碎后过250~500μm网筛。称取5g至100mL具塞三角烧瓶中,加入20mL乙腈-水溶液(84:16,V/V),强力振荡3min后过滤,取4mL滤液,氮气吹干,残渣用20%甲醇-PBS溶解后进行检测。
1.3.3.2 测定
用质量浓度60ng/mL OA-BSA偶联物包被酶标板,100μL/孔、4℃孵育过夜,次日用 0.05%吐温-20洗涤3min(重复3次),每孔再加2g/100mL BSA封闭液120μL/孔,37℃封闭1h。然后加入抗原抗体反应液(25μL OA样品提取液+25μL抗OA抗体(1:200,V/V)),50μL/孔,同时设阴性对照(25μL抗OA抗体+25μL抗原稀释液),50μL/孔,37℃反应2h后,洗涤4次。加入l:10000 HRP标记羊抗鼠IgG,50μL/孔,37℃反应1h,洗涤4次后加入发光底物,测定其发光强度。
1.3.3.3 计算
样品中OA含量按以下公式用标准曲线插入法计算。曲线纵坐标为待测物发光强度(B)与阴性对照发光强度(B0)之比,横坐标为待测物中OA含量的常用对数值。
Y=aX+b
式中:Y=B/B0;X为待测物中OA含量/(ng/mL)的对数值;a为斜率;b为截距。
OA含量/(μg/kg)=C×D×X/(S×W)
式中:C为酶标板上测得的OA含量/ng,根据标准曲线插入法求得;D为样品提取液的体积/mL;X为样品提取液的稀释倍数;S为酶标板上每孔加入的样液体积/mL;W为样品质量/g。
1.3.4 方法回收率
分别将一定质量浓度的OA标准溶液加到5g粉碎后经仪器法证明不含OA的玉米中,使其添加量分别为100、200、500、2000ng/g,按前述方法提取后进行检测。
1.3.5 日内与日间精密度的测定
将一定质量浓度的OA标准溶液加到5g粉碎后玉米中,使其添加量为100ng/g,按前述方法提取后进行检测,在同一天不同时间点以及不同天对同一样品在相同条件下作重复提取后测定(至少3次)。
1.3.6CLIA检测真菌毒素验证方法检测质控样品
用本实验建立的CLIA法检测质控样品(FAPAS玉米粉末样品,其中的OA含量范围为31~58ng/mL)中的OA含量,具体操作方法同上。
2 结果与分析
2.1CLIA最佳工作条件的确定
2.1.1OA -BSA包被质量浓度和抗OA抗体的稀释度
经过多次实验,微孔板的包被量确定为100μL/孔。结果如图1所示。由图1可见,发光强度随抗体稀释度增加而下降,曲线拐点位于抗OA抗体稀释度为1:400、包被质量浓度60ng/mL处,从而确定抗原偶联物最佳包被质量浓度60ng/mL,抗赭曲霉毒素单克隆抗体的最佳工作稀释度为1:400。

图1 OA-BSA偶联物最佳包被质量浓度和抗OA抗体最佳工作稀释度筛选Fig.1 Screening of the optimal OA-BSA conjugate concentration and the optimal working dilution of anti-OA antibody
2.1.2HRP标记羊抗鼠IgG工作效价的确定
经过多次实验,HRP标记羊抗鼠IgG的工作效价为1:10000。
2.1.3 标准曲线、检测限和检测范围
经实验,CLIA检测OA标准曲线的线性方程为Y= -0.234x+1.006,LOD为0.02ng/mL(换算成样品中的OA含量为0.4ng/g),检测线性范围为6~400ng/mL,50%抑制质量浓度为145ng/mL。
2.1.4 方法回收率
当添加到玉米中的OA添加量分别为100、200、500、2000ng/g时,方法的回收率见表1。

表1 玉米样品中OA的回收率实验(n=5)Table 1 Recovery experiments of OA in corn samples (n=5)
2.1.5 日内精密度和日间精密度
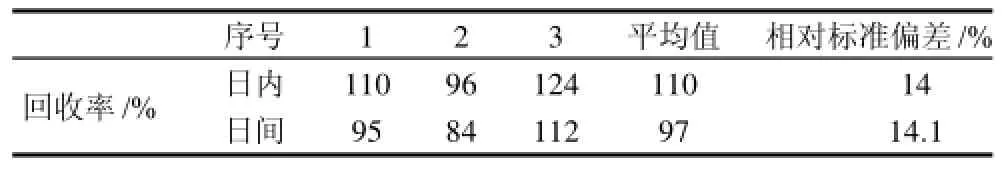
表2 OA在100ng/g加标水平的日内和日间精密度Table 2 Precision assay of OA with the spiked sample level of 100 ng/g
由表2可见,相对标准偏差小于15%,说明精密度良好。
2.2 样品分析
本研究建立的CLIA法分析FAPAS玉米质控样品(OA含量31~58ng/g),在不同日共测5次,结果见表3。由表3可知,检测结果符合率为100%。

表3 CLIA法检测玉米质控样品中OA的结果Table 3 Results of CRM detection in corn samples using the CLIA method
3 结论与讨论
本实验建立了OA的免疫化学发光检测法,检测限为0.02ng/mL(换算成样品中的OA含量为0.4ng/g),检测线性范围为6~400ng/mL, 50%抑制质量浓度为145ng/mL,完全可以满足现场快速、大批量检测的需求。
在100、200、500、2000ng/g添加水平的加标回收率范围为83.6%~105.8%。对质控玉米样品的检测结果显示,CLIA法检测结果的重现性较高。国内熊勇华等[14]建立的ELISA法检测OA的检测限为1ng/mL,刘仁荣等[15]建立单克隆抗体竞争ELISA法检测OA的检测限为0.15ng/mL,均高于本实验所建方法的检测限(0.02ng/mL)。因此本实验建立检测OA的CLIA法其灵敏度高于传统的ELISA法,而精确度和准确性均能满足实际工作需要,且与ELISA法相比检测时间缩短,使用试剂量更少,适用于食品中OA的分析。
实验发现,由于灵敏度较高,检测时发光强度受实验操作中各环节因素的影响较大,故本方法对实验操作人员的操作技术有较高要求。总之,由于CLIA法操作更简便,提取样品不需要复杂的净化过程,节省了时间和实验材料,而且实际工作中可使用384孔微孔板,一次实验即可检测大量样本,且检测过程可利用常规设备实现自动化,非常适用于大面积筛选。
[1]高翔, 李梅. 赭曲霉毒素A的毒性研究进展[J]. 国外医学: 卫生学分册, 2005, 32(1): 51-55.
[2]GHALI R, HMAISSIA-KHLIFA K, GHORBEL H, et al. HPLC determination of ochratoxin A in high consumption Tunisian foods[J]. Food Control, 2009, 20(8): 716-720.
[3]刘玉芳, 庄新华, 李学云, 等. 高效液相色谱法测定谷物及其制品中赭曲霉毒素A[J]. 食品科学, 2009, 30(14): 322.
[4]杨超, 林洪, 张辉珍, 等. 免疫亲和柱净化高效液相色谱检测啤酒中赭曲霉毒素A[J]. 分析与检测, 2007, 33(12): 127-129.
[5]MONACI L, PALMISANO F, MATRELLA R, et al. Determination of ochratoxin A at part-per-trillion level in Italian salami by immunoaffinity clean-up and high-performance liquid chromatography with fluorescence detection[J]. Journal of Chromatography A, 2005, 1090(12): 184-187.
[6]时瑾, 黄飚, 孙蔚榕, 等. ELISA法检测赭曲霉毒素A的改进研究[J]. 分析检测, 2007, 28(8): 425-428.
[7]阎龙宝, 王浩. 液相色谱-质谱联用技术测定葡萄酒中的赭曲霉毒素A残留[J]. 食品研究与开发, 2010, 31(6): 136-138.
[8]李琦, 王东琳, 张赟, 等. ECLIA 法与传统ELISA法检测TNF-α比较[J]. 标记免疫分析与临床, 2007, 14(3): 181-182.
[9]尹东光, 贺佑年, 刘兵, 等. 几种主要化学发光物质的发光性能及基础化学发光免疫分析体系[J]. 标记免疫分析与临床, 2002, 9(4): 225-230.
[10]邵晓东, 李瑛. 鲁米诺化学发光分析法研究进展[J]. 化学研究, 2010, 21(1): 102-112.
[11]刘晓宇, 刘作满, 李爱芳. 化学发光法测定水和食品中痕量亚硝酸根[J]. 农产品加工: 学刊, 2007(7): 74-77.
[12]李爱芳, 刘晓宇. 化学发光法测定小西红柿中的倍硫磷[J]. 分析检测, 2007, 28(6): 281-284.
[13]RIVERA V R, GAMEZ F J, KEENER W K, et al. Rapid detedtion of Clostridmatrices, and buffer using paramagnetic bead-based elecltrochemiluminescence detection[J]. Anal Biochem, 2006, 353(2): 248-256.
[14]熊勇华, 陈雪岚, 许杨. 检测赭曲霉毒素A(OTA)的酶联免疫吸附法(ELISA)体系的建立[J]. 食品科学, 2006, 27(5): 30-35.
[15]刘仁荣, 余宙, 何庆华, 等. 以赭曲霉毒素A单克隆抗体竞争酶联免疫吸附分析方法的研究[J]. 食品科学, 2005, 26(11): 174-176.
Detection of Ochratoxin A in Food by Chemiluminescent Immunoassay
QIU Yun-qing,WANG Wei,LI Feng-qin*
(National Institute of Nutrition and Food Safety, Chinese Center for Disease Control and Prevention, Beijing 100021, China)
Objective: To establish a sensitive, specific and rapid chemiluminescent immunoassay (CLIA) method for the detection of ochratoxin A (OA) in food. Methods: The optimal conditions of CLIA for OA detection including the concentration of OA-bovine serum albumin (BSA) conjugate, the volume of OA-BSA solution for immobilization, the working concentrations of both antibodies against OA and a horseradish peroxidase-labeled anti-antibody, were explored by chessboard titration experiments. The linear range and the limit of detection (LOD) were studied as well. Certified reference material (CRM) of corn samples containing OA obtained from Food Analysis Performance Assessment Scheme (FAPAS) were analyzed by the developed CLIA method. Results: The optimal CLIA conditions for OA detection were 0.06μg/mL coating concentration of OA-BSA, 100μL/well of coating volume and 1:400 of working titer of the antibody against OA. The linear range of the developed CLIA was 6-400 ng/mL. The half inhibitory concentration was 145 ng/mL and the LOD was 0.04μg/kg for OA in food samples. The recovery rate was in the range of 66%-124% with the spiked sample level of 0.1-2μg/kg. CRM corn samples were analyzed and the results were consistent with the real values. Conclusion: The developed CLIA method was simple, fast, sensitive and can be employed in the screening of OA in foods.
ochratoxin A(OA);chemiluminescent immunoassay (CLIA);detection
Q814
A
1002-6630(2010)24-0433-04
2010-10-12
国家“863”计划项目(2007AA10Z423)
邱云青(1973—),女,博士研究生,研究方向为生物毒素分析与控制。E-mail:dawndew@163.com
*通信作者:李凤琴(1963—),女,研究员,博士,研究方向为食品微生物。E-mail:lifengqin0224@gmail.com
