双抗夹心ELISA方法检测食品中单核细胞增生李斯特氏菌
2010-03-24黄岭芳赖卫华
段 霞,黄 欣,黄岭芳,魏 华,赖卫华,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌市西湖区疾病预防控制中心,江西 南昌 330025)
双抗夹心ELISA方法检测食品中单核细胞增生李斯特氏菌
段 霞1,黄 欣2,黄岭芳1,魏 华1,赖卫华1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌市西湖区疾病预防控制中心,江西 南昌 330025)
采用0.5%福尔马林灭活的单核细胞增生李斯特氏菌作为免疫原免疫日本大耳兔,获得抗单核细胞增生李斯特氏菌多克隆抗体,并以此多克隆抗体作为捕获抗体,以抗单核细胞增生李斯特氏菌Internalin A(InlA)单克隆抗体作为检测抗体,建立快速、特异的检测该菌的双抗夹心ELISA方法。结果表明:该方法对单核细胞增生李斯特氏菌纯培养液的最低检测量为1.7×105CFU/mL。在检测食品样品的实验中,食品样本对本方法干扰较小,运用选择性增菌液进行前增菌可提高该方法的准确性。
单核细胞增生李斯特氏菌;多克隆抗体;单克隆抗体;双抗夹心ELISA方法
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM)是李斯特氏菌属(Listeria)中唯一能引起食物中毒的菌。该菌为革兰氏阳性短杆菌,无芽孢和荚膜,有鞭毛,需氧或兼性厌氧菌[1-2]。该菌可在比较极端的条件下生长,例如生长温度范围-1.5~50℃、pH4.3~9.6,可耐受较高盐浓度。LM同时可以耐受低温和低水分的特性,导致了其在食品中的广泛传播。感染LM可引起单核细胞增多、脑膜炎、败血症和流产。孕妇、新生儿、老年人和免疫缺陷病人[3-4]为易感人群。食源性李斯特氏菌发病率虽不高,但死亡率有时可达20%~50%,对食品安全及人类健康造成了极大的威胁。
LM在2000年已被世界卫生组织(WHO)食品安全工作计划列为重点检测的食源性致病菌之一。1999年底美国密歇根州和2008年8月加拿大均因LM污染肉类食品而导致了严重的集体食物中毒事件。欧洲地区仅2006年LM感染确诊病例就达1583例[5]。在我国尚未有LM引起大规模食物中毒的报道,但食品中LM污染情况还是较为严重。傅宜方等[6]对广州市市售的112份熟肉制品样品进行LM检测,LM检出率高达8.04%;龙岩市[7]、江门市[8]、马鞍山市[9]等城市的食品也受到不同程度的LM污染。因此建立灵敏且特异性高的检测方法用于食品中该菌的检测尤为重要。
ELISA方法是一种敏感性高、特异性强、重复性好的实验诊断方法。将抗原、抗体免疫反应的特异性和酶的高效催化作用原理有机地结合起来,可敏感地检测样品中微量的特异性抗原。本研究拟建立检测LM双抗夹心ELISA方法,并对该方法进行灵敏度和特异性评价。
1 材料与方法
1.1 材料与试剂
单核细胞增生李斯特氏菌CMCC 54007(Listeria monocytogenes CMCC 54007) 中国医学细菌保藏管理中心;单核细胞增生李斯特氏菌CMCC 54001(Listeria monocytogenes CMCC 54001)、绵羊李斯特氏菌 1.1476 (Listeria ivanovii 1.1476)、大肠埃希氏菌O157:H7 CMCC 44828(Escherichia coli O157:H7 CMCC 44828)、大肠埃希氏菌CMCC 44496(Escherichia coli CMCC 44496)、大肠埃希氏菌CMCC 44350(Escherichia coli CMCC 44350)、大肠埃希氏菌CMCC 44102(Escherichia coli CMCC 44102)、大肠埃希氏菌2DBE2001(Escherichia coli 2DBE2001)、金黄色葡萄球菌CMCC 26001(Staphylococcus aureus CMCC 26001)、金黄色葡萄球菌CMCC 26002(Staphylococcus aureus CMCC 26002)、金黄色葡萄球菌CMCC 26003 (Staphylococcus aureus CMCC 26003)、阪崎肠杆菌CMCC 45401(Enterobacter sakazakii CMCC 45401)、阪崎肠杆菌CMCC 45402(Enterobacter sakazakii CMCC 45402)、鼠伤寒沙门氏菌 ATCC13311(Salmonella typhimurium ATCC 13311)、福氏志贺氏菌2457(Shigella flexneri 2457)、福氏志贺氏菌301(Shigella flexneri 301)、藤黄微球菌 CMCC 28003(Micrococcus luteus CMCC 28003)、白色假丝酵母Z1(Candida albicans Z1)、枯草芽孢杆菌168(Bacillus subtilis 168)、枯草芽孢杆菌BD366(Bacillus subtilis BD366)、副溶血弧菌CGMCC 1.1997(Vibrio parahemolyticus CGMCC 1.1997)、副溶血弧菌CGMCC 1.1616(Vibrio parahemolyticus CGMCC 1.1616)均为本实验室保存。
LB肉汤培养基 杭州百思生物技术有限公司;BLEB增菌肉汤 北京陆桥技术有限公司;Tween-20 天津永大化学试剂开发中心;辣根过氧化物酶标记的羊抗鼠IgG、羊抗兔IgG Sigma公司;TMB显色液 北京科卫临床诊断试剂有限公司。
1.2 仪器与设备
DNM-9602型酶标分析仪 北京朗普新技术有限公司;BHC-1300ⅡA/B3型生物安全柜 苏州苏净集团安泰公司;ZDP-A2160型电热恒温箱、2HWY-21029型恒温培养振荡器 上海智诚分析仪器制造有限公司。
1.3 方法
1.3.1 免疫抗原及检测菌液的制备
将甘油管保存的菌株LM CMCC 54007(LM 54007)复苏后,转接于200mL LB中,37℃振荡培养20h,4300 r/min离心收集菌体,0.01mol/L、pH7.4的磷酸盐缓冲液(PBS)洗涤两次后加入含0.5%福尔马林的PBS 30mL[10],室温作用24h灭活菌体,然后离心收集菌体,PBS洗涤两次后重悬,分装-20℃保存备用。
1.3.2 抗LM多克隆抗体的制备
雌性日本大耳兔(2.0kg左右)2只,进行皮下多点免疫,免疫原体积为0.5mL/只。首次免疫抗原量约为2× 109CFU/只。之后进行4次追加免疫,免疫周期为两周,免疫量为4×109~3.2×1010CFU/只[11]。每次免疫前和免疫1周后耳缘静脉采血,间接ELISA方法测定效价[12-13],效价达到105后停止免疫,并在最后一次免疫1周后股动脉采血。获得的抗血清采用辛酸-硫酸铵法纯化[14],测定纯化后的抗血清的效价。
1.3.3 双抗夹心ELISA方法的建立
以纯化后的多克隆抗体作为捕获抗体,以本实验室已经制备的抗LM Internalin A单克隆抗体3R6[15]为检测抗体,建立双抗夹心ELISA方法[16-17]。具体步骤如下:

抗体、抗原和BSA稀释液均为0.01mol/L、pH7.4 PBS。洗板液为含0.1% Tween-20的0.01 mol/L、pH7.4 PBS(PBST)。结果判定:以(测定孔OD值-空白对照孔OD值)/(阴性对照孔OD值-空白对照孔OD值)≥2.1(即P/N≥2.1)时判断为阳性。
1.3.4 棋盘滴定法确定多克隆抗体和单克隆抗体工作浓度
本实验采用棋盘滴定法确定双抗夹心ELISA方法中多克隆抗体和单克隆抗体适宜的工作浓度。多克隆抗体作为捕获抗体从5000倍倍比稀释至3.2×105倍。单克隆抗体作为检测抗体从400倍倍比稀释至12800倍。同时阴性血清也由400倍稀释至12800倍作为阴性对照,每个多克隆抗体的稀释度都用PBS作为空白对照[18]。ELISA操作步骤同1.3.3节。
1.3.5 双抗夹心ELISA方法灵敏度和特异性的判断
将37℃振荡培养20h的LM 54007纯培养液,平板计数后经系列稀释后作为待检菌液加入双抗夹心ELISA体系中,检测该方法的灵敏度;用LM 54007和绵羊李斯特氏菌、E.coli O157:H7 44828、福氏志贺氏菌301、金黄色葡萄球菌 26003、阪崎肠杆菌 45401等实验室保存21株菌株的新鲜纯培养液检测双抗夹心方法的特异性。检测菌液的菌浓度均为1.0×108CFU/mL。
1.3.6 食品样本检测实验
本实验选取市售消毒牛奶、生菜、牛肉、果汁接种目的菌(LM 54007)和非目的菌(金黄色葡萄球菌26003、鼠伤寒沙门氏菌13311、福氏志贺氏菌301、E.coli O157: H7 44828和阪崎肠杆菌45401)。经过前增菌后,作为检测菌液加入本检测系统,以检测食品样品对于本系统的敏感性和准确性的影响。
目的菌的准备:LM 54007用LB培养基,37℃振荡培养20h后,用生理盐水稀释105倍。非目的菌的准备:金黄色葡萄球菌26003、鼠伤寒沙门氏菌13311、福氏志贺氏菌301、E.coli O157:H7 44828和阪崎肠杆菌45401用LB培养,37℃振荡培养8h后,用生理盐水稀释105倍。同时对这6株菌培养液进行活菌计数。之后,目的菌和5株非目的菌各取1mL混合,标记为A菌液。另外将5株非目的菌各取1mL混合,标记为B菌液。
食品样本的处理:将市售牛肉样本研磨成肉糜,每份25g,共4份。称取50g生菜,加入50mL PBS榨汁,每份25mL,共4份。对于消毒牛奶和果汁分别取4份,每份25mL。
每种食品样本做4组实验,分别为BLEB增菌液添加A菌液组、BLEB增菌液添加B菌液组和LB增菌液添加A菌液组、LB增菌液添加A菌液组。首先取220mL增菌液、25g(25mL)样品(样品液)和5mL菌液,混匀后进行增菌。BLEB增菌液实验组在30℃预增菌4h,之后向增菌液中加入配套选择性试剂(吖啶黄、萘啶酮酸、放线菌酮)后30℃继续培养[19]。LB增菌液实验组在37℃培养。分别在增菌16h和24h,取增菌液进行双抗夹心ELISA实验。同时各增菌液经系列稀释后涂布于OXA琼脂平板(LM典型菌落在平板上呈现黑色并带有黑色晕圈),37℃培养24h后观察结果,以判定双抗夹心ELISA方法的准确性。
2 结果与分析
2.1 多克隆抗体效价
经饱和辛酸-硫酸铵法纯化的多克隆抗体,用间接ELISA方法测定其效价。由图1可知多克隆抗体的效价约为3.2×105。
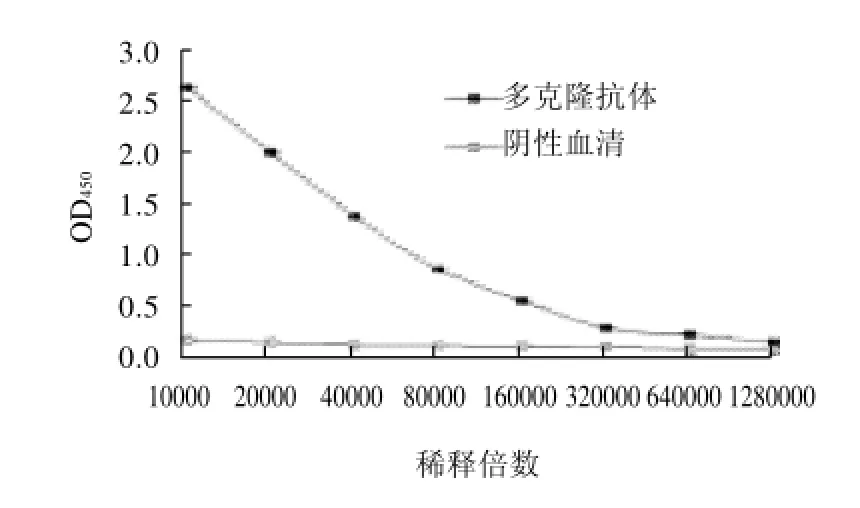
图1 多克隆抗体效价曲线Fig.1 Titer cure of polyclonal antibody
2.2 多克隆抗体和单克隆抗体工作浓度的确定

表1 棋盘滴定法确定多克隆抗体和单克隆抗体稀释倍数Table 1 Determination of poly- and mono-clonal antibody working concentration by chessboard titration

表2 双抗夹心ELISA检测灵敏度实验结果Table 2 Sensitivity of double-antibody sandwich ELISA
由表1可以看出,当多克隆抗体抗体稀释10000倍作为捕获抗体时,单克隆抗体稀释800倍和1600倍的OD450值均在1.0左右,稀释800倍的P/N值较稀释1600倍大,因此选择多克隆抗体稀释10000倍,单克隆抗体稀释800倍为最终工作浓度。
2.3 双抗夹心ELISA方法的灵敏度
经过平板计数,新鲜LM 54007纯培养液的菌浓度约为3.4×108CFU/mL。LM 54007纯培养液经梯度稀释后作为检测菌液测定本方法的灵敏度。如表2所示,本方法的检测限约为1.7×105CFU/mL。
2.4 双抗夹心ELISA方法的特异性
用LM 54007和实验保存的LM 54001等21株菌检测双抗夹心ELISA法的特异性。结果显示,本方法与LM 54001有强烈的交叉反应,说明本方法可以检测到不同血清型的LM。与绵羊李斯特氏菌、金黄色葡萄球菌26003和阪崎肠杆菌45401有轻微的交叉反应。其余的17株菌均无交叉反应。

表3 双抗夹心ELISA方法特异性实验结果Table 3 Specificity of double-antibody sandwich ELISA
2.5 食品样本检测实验
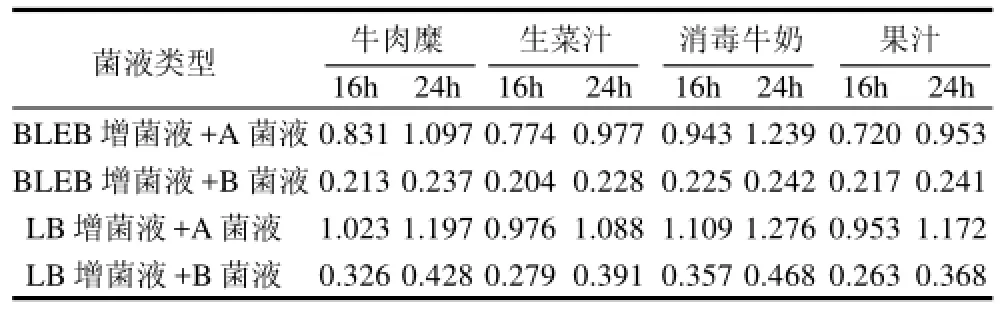
表4 双抗夹心ELISA方法特异性检测食品样本实验结果Table 4 Detection of Listeria monocytogenes in food samples by double-antibody sandwich ELISA
通过平板计数,可推断出最终接种于增菌液中的目的菌LM 54007的浓度约为10CFU/mL。用双抗夹心ELISA方法检测在不同增菌条件下的增菌液,通过测定OD值进行判定。最终结果显示添加有目的菌的BLEB增菌液和LB增菌液在增菌16h时就完全可以到达检测限,检测结果为强阳性。没有添加目的菌的BLEB增菌液,结果判定为阴性。4种食品样本用无选择性的LB增菌液增菌后的OD值均比选择性BLEB增菌液的略高。BLEB增菌液组的ELISA结果与OXA平板计数结果均一致,而没有添加目的菌的LB增菌液ELISA结果与平板计数结果对比后,存在假阳性结果。
3 讨 论
本实验以福尔马林灭活的LM 54007免疫日本大耳兔,获得了抗LM 54007的多克隆抗体。多克隆抗体经辛酸-硫酸铵法纯化后的效价可达3.2×105。以此多克隆抗体作为捕获抗体,以实验室已制备的抗LM Internalin A单克隆抗体作为检测抗体,建立了双抗夹心ELISA方法。该方法对于LM 54007纯培养液的检测限约为1.7×105CFU/mL,可以和另一株不同血清型的LM有强烈的交叉反应。
实际食品样本中LM的存在量往往较少,无法达到检测限的要求。因此,对检测样品来说,进行前增菌是必要的。本实验中采用FDA增菌方法,以具有选择性的BLEB增菌液进行前增菌。结果显示,通过选择性前增菌16h可以使样品中的LM达到ELISA方法的检测限。LB增菌液的OD值较高和假阳性结果可能是由于能够引起交叉反应的金黄色葡萄球菌等菌可在没有选择性的LB增菌液充分生长导致的。LM在选择性增菌液中生长良好,但选择性试剂可抑制革兰氏阴性菌和金黄色葡萄球菌等阳性菌的生长,从而能够减弱与金黄色葡萄球菌等的交叉反应,降低假阳性率。本研究建立的方法用于实际样本LM污染的筛查,可在48h内报告结果(包括前增菌),比国标[20]等传统检测方法省时省力。本方法对设备要求较低,结果准确性较高,具有一定的应用前景。
[1]江汉湖. 食品微生物学[M]. 2版. 北京: 中国农业出版社, 2005.
[2]董丽丽, 王春生, 安笑秋, 等. 单核细胞增生李斯特菌简介[J]. 中国乡村医药, 2000, 7(12): 24-25.
[3]FARBER J M, PETERKIN P I. Listeria monocytogenes, a food-borne pathogen[J]. Microbiological Reviews, 1991, 55(3): 476-511.
[4]MITCHELL L G, ARDEN H K. Listeria monocytogenes and Listeria infections[J]. Bacteriological Reviews, 1966, 30(2): 309-382.
[5]DENNY J, MCLAUCHLIN J. Human Listeria monocytogenes infections in Europe: an opportunity for improved European surveillance[J]. Eurosurveillance, 2008, 13(13): 1-5.
[6]傅宜方, 梁春霞, 卢国钧, 等. 广州市售熟肉制品单核细胞增生李斯特菌污染状况调查及前增菌方法运用效果观察[J]. 华南预防医学, 2008, 34(1): 68-70.
[7]袁丹茅, 金建潮, 陈前进, 等. 龙岩市6类食品中单核细胞增生李斯特菌的污染监测[J]. 疾病监测, 2006, 21(1): 21-23.
[8]尹本康, 梁柏年, 李占裕, 等. 江门市区食品中单增李斯特菌污染及耐药状况调查[J]. 疾病监测, 2007, 22(5): 294-296.
[9]汪永禄, 王艳, 郑锦绣, 等. 马鞍山市食品中单核细胞增生李斯特菌污染调查及分子生物学特征[J]. 中国预防医学杂志, 2010, 44(6): 566-568.
[10]LIN Min, TODORIC D, MALLORY M, et al. Monoclonal antibodies binding to the cell surface of Listeria monocytogenes serotype 4b[J]. Journal of Medical Microbiology, 2006, 55(3): 291-299.
[11]熊国华. 单增李斯特菌及溶血素O与葡萄球菌三种肠毒素免疫胶体金检测技术研究[D]. 沈阳: 沈阳农业大学, 2007.
[12]HOCHE I. Characterisation of antibodies for the immunochemical detection of Enterobacter sakazakii[J]. Czech Journal of Food Science, 2009, 27 (Suppl 2): 66-74.
[13]LARRY H S, PAUL M, MIES C S, et al. Development and partial characterization of high-affinity monoclonal antibodies for botulinum toxin type A and their use in analysis of milk by sandwich ELISA[J]. Journal of Immunological Methods, 2008, 336(1): 1-8.
[14]王志祥, 王静梅, 王耀峰. 单核增多性李氏杆菌多克隆抗体的制备及纯化[J]. 石河子大学学报: 自然科学版, 2003, 7(1): 4-6.
[15]彭珍, 魏华, 万翠香, 等. 单核增生李斯特菌Internalin A的克隆表达与抗体制备[J]. 中国微生态学杂志, 2009, 21(12): 1073-1076.
[16]YU K Y, NOH Y S, CHUNG M, et al. Use of monoclonal antibodies that recognize p60 for identification of Listeria monocytogenes[J]. Clinical and Diagnostic Laboratory Immunology, 2004, 11(3): 446-451.
[17]KIM S H, PARK M K, KIM J Y, et al. Development of a sandwich ELISA for the detection of Listeria spp. using specific flagella antibodies [J]. Journal of Veterinary Science, 2005, 6(1): 41-46.
[18]窦勇, 宁喜斌. 副溶血弧菌间接ELISA快速检测法的建立[J]. 食品工业科技, 2007, 28(6): 205-209.
[19]程洁, 张晓峰. 单增李斯特菌选择性增菌培养和分离方法的比较研究[J]. 检验检疫科学, 2003, 13(6): 36-38.
[20]GB/T 4789.30—2008食品卫生微生物学检验: 单核细胞增生李斯特氏菌检验[S].
Detection of Listeria monocytogenes in Food by Sandwich ELISA
DUAN Xia1,HUANG Xin2,HUANG Ling-fang1,WEI Hua1,LAI Wei-hua1,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Nanchang Xihu District Center for Disease Control and Prevention, Nanchang 330025, China)
A rapid, specific and sensitive sandwich enzyme-linked immunosorbent assay (ELISA) was developed to detect L. monocytogenes in food samples, which using polyclonal antibody as the capture antibody and anti-Internalin monoclonal antibody as the detection antibody. Anti-Listeria monocytogenes polyclonal antibody was prepared by using 0.5% formalin inactivated L. monocytogenes as antigen and Japanese rabbits as the host animal. The detection limit was 1.7×105CFU/mL in pure culture. Results showed that food samples had limited interference to the detection, while pre-enrichment using selective enrichment broth could significantly increase the detection limit and sensitivity.
Listeria monocytogenes;polyclonal antibody;monoclonal antibody;double-antibody sandwich ELISA
TS207.3
A
1002-6630(2010)24-0272-05
2010-08-07
科技部中小企业创新基金项目(10C26223601934)
段霞(1985—),女,硕士研究生,研究方向为食品科学。E-mail:huaxiady666@126.com
*通信作者:赖卫华(1968—),男,教授,博士,研究方向为食品科学。E-mail:talktolaiwh@163.com
