高效液相色谱法同时检测粮谷中的黄曲霉毒素和赭曲霉毒素
2010-03-24张宇昊
杨 琳,张宇昊,2,马 良,2,*
(1.西南大学食品科学学院,重庆 400715; 2.重庆市特色食品工程技术研究中心,重庆 400715)
高效液相色谱法同时检测粮谷中的黄曲霉毒素和赭曲霉毒素
杨 琳1,张宇昊1,2,马 良1,2,*
(1.西南大学食品科学学院,重庆 400715; 2.重庆市特色食品工程技术研究中心,重庆 400715)
建立粮谷类食品中黄曲霉毒素(B1、B2、G1和G2)和赭曲霉毒素A的同时检测方法。样品经过甲醇-水(80:20,V/V)提取,液液萃取净化和富集后,三氟乙酸衍生,采用Agilent ZORBAX SB-C18色谱柱(4.6mm× 250mm),以乙腈和体积分数2%冰醋酸溶液为流动相梯度洗脱,在线变换波长荧光检测。根据3倍信噪比的峰响应值,确定黄曲霉毒素(B1、B2、G1和G2)和赭曲霉毒素A检出限分别为0.06、0.03、0.18、0.05μg/kg和0.51μg/kg,上述5种毒素分别在质量浓度0.05~100、0.125~25.00、0.05~100、0.125~25.00μg/L和0.05~50.00 μg/L范围内呈线性相关,相关系数r分别为0.9998、0.9998、0.9998、0.9996和0.9998;在玉米、大米、小麦3类样品中加标回收率平均为71.73%~115.37%,相对标准偏差为3.00%~9.88%,方法学验证结果表明,黄曲霉毒素和赭曲霉毒素A 5种毒素同时检测结果与现行国标的单独检测方法检测结果无显著性差异(P>0.05)。
高效液相色谱;真菌毒素;同时检测;粮谷
黄曲霉毒素(AFT)和赭曲霉毒素(OT)是真菌毒素中毒性最大的两类毒素[1],1993年AFT被国际癌症研究机构(IARC)列为一类致癌物,赭曲霉毒素中的赭曲霉毒素A (OTA)则被列为二类致癌物。AFT和OT不仅毒性强,而且污染范围极广,AFT对粮食和饲料的危害有不少报道,检出率高达80%~100%[2-3],OT则被许多国家检出大量污染粮食作物[4-6],更有资料表明AFT和OTA常常同时污染同一粮食作物[7],而且存在毒性的加性效应[8]。目前虽然AFT和OTA的分别测定方法已比较成熟,很多学者都做了大量的研究,但其分别测定成本较高,试剂损耗严重且测定耗时,工作量大。而对AFT和OT进行同时检测可有效解决上述问题,缩短分析时间,提高食品安全性。目前对食品、农产品中AFT和OT等真菌毒素的单独检测方法主要有薄层色谱法、酶联免疫吸附法、荧光光度法、胶体金免疫层析法和高效液相色谱法等[9],但对其进行同时检测的报道较少,虽有少数文献建立了其同时检测方法[10-16],但其方法成本高,设备昂贵,不能在一般实验室大面积推广使用,因而受到限制,本实验采用液液萃取净化-三氟乙酸柱前衍生-高效液相色谱法配制可变波长荧光检测器同时检测AFT和OTA,可为粮食中AFT和OTA的限量检测提供一定的参考依据。
1 材料与方法
1.1 材料、试剂与仪器
玉米、大米、小麦均购于超市,产于重庆地区。
乙腈(色谱纯)、甲醇(色谱纯)、正己烷(分析纯) 天津四友公司;冰醋酸(色谱纯)、三氟乙酸(分析纯) 成都科龙试剂厂;AF(B1、B2、G1和G2)和OTA标准品北京泰乐祺公司;高纯氮气 重庆嘉润气体有限公司;超纯水。
LC-20A高效液相色谱仪(配有可变波长荧光检测器)日本岛津公司;JY2002分析天平(精度到0.0001g) 上海精密科学仪器有限公司天平仪器厂;KQ-50超声清洗器昆山超声仪器有限公司;HQ-60漩涡振荡器 北方同正生物技术发展公司;SG-280万能高速粉碎机 天津达康公司;HGC-12A氮吹仪 南京科捷分析仪器厂;JSG22 ×12标准筛 杭州大吉光电仪器有限公司;TC-M160 AFT多功能净化柱、OTA-A01免疫亲和柱 北京泰乐祺公司;Milli-QA10System超纯水仪 Millipore公司。
1.2 方法
1.2.1 同时检测方法
1.2.1.1 标准溶液的配制
分别称取0.0010g AFB1、AFB2、AFG1、AFG2和OTA溶于1mL乙腈中,配制成各自质量浓度为106μg/L的标准储备液,密封后避光保存。用标准储备液逐级稀释成标准系列溶液,制作标准曲线。
1.2.1.2 色谱条件
色谱柱:安捷伦ZORBAX SB-C18色谱柱,4.6mm ×250mm;流动相A:2%冰醋酸-乙腈70:30(V/V);流动相B:2%冰醋酸-乙腈 50:50(V/V);流速:1mL/min;柱温:30℃;进样量:10μL;梯度洗脱程序见表1。

表1 液相梯度洗脱条件Table 1 Elution conditions of HPLC
1.2.1.3 提取与净化
样品粉碎,过20目筛,准确称取5g样品于50mL三角瓶中,加入20mL甲醇-水(80:20,V/V),室温超声提取20min,定量滤纸过滤至三角瓶中,准确移取滤液5mL于试管中,加入5mL三氯甲烷,振荡1min,静置分层,将上层滤液移入另一试管中,向其加入1mL三氯甲烷,振荡1min,静置分层,弃去上层水层,将三氯甲烷层倒入第一支试管中,合并两次萃取液。
1.2.1.4 衍生
将收集到的萃取液(60±1)℃水浴氮气吹干,加入200μL正己烷和100μL三氟乙酸,密闭混匀30s,(40± 1)℃烘干箱中衍生15min,室温水浴氮气吹干,用1mL流动相溶解,0.22μm有机滤膜过滤,液相色谱测定。
1.2.2AFT国家标准检测方法
参照GB/T 5009.23—2006《食品中黄曲霉毒素B1、B2、G1、G2的测定》[17]方法检测。
1.2.3 OTA国家标准检测方法
参照GB/T 23502—2009《食品中赭曲霉毒素A的测定:免疫亲和层析净化高效液相色谱法》[18]方法检测。
2 结果与分析
2.1 提取净化条件的选择
2.1.1 提取方式对毒素提取效果的影响

图1 提取方式对毒素回收率影响Fig.1 Effect of extraction method on recovery rates of mycotoxins
实验比较超声波和漩涡振荡及两者交替3种方式对提取效果的影响,3种方式对毒素的提取回收率影响见图1。结果表明超声波提取效果比漩涡振荡效果好,各种毒素的回收率均在80%以上,而漩涡提取回收率不到70%,超声与漩涡交替与直接超声提取结果无显著差异。
在食品原料中,毒素在食品中的分布非常不均匀,毒素并不集中在样品颗粒表面,而是常常包埋在种子内部,并且与某些成分结合在一起,加之含量甚微,所以采用普通的机械振荡处理很难提取完全,而超声波提取技术主要通过快速机械振动波来减少目标萃取物与样品基体之间的作用力从而实现固-液萃取分离,从而使固体样品分散,被提取的样品细胞在瞬间破碎,同时改变细胞壁的结构,从而加强了毒素的溶解及扩散,增大样品与萃取溶剂之间的接触面积,提高目标物从固相转移到液相的传质速率,所以有利于毒素的提取完全。故采用超声波作为提取方式。
2.1.2 提取溶剂对毒素提取效果的影响
分别以甲醇-水(90:10;80:20;70:30,V/V)和乙腈-水(90:10;80:20;70:30,V/V)为提取剂对样品进行提取,结果表明,以甲醇-水(80:20,V/V)和乙腈-水(80: 20,V/V)的提取效率最高,回收率均大于85%,提取结果见图2。

图2 提取剂比例对毒素回收率的影响Fig.2 Effect of solvent amount on recovery rates of mycotoxins
AFT和OTA易溶于带极性的溶剂而不溶于非极性溶剂中,一般使用几种有机溶剂的混合液,如甲醇、乙睛、丙酮、氯仿等作为提取液。提取液中少量水可以湿润基质,增强有机溶剂在样品中的渗透能力,提高萃取效率,因此,通常采用有机溶剂与水的混合溶液作提取剂,例如,氯仿-水、甲醇-水或乙睛-水等;实验结果表明80%甲醇溶液和80%乙腈溶液对提取效果影响无显著差异,考虑到甲醇的潜在毒性相对较低且价格便宜,因此最终选择以甲醇-水(80:20,V/V)作为提取剂。
2.1.3 提取时间对毒素提取效果的影响
研究提取时间(10、20、30min)对提取率的影响,当提取时间10min时各种毒素回收率较低,当提取时间达20min以上时,回收率显著升高,20min和30min对提取效果无显著差异,结果见图3。
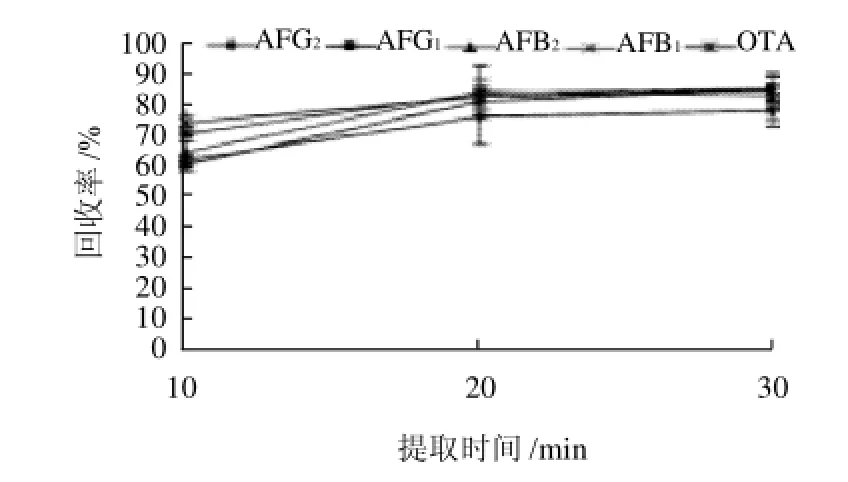
图3 提取时间对毒素回收率的影响Fig.3 Effect of extraction time on recovery rates of mycotoxins
随超声波提取时间的延长,提取率增大。分析原因是毒素在甲醇-水溶液中扩散逐渐均匀,随着时间延长而达到最大溶解度;但是提取时间过度延长,使杂质的溶出量增加,使毒素的检测受到干扰,另一方面成本费用增大,影响环保,因此提取时间确定为20min。
2.1.4 萃取次数对毒素提取效果的影响
研究萃取次数(1、2次和3次)对回收率的影响,发现当萃取次数达2次以上时提取效果较好,回收率均大于80%,结果见图4。
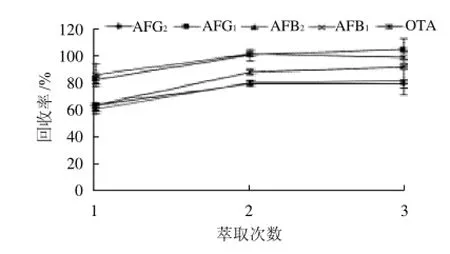
图4 萃取次数对毒素回收率的影响Fig.4 Effect of extraction repeat number on recovery rates of mycotoxins
AFT和OTA易溶于甲醇、三氯甲烷等有机溶剂,当用三氯甲烷萃取1次时仍有少量毒素残留水相中,回收率低,当萃取2次后回收率显著升高,毒素已基本萃取完全,萃取2次和萃取3次结果无显著差异,因此最终选择萃取2次。
2.1.5 提取温度、功率和料液比对毒素提取效果的影响
研究温度(40、30、20℃)、功率(100、120、150W)、料液比1:4、1:5、1:6(g/mL)对提取效果的影响,发现三者对提取率的影响不显著,本着经济和环保的原则最终选择20℃、100W和料液比1:4(g/mL)作为提取条件。
2.2 线性范围及检出限
分别用AFB1、AFG1、AFB2、AFG2和OTA的系列标准溶液按选定的色谱条件测定,其质量浓度(y)与峰面积(x)具有良好的线性关系,结果见表2。根据3倍信噪比的峰响应值,得出此方法检出限。

表2 真菌毒素的线性回归方程及检出限Table 2 Regression equations and detection limits of mycotoxins
2.3 精密度实验
分别用同一批样品做了日内和日间7次精密度实验,日内不同时间段分别处理7个样品,日间连续7d每天处理一个样品,实验结果见表3。日内和日间实验都表明精密度良好,说明方法重现性好。

表3 精密度实验结果Table 3 Result of precision experiments
2.4 回收率实验
在玉米、大米和小麦中添加表4中所列的3组不同水平的真菌毒素,按上述实验条件进行回收实验,测得的回收率见表4。标准溶液及加标样品的色谱图见图5~8。
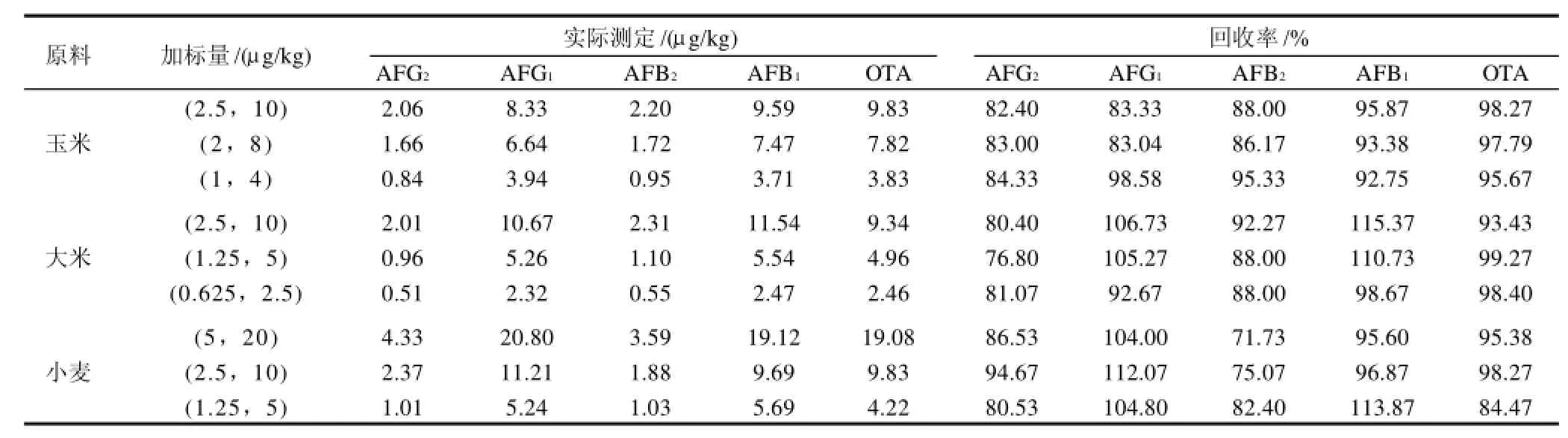
表4 回收率实验结果Table 4 Results of recovery experiments
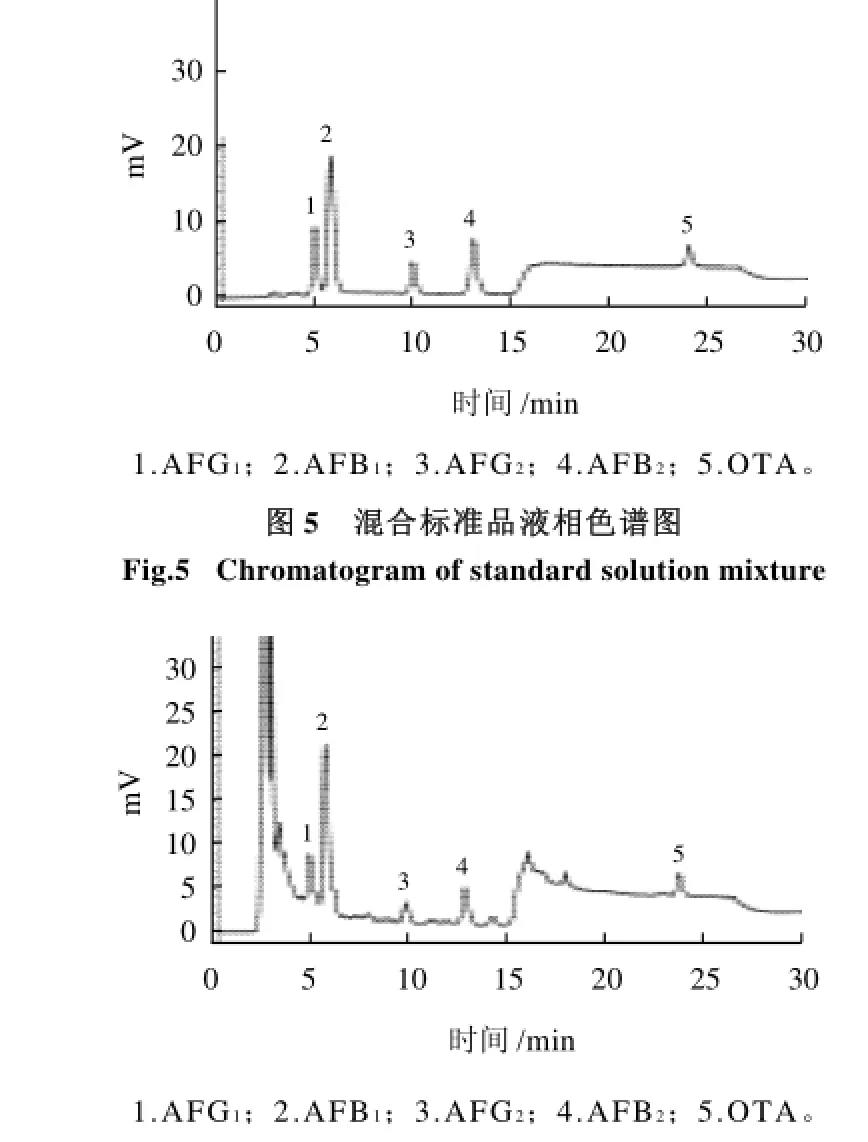
图6 玉米样品液相色谱图Fig.6 Chromatogram of corn sample

图7 大米样品液相色谱图Fig.7 Chromatogram of rice sample

表6 本方法与国标方法比较Table 6 Comparison of the simultaneous determination method with current national standard method
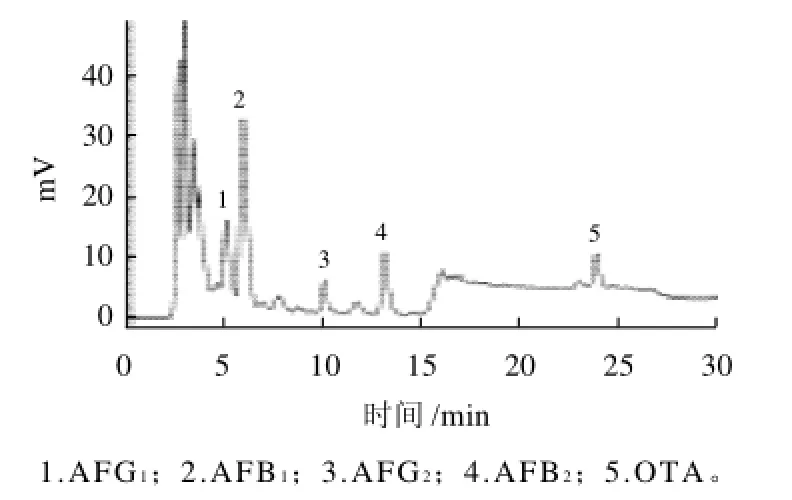
图8 小麦样品液相色谱图Fig.8 Chromatogram of wheat sample
2.5 方法学验证
将所建立的AFT和OTA 5种主要真菌毒素同时检测方法与AFT、OTA单一毒素国标检测方法进行比对,同一批样每种方法平行测定3次,比对结果见表5。
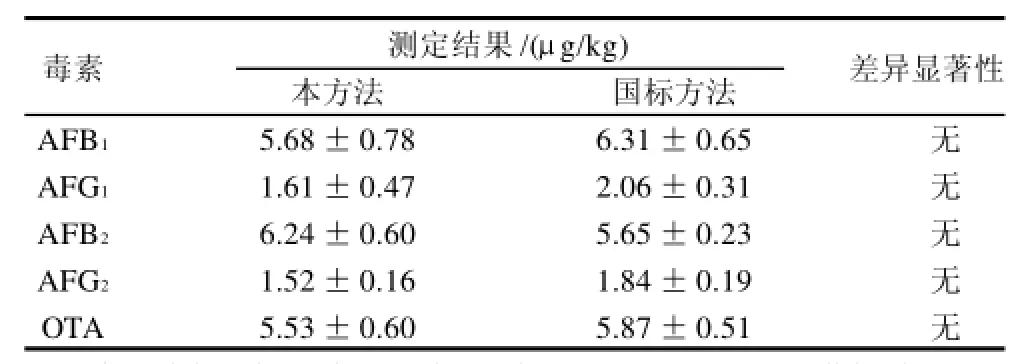
表5 与国标对比实验结果Table 5 Comparison of experimental results with current national standard
本方法在试剂使用、时间、成本及检出限等方面都满足现行国标要求,比较结果见表6。
从表6可以看出,AFT和OTA的同时检测可以节约时间,降低成本,减少工作量,避免试剂的重复使用,检出限满足国家检测标准要求,适用于粮食作物中AFT和OTA的测定。
3 结 论
本研究结果表明采用三氟乙酸柱前衍生-高效液相色谱能够同时检测AFT和OTA,且建立的同时检测方法与两者单独国标检测方法检测结果无显著差异,该方法成本较低,操作简便、快速、净化效果好,各项技术指标均符合真菌毒素国家检测标准的要求,可以满足我国对粮食中AFT和OTA的限量检测要求。
[1]吴永宁. 现代食品安全科学[M]. 北京: 化学工业出版社, 2003: 27.
[2]王若军, 苗朝华, 张振雄, 等. 中国饲料及饲料原料受霉菌毒素污染的调查报告[J]. 饲料工业, 2003, 24(7): 53-54.
[3]敖志刚, 陈代文. 2006—2007 年中国饲料及饲料原料[J]. 中国畜牧兽医, 2008, 35(1): 152-156.
[4]BURDASPAL P A, LEGARDA T M. Ochratoxin A en vinos, mostosyzumos de uvaelaborados en Espanay en otros paises europeas[J]. Alimentaria, 1999, 99: 107-113.
[5]PIETRI A, BERTUZZI T, PALLARONI L, et al. Occurrence of ochratoxin A in Italian wines[^J]. Food Addit Contam, 2001, 18: 647-654.
[6]SAGE L, KRIVOBOK S, DELBOS E, et al. Fungal flora and ochratoxin A production in grapes and musts from France[J]. J Agri Food Chem, 2002, 50: 1306-1311.
[7]SEDMIKOVA M, REISNEROVA H, DUFKOVA Z, et al. Potential hazard of simultaneous occurrence of aflatoxin B1and ochratoxin A[J]. Vet Med-Czech, 2001, 46(6): 169-174.
[8]王刚, 杨汉春. 黄曲霉毒素B1和赭曲霉毒素A对商品肉鸡ND疫苗免疫的影响[J]. 中国兽医杂志, 2008, 44(11): 30-32.
[9]杨洁彬, 王晶, 王柏琴. 食品安全性[M]. 北京: 中国轻工业出版社, 2002: l45.
[10]李军, 于一茫, 田苗, 等. 免疫亲和柱净化-柱后光化学衍生-高效液相色谱法同时检测粮谷中的黄曲霉毒素、玉米赤霉烯酮和赭曲霉毒素A[J]. 色谱, 2006, 24(6): 581-584.
[11]GORYACHEVA I Y, SAEGER S D, DELMULLE B, et al. Simultaneous non-instrumental detection of aflatoxin B1 and ochratoxin A using a clean-up tandem immunoassay column[J]. Analytica Chimica Acta, 2007, 590: 118-124.
[12]GHALI R, HMAISSIA-KHLIFA K, GHORBEL H, et al. Incidence of aflatoxins, ochratoxin A and zearalenone in tunisian foods [J]. Food Control, 2008, 19: 921-924.
[13]SAHA D, ACHARYA D, ROY D, et al. Simultaneous enzyme immunoassay for the screening of aflatoxin B1and ochratoxin A in Chili samples[J]. Analytica Chimica Acta, 2007, 584: 343-349.
[14]杨芳, 吴洪城. 婴儿米粉中2种曲霉毒素的同时检测[J]. 中国公共卫生, 2005, 21(10): 1254-1255.
[15]WANG Yaling, CHAI Tongjie, LU Guozhong, et al. Simultaneous detection of airborne aflatoxin, ochratoxin and zearalenone in a poultry house by immunoaffinity clean-up and high-performance liquid chromatography[J]. Environmental Research, 2008, 107: 139-144.
[16]CHAN D, MACDONALD S J, BOUGHTFLOWER V, et al. Simultaneous determination of aflatoxins and ochratoxin A in food using a fully automated immunoaffinity column clean-up and liquid chromatographyfluorescence detection[J]. Journal of Chromatography A, 2004, 1059: 13-16.
[17]中国疾病预防控制中心营养与食品安全所. GB/T 5009.23—2006食品中黄曲霉毒素B1、B2、G1、G2的测定[S]. 北京: 中国标准出版社, 2006.
[18]青岛市产品质量监督检验所. GB/T 23502—2009 食品中赭曲霉毒素A的测定: 免疫亲和层析净化高效液相色谱法[S]. 北京: 中国标准出版社, 2009.
Simultaneous Determination of Aflatoxins and Ochratoxin A in Cereal Grains by High Performance Liquid Chromatography
YANG Lin1,ZHANG Yu-hao1,2,MA Liang1,2,*
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Special Food Engineering Technology Research Center, Chongqing 400715, China)
A HPLC method was developed for the simultaneous determination of aflatoxins B1, B2, G1 and G2 and ochratoxin A in cereal grains. Cereal grain samples were subject to extraction using methano1-water (80:20, V/V), liquid-liquid purification, enrichment and derivation using trifluoroacetic acid. The purification was performed on an Agilent ZORBAX SB-C18column (4.6 mm × 250 mm) with a linear gradient elution of acetonitrile-2% glacial acetic acid. The detection limits of developed HPLC method for AFB1, AFB2, AFG1, AFG2 and OTA were 0.06, 0.03, 0.18, 0.05μg/kg and 0.51μg/kg, respectively. The linear detection ranges of developed HPLC method for AFB1, AFB2, AFG1, AFG2and OTA was 0.05-100, 0.125-25.00, 0.05-100, 0.125-25.00μg/L and 0.05-50.00μg/L with correlation coefficients of 0.9998, 0.9998, 0.9998, 0.9996 and 0.9998, respectively. Recovery rates in cereal grains (corn, rice, wheat) spiked with mycotoxins were in the range of 71.73%-115.37% with the relative standard deviation of 3.00%-9.88%. This HPLC method exhibited the capability to simultaneously determinate mycotoxins. Moreover, no significant difference was observed between the determination results and current national standard (P>0.05).
high performance liquid chromatography;mycotoxins;simultaneous determination;cereal grain
TS207.3
A
1002-6630(2010)24-0250-05
2010-09-20
国家“863”计划项目(2007AA10Z427);重庆市科技攻关计划项目(CSTC,2009AC0008);中央高校基本科研业务费专项(XDJK 2009C056);重庆市高等教育教学改革研究项目(09-3-183);西南大学“518”质量工程项目(2008JY069)
杨琳(1984—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:swuyanglin@yahoo.com.cn
*通信作者:马良(1979—),女,副教授,博士,研究方向为食品安全检测技术与食品质量控制。E-mail:zhyhml@163.com
