向日葵盘总黄酮工艺优化及含量测定
2010-03-24杨树平韩立军陈晓云许瑞波蒋迎道
杨树平,韩立军,陈晓云,许瑞波,蒋迎道
(1.淮海工学院化学工程学院,江苏 连云港 222005;2.淮海工学院理学院,江苏 连云港 222005)
向日葵盘总黄酮工艺优化及含量测定
杨树平1,韩立军2,陈晓云1,许瑞波1,蒋迎道1
(1.淮海工学院化学工程学院,江苏 连云港 222005;2.淮海工学院理学院,江苏 连云港 222005)
为研究向日葵盘总黄酮提取最优条件,采用正交试验L9(33)考察乙醇体积分数、提取温度和提取时间对向日葵盘中总黄酮提取率的影响。用紫外分光光度法测定提取液中总黄酮含量,以总黄酮含量作为提取工艺优化指标,得出向日葵盘中总黄酮的最佳提取工艺条件为A1B3C3,即乙醇体积分数50%、提取温度80℃、反应时间2h,提取效果最好,向日葵盘中总黄酮含量高达33.6436mg/g。
向日葵盘;总黄酮;工艺优化;提取
向日葵花盘为菊科植物向日葵(Helianthus annuuss L.)的花盘,亦称向日葵花托、向日葵饼和葵房,其性平、味甘淡、无毒、归肝经,主要功能有清热平肝、止痛、止血,用于治疗关节炎、乳腺炎、头晕、耳鸣、脘腹痛等[1]。向日葵盘水煎液具有治疗肿瘤作用,向日葵花盘乙醇提取物有一定的降压作用[2-3],民间也用其作为调治萎缩性胃炎药膳[4]。
天然黄酮作为生物活性化合物,具有预防和治疗高血压及动脉硬化、抗肝脏毒、抗炎、抗氧化、雌性激素样、抗菌及抗病毒、泻下作用等[5-7],也可作为甜味剂、抗氧化剂、天然色素在保健食品、化妆品及食品工业中被广泛应用[8-9]。目前,花盘中多糖、果胶和绿原酸的提取研究已有报道[10-13],但从向日葵盘中提取黄酮类化合物还尚未见报道。内蒙古河套地区是我国向日葵的主产地之一,长期以来,大量的脱去种子后的向日葵盘成为垃圾被丢弃或作为饲料使用,造成资源的极大浪费。鉴于黄酮类化合物在医药、食品、化妆品工业中的广阔应用前景,本实验通过对采自内蒙古河套地区向日葵盘中总黄酮的提取,探讨最佳提取工艺,旨在为向日葵中黄酮成分的提取提供参考,为向日葵资源的充分利用与综合开发提供科学依据。
1 材料与方法
1.1 材料、试剂与仪器
向日葵盘,采自内蒙古自治区河套地区,秋季采摘,自然晾干,粉碎后备用。
芦丁标准品 中国药品生物制品检定所;无水乙醇、石油醚、氯仿等均为分析纯。
DF-1型集热式磁力搅拌器 江苏省金坛市荣华仪器制造有限公司;DHG-9140A型电热恒温鼓风干燥箱 浙江舟山市定海区海源仪器厂;BS210S型电子天平 北京赛多利斯天平有限司;UV-2550型紫外分光光度计 日本岛津公司。
1.2 方法
1.2.1 向日葵盘总黄酮的提取工艺
工艺流程:向日葵盘→干燥→粉碎、过筛(60目)→精密称量→石油醚脱色→乙醇提取→过滤→定容→向日葵盘总黄酮提取液。
操作要点:将向日葵盘粉末(60目)在50℃恒温烘干至质量恒定,精密称取粉末1g置于100mL圆底烧瓶中,加入石油醚30mL,加热回流1h,滤去石油醚(重复操作一次),然后挥干石油醚,按照正交试验表L9(33)设定的提取条件进行提取,过滤,提取液置于100mL容量瓶中,用相应体积分数的乙醇溶液定容,静置待测。
1.2.2 总黄酮含量的测定
1.2.2.1 吸收波长的选择
芦丁标准品溶液配制:精密称取质量恒定的芦丁标准品20.20mg,用30%乙醇将其充分溶解,并定容于200mL容量瓶中,即该标准品溶液的质量浓度为0.1010mg/mL。
将芦丁标准品溶液和向日葵盘样品溶液以30%乙醇为空白对照,在200~400nm波长范围进行紫外吸收扫描,结果显示,标准溶液和样品溶液的最大吸收波长出现在260nm附近(图1),故选定260nm为总黄酮的测定波长。
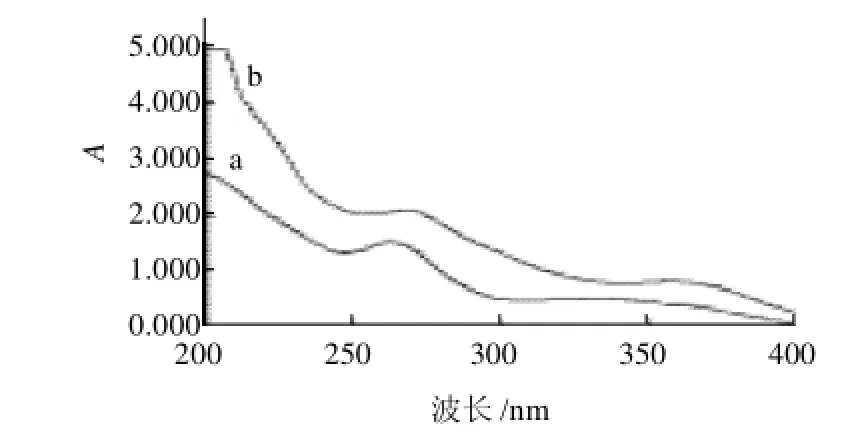
图1 芦丁标准品(a)和向日葵盘样品(b)的紫外吸收图谱Fig.1 UV absorption spectra of standard rutin and Helianthus annuus L.
1.2.2.2 标准曲线的制备
精确量取芦丁标准品溶液0、1、2、3、4、5mL分别置于10mL具塞试管中,用30%乙醇稀释至刻度,摇匀静置10min后,在波长260nm处进行紫外吸光度测定,以吸光度(Y)为纵坐标、芦丁含量X/(mg/mL)为横坐标,绘制标准曲线,得回归方程为:Y=34.277X+0.0304,R2=0.9998。结果表明,芦丁对照品质量浓度在0.0101~0.0505mg/mL范围内与吸光度呈良好线性关系。
1.2.2.3 样品液制备和总黄酮含量测定
精密量取1.2.1节9组向日葵盘总黄酮提取液0.5mL分别置于10mL具塞试管中,用相应体积分数的乙醇定容,即稀释20倍,并用相应体积分数的乙醇作空白参比,按照1.2.2.2节方法通过回归方程计算相应的总黄酮质量浓度X/(mg/mL)。
总黄酮含量/(mg/g) =总黄酮质量浓度/(mg/mL)×20 (稀释倍数)×100(提取液总体积/mL)/向日葵盘粉末质量/g
1.2.3 试验设计
1.2.3.1 单因素试验
分别研究固液比(g/mL)、提取时间及提取次数对向日葵盘总黄酮含量的影响。
1.2.3.2 正交试验设计
参考相关文献[14-16]并结合单因素试验结果,在选定固液比为1:25(g/mL),提取次数2次的前提下,选取乙醇体积分数、提取温度和提取时间为试验因素进行正交试验设计,每因素设3水平(表1),选用L9(33)正交试验设计表进行试验,优化向日葵盘总黄酮的提取工艺。

表1 向日葵盘总黄酮提取工艺正交试验因素水平表Table 1 Factors and levels in orthogonal experiments
2 结果与分析
2.1 向日葵盘总黄酮提取工艺
2.1.1 不同脱色溶剂对向日葵盘总黄酮脱色效果的影响

图2 氯仿脱色后向日葵盘样品的紫外图谱Fig.2 UV absorption spectrum of Helianthus annuus L. decolorized by chloroform
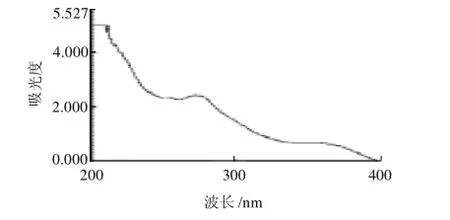
图3 石油醚脱色后向日葵盘样品的紫外图谱Fig.3 UV absorption spectrum of Helianthus annuus L. decolorized by petroleum ether
向日葵盘中含有的脂溶性色素会影响到总黄酮提取纯度并干扰含量测定的准确度,分别选用石油醚和氯仿去除向日葵盘中脂溶性色素,对比实验结果,石油醚的脱脂效果明显强于氯仿,见图2、3,由于石油醚的极性弱于氯仿,更易于将向日葵盘中脂溶性成分溶出,因此其脱脂效果明显好于氯仿。
2.1.2 固液比对总黄酮含量的影响
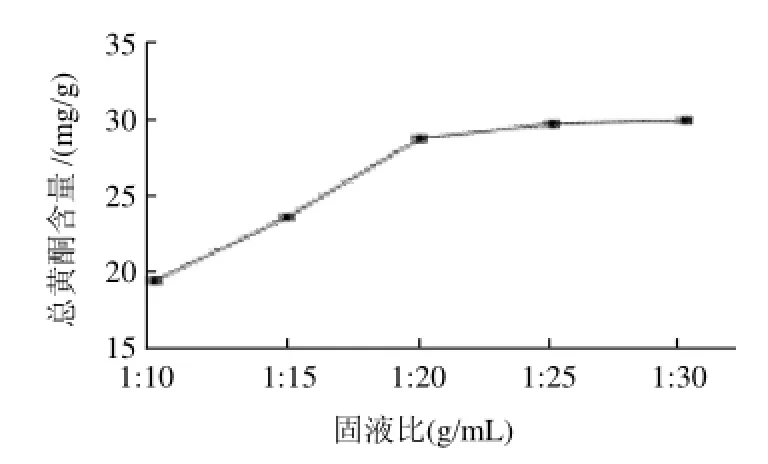
图4 固液比对总黄酮含量的影响Fig.4 Effect of material-liquid ratio on the content of total flavonoids
在乙醇体积分数60%、提取温度70℃、提取时间2h和提取2次的条件下,研究固液比对向日葵盘总黄酮含量的影响(图4)。结果表明,随溶剂量的增加,总黄酮含量明显增大,在固液比1:25(g/mL)时总黄酮的含量基本趋于稳定。在实际操作中考虑总黄酮的充分溶出,同时也为避免溶剂的浪费,综合两方面的因素,固液比设置为1:25(g/mL)时较佳。
2.1.3 提取时间对总黄酮含量的影响
在乙醇体积分数60%、提取温度70℃、固液比1:25(g/mL)和提取次数2次的条件下,研究提取时间对向日葵盘总黄酮含量的影响(图5)。结果表明,总黄酮含量随提取时间的加大而增加,当提取时间大于1.5h时总黄酮的含量趋于稳定。在选择提取时间时既要考虑到有效物质是否充分溶出,也要注意过长时间的高温提取对化合物结构的影响,故正交试验设计中提取时间设置为1.5~2.0h。
2.1.4 提取次数对总黄酮含量的影响

图6 提取次数对对总黄酮含量的影响Fig.6 Effect of extraction repeat number on the content of total flavonoids
在乙醇体积分数60%、提取温度70℃、固液比1:25(g/mL)和提取时间2h的条件下,研究提取次数对向日葵盘总黄酮含量的影响(图6)。结果表明,随着提取次数增加,总黄酮含量增加,当提取次数大于2次,曲线趋势已接近平缓,即总黄酮含量的增加已不明显,增加提取次数,可以提高总黄酮含量,从简化实验操作和节省时间考虑,确定提取次数为2次。
2.2 正交试验结果分析

表2 向日葵盘总黄酮提取正交试验结果L9(33)Table 2 Results of orthogonal experiments
表2正交试验结果分析表明:在影响总黄酮含量的各因素中,乙醇体积分数(A)对总黄酮含量影响最大,提取温度(B)次之,提取时间(C)影响较小,确定向日葵盘中总黄酮的最佳提取工艺组合是A1B3C3,即用50%乙醇,在温度80℃条件下提取时间2h,可得到较高的总黄酮含量。
2.3 验证实验
精密称取向日葵盘粗粉1g,共5份,按最佳提取工艺条件提取,进行验证实验,测得平均总黄酮含量为33.8061mg/g,RSD1.83%,可见该工艺稳定可行。
3 结 论
通过单因素试验与正交试验结果分析得出,在固液比1:25(g/mL),提取次数2次固定不变的条件下,向日葵盘中总黄酮的最佳提取工艺组合是A1B3C3,即用50%乙醇,在温度80℃条件下,提取时间2h,向日葵盘中总黄酮含量为33.6436mg/g。影响向日葵盘中总黄酮含量的各因素顺序依次是乙醇体积分数(A)、提取温度(B)、提取时间(C),此提取工艺条件简单,提取率较高,重现性好。
[1]苏烧琴, 赵利民, 王秉兰. 向日葵的药用研究[J]. 黑龙江医药, 1995, 8(1): 57-59.
[2]赵国中, 戴慎, 陈仁寿. 中药大辞典[M]. 上海: 上海科学技术出版社, 2006: 1287-1288.
[3]金贻郎, 伍后胜. 中华天然补品资源大辞典[M]. 北京: 长征出版社, 1993: 93-94.
[4]于彦芳. 调治萎缩性胃炎药膳两例[J]. 饮食科学, 2007(7): 61.
[5]刘蕊. 黄酮类化合物的药理作用研究进展[J]. 黑龙江医药, 2010, 23 (2): 234-236.
[6]周俊, 周德生. 天然黄酮类化合物对心脑血管的药理研究进展[J]. 中西医结合心脑血管病杂志, 2010, 8(6): 725-727.
[7]黄河胜, 马传庚, 陈志武. 黄酮类化合物药理作用研究进展[J]. 中国中药杂志, 2000, 25(10): 18-20.
[8]陈晓慧, 徐雅琴. 黄酮类化合物生物活性及在食品中的应用研究[J].食品工程, 2006(3): 12-14.
[9]万明, 宋永钢, 杨菠. 黄酮类化合物的药理作团及其在食品王业中的应用[J]. 江西食品工业, 2007(3): 47-49.
[10]索金玲, 彭秧, 朱然. 向日葵花盘水溶性多糖提取工艺及抗氧化研究[J]. 生物技术, 2010, 20(2): 74-77.
[11]张磊, 柳红东, 刘忆冬, 等. 向日葵盘果胶的提取工艺条件研究[J].化工技术与开发, 2008, 37(6): 33-38.
[12]郭代英. 向日葵盘中绿原酸的提取、纯化工艺研究[J]. 中国当代医药, 2009, l6(18): 43-44.
[13]张磊, 江英, 陈计峦, 等. 利用响应面分析法优化向日葵盘中果胶的提取工艺[J]. 保鲜与加工, 2007, 7(4): 36-39.
[14]殷红, 胡永洲, 杨鑫骥, 等. 正交设计研究杭白菊总提取物及总黄酮提取工艺[J]. 中国中药杂志, 2004, 29(8): 737-739.
[15]黄爱萍, 郑少泉. 龙眼果肉黄酮乙醇法提取优化工艺研究[J]. 福建农业学报, 2009, 24(6): 535-539.
[16]陈林林, 吴春, 蒋意桥. 菟丝子总黄酮提取工艺的研究[J]. 哈尔滨商业大学学报: 自然科学版, 2004, 20(6): 644-647.
Extraction and Determination of Total Flavonoids from Helianthus annuus L.
YANG Shu-ping1,HAN Li-jun2,CHEN Xiao-yun1,XU Rui-bo1,JIANG Ying-dao1
(1. School of Chemical Engineering, Huaihai Institute of Technology, Lianyungang 222005, China;2. School of Mathematics and Science, Huaihai Institute of Technology, Lianyungang 222005, China)
In order to investigate the optimal extraction processing conditions of total flavonoids from Helianthus annuus L, orthogonal experiments were used to explore the effects of ethanol concentration, extraction temperature and extraction time on extraction rate of total flavonoids. The content of total flavonoids was determined by ultraviolet (UV) spectrometry method. Results indicated that the optimal extraction processing conditions were ethanol concentration of 50%, extraction temperature of 80 ℃and extraction duration of 2 h. The maximum extraction rate of 33.6436 mg/g was achieved under the optimal extraction conditions.
Helianthus annuus L.;total flavonoids;optimization;extraction
R284.2
A
1002-6630(2010)24-0066-04
2010-09-20
江苏省海洋资源开发研究院科技开放基金课题(JSIMR09D02);淮海工学院自然科学基金项目(KX10019);淮海工学院引进人才启动基金项目(KK01064)
杨树平(1960—),女,副教授,学士,主要从事药物化学研究。E-mail:spyang69320@yahoo.cn
