动态超高压微射流预处理对香菇多糖得率的影响
2010-03-24涂宗财尹月斌
姜 颖,涂宗财*,陈 媛,王 强,李 志,尹月斌
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
动态超高压微射流预处理对香菇多糖得率的影响
姜 颖,涂宗财*,陈 媛,王 强,李 志,尹月斌
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
为拓展动态超高压微射流均质技术的应用,采用该技术对香菇子实体进行预处理,在单因素试验的基础上进行正交试验预处理条件优化,通过实验组和对照组的对比分析,研究此预处理方法对香菇多糖得率的影响。结果表明:动态超高压微射流在140MPa、料液比1:60(g/mL)条件下多糖得率达到最高值6.755%。与对照组相比,实验组香菇多糖提取效率改善显著。
动态超高压微射流;香菇多糖;预处理;提取
香菇多糖,是一种从香菇中提取的β-(1→3)-D-葡聚糖,是可激活人体免疫系统的、具有显著抗肿瘤作用的生物活性大分子[1]。最早是由日本学者Chihara等[2]通过乙醇和正十六烷基三甲基氢氧化铵分级沉淀,及醋酸分步溶解,DEAE树脂纯化而得到的。通常其提取方法可分为两大类,一类是溶剂(水、稀碱、聚乙二醇)浸提;另一类是使用超声和超高压辅助提取[3]。
国内动态超高压微射流技术较多运用于生物大分子的改性研究中,其对卵清蛋白、花生球蛋白的结构及功能性质的影响已有研究[4-5];Liu等[6-7]研究该处理对多酚氧化酶的影响。国外Tunick等[8]研究其对干酪微结构的影响;Lagoueyte等[9]研究微射流均质技术对黄原胶功能性质的影响;Dalgleish等[10]研究经超高压微射流均质后牛奶脂肪颗粒及酪蛋白的变化情况。关于动态超高压微射流对有效成分提取的影响,鲜有报道。涂宗财等[11]研究动态超高压微射流处理对玉米花粉破壁效果和多糖得率的影响。本研究以此技术作为预处理方法,考察其对香菇多糖提取的影响,拟为此技术的应用开辟新的方向。
1 材料与方法
1.1 材料与试剂
干香菇子实体(干燥粉碎后过100目筛备用) 市购;苯酚、无水乙醇、乙醚、丙酮 天津市大茂化学试剂厂;浓硫酸 上海试剂化学有限公司;无水葡萄糖 广东汕头市西陇化工厂。以上试剂均为分析纯。
1.2 仪器与设备
M-110EH型微射流均质机 美国Microfluidics公司;FreeZone 4.5 Litter真空冷冻干燥机 美国Labconco公司;TDL-5-A台式离心机 上海安亭科学仪器厂;T6新世纪紫外-可见分光光度计 北京普析通用仪器有限责任公司;小型均质机 上海东华高压均质机厂。
1.3 方法
1.3.1 预处理方法的建立
实验组预处理方法:5g香菇原料分散于设定比例的水中,经30MPa高压均质5min后,在预设压力及次数条件下,过M-110EH型微射流均质机,备用。
对照组预处理方法:5g香菇原料分散于设定比例的水中,经30MPa高压均质5min,备用。
1.3.2 香菇多糖的提取[2,12-13]
样品预处理后,在一定温度下,水浴提取一定时间,离心(4000r/min、10min、20℃)得上清液;Sevag法[14]脱蛋白,流水透析(8000~14000D)2d,蒸馏水透析1d;45℃下旋转蒸发浓缩;4℃无水乙醇沉淀2h,并使乙醇最终体积分数达到75%;离心(4000r/min、10min、20℃)得沉淀;45℃水浴去离子水复溶沉淀;离心(10000r/min、0.5h、20℃)取清液;丙酮逐滴加入,至丙酮与上清液终体积比1:1;离心(4000r/min、10min、20℃)得沉淀;无水乙醇洗涤沉淀两次,乙醚洗一次;冷冻干燥得香菇多糖。
1.3.3 香菇多糖得率的测定
以D-葡萄糖为标准,采用苯酚-硫酸法测定多糖含量[15]。回归方程为:A=0.0076C-0.0105,R2=0.9993。

1.3.4 微射流处理压力对香菇多糖得率的影响
动态超高压微射流处理压力的变化范围60~160MPa,变化梯度为20MPa,其他条件为料液比1:60 (g/mL)、微射流处理次数2次、提取时间2h、提取温度90℃。提取结束后考察预处理压力对香菇多糖得率的影响。
1.3.5 微射流处理次数对香菇多糖得率的影响
处理次数的变化范围1~5次,变化梯度为1次,其他条件处理压力140MPa、料液比1:60(g/mL)、提取时间2h、提取温度90℃。提取结束后考察预处理次数对香菇多糖得率的影响。
1.3.6 实验组与对照组的比较
在不同时间段内,不同料液比以及不同温度下,以香菇多糖得率为响应值,实验组与对照组比较分析,证明实验组预处理方式对提高多糖得率的效果显著。
1.3.7 动态超高压微射流预处理提取香菇多糖条件优化
为评价动态超高压微射流预处理对香菇多糖提取效率的影响,在单因素试验基础上,选取微射流处理压力(A)、料液比(B)、提取温度(C)三因素三水平(表1),且不考虑各因素之间的交互作用,以香菇多糖得率为响应值,采用正交试验助手软件(Sharetop软件工作室)做数据分析。

表1 动态超高压微射流预处理提取香菇多糖正交试验因素水平表Table 1 Factors and levels of orthogonal experiments
1.3.8 数据分析
所有实验重复5次,采用SPSS 13.0数据处理软件,各组数据结果以x±s表示,并进行单因素方差分析,LSD两两比较,P<0.05为差异具有显著性。
2 结果与分析
2.1 动态超高压微射流预处理压力对香菇多糖得率的影响
实验组样品在微射流均质机反应腔中受到强烈剪切、高速撞击、压力瞬时释放、涡旋等综合作用[6-7],导致样品颗粒在水中更均匀地分散、混合和微粒化;并使样品细胞破碎度增大,溶剂利用细胞的通透性或渗透性,更易进入细胞内部,从而和细胞内的有效成分快速达到溶解平衡,更利于提取的进行[11]。不同预处理压力(60~160MPa)对香菇多糖得率的影响如图1所示。

图1 动态超高压微射流处理压力对香菇多糖得率的影响Fig.1 Effect of microfluidization pressure on extraction rate of lentinan
由图1可知,实验组随着预处理压力的增大,香菇多糖得率呈现递增趋势。处理压力从60MPa逐渐提高到160MPa,多糖得率由(5.65±0.17)%增高到(7.18± 0.15)%。当压力增加到140MPa后,得率增幅较小,逐渐趋于平衡。单因素方差分析显示在60、80、100、120、140MPa下,压力对多糖得率具有显著性影响(P<0.01)。以上结果说明,均质压力越高,可能细胞破碎程度越高,更利于多糖的溶出,得率有所提高。
2.2 动态超高压微射流处理次数对香菇多糖得率的影响
M-110EH型微射流均质机最高操作压力为172MPa,样液最大流速为450mL/min,在此系统下,考察微射流处理次数对多糖得率的影响。
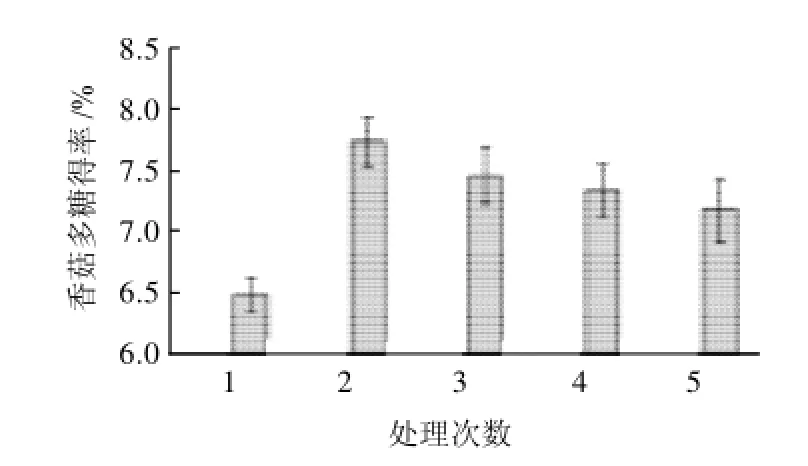
图2 动态超高压微射流处理次数对香菇多糖得率的影响Fig.2 Effect of microfluidization pretreatment repeat number on extraction rate of lentinan
如图2所示,在1~5次不同处理次数下,经微射流处理2次,多糖得率最大,可达到(7.75±0.20)%;处理一次,样液在反应腔中受力不充分,得率仅为(6.49±0.14)%;当处理次数超过2次后,样液有一定程度的损失,从而造成多糖得率的下降,单因素方差分析表明处理次数对多糖得率具有显著性影响(P<0.01)。
2.3 实验组与对照组不同提取时间多糖得率的比较
在传统的溶剂提取过程中,时间对提取结果的影响较大,有效成分的溶出是一个平衡的过程,需要一定的时间。两组实验的比较结果如图3所示。
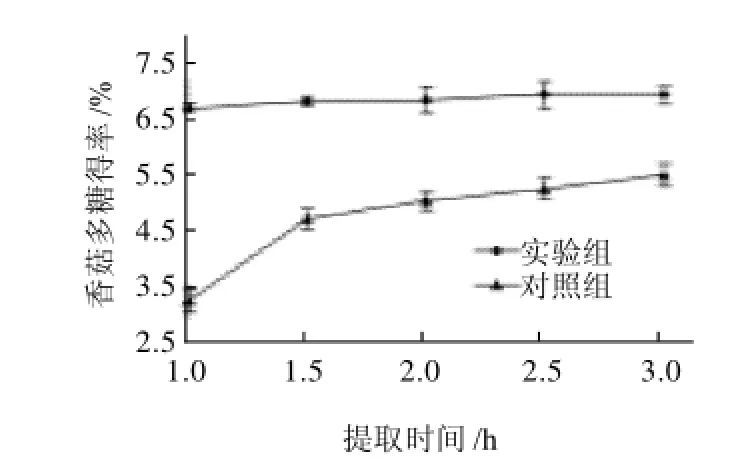
图3 两组实验不同时间段内的比较结果Fig.3 Comparison of extraction rates of lentinan in two groups with different pretreatment time
由图3可见,实验组在1~3h内,多糖得率基本没有变化,仅从1h的(6.76±0.10)%增加到3h时的(7.02± 0.16)%,增幅较小;而对照组多糖得率随时间的延长,有明显提高。1h为(3.27±0.21)%,3h时为(5.56±0.21)%,增加了2.29%;且实验组在1h时的得率就已高出对照组在3h时的得率1.2%。其原因在于,实验组经微射流预处理后,细胞破碎程度大,再加上瞬时高压的作用,溶剂能够在极短的时间渗透到细胞内部,多糖溶解快速达到平衡,后续延长提取时间也不能明显增加多糖得率。不同时间条件下,实验组与对照组比较,有显著差异(P<0.05)。因此,微射流预处理样液,省时高效,对提高香菇多糖得率效果显著。
2.4 实验组与对照组不同料液比多糖得率的比较
液体的体积,会影响固体微粒从固体主体向液体主体的传质过程。但料液比过大,后续浓缩步骤耗能、耗时过多。两组实验的比较结果如图4所示。
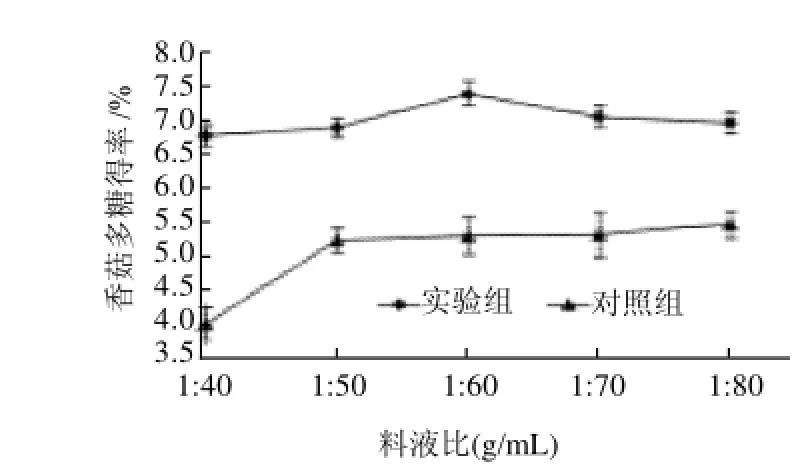
图4 两组实验不同料液比的比较结果Fig.4 Comparison of extraction rates of lentinan in two groups with different material-liquid ratios
图4 所示,实验组多糖得率随着料液比的增大,呈先增大后递减趋势,当料液比为1:60(g/mL)时达到最大得率(7.43±0.18)%。对照组得率先显著增大后逐渐趋于平缓。料液比在1:40~1:50(g/mL)范围内,得率增幅较大,平均得率增大1.3%。原因在于对照组多糖得率依靠液体体积效能明显,在较低液体量时,提取不能充分进行。而实验组,在引入微射流均质预处理的高撞击、剪切、瞬时压力降等作用后,增大了固液界面的湍流程度,同时瞬时压力作用促进了传质的过程,从而在较低液体量时,也能提取相对充分。实验组得率有所降低,是因为液体量过大时,实验组样品颗粒相对更分散,在反应腔内,剧烈作用力下,可能导致多糖降解,得率降低。两组多糖得率差异有显著性(P<0.05)。
2.5 实验组与对照组不同温度多糖得率的比较

图5 两组实验不同温度下的比较结果Fig.5 Comparison of extraction rates of lentinan in two groups with different temperatures
如图5所示,实验组得率随温度的增高显著提高。对照组增幅不大。两组实验趋势相同。一般来说,温度升高,多糖的溶解度会增大,浸提液黏度会减少,扩散系数会增大[16],这就促使浸提效率的提高。两组实验在60℃时无显著差异,其他温度下,差异显著(P<0.05)。
2.6 动态超高压微射流预处理提取香菇多糖条件优化

表2 正交试验设计L9(34)结果与分析Table 2 Results and analysis of orthogonal experiments
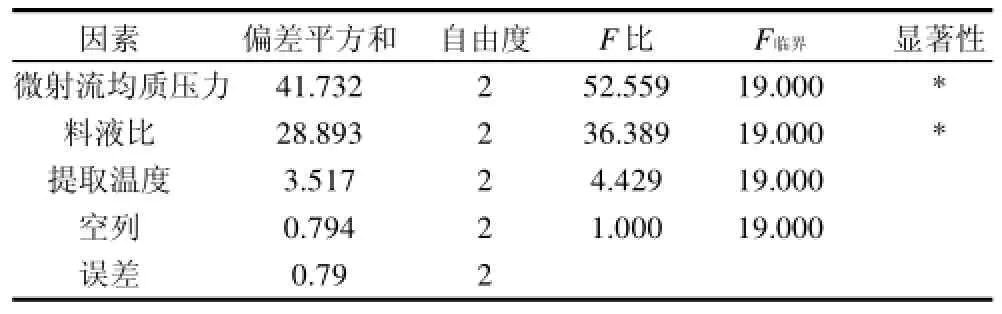
表3 正交试验方差分析表Table 3 ANOVA analysis of orthogonal experiments
由表2可知,各因素影响主次顺序为微射流均质压力>料液比>提取温度,提取条件的最优组合为A2B2C3,即微射流均质压力140MPa、料液比1:60(g/ mL)、提取温度90℃,此条件下多糖得率可达6.755%。表3中的方差分析表示,微射流均质压力和料液比对多糖得率影响显著(P<0.05)。
3 结 论
经动态超高压微射流预处理后的样品液,由于在反应腔内受到超高压微射流作用时的瞬间剪切、高速撞击、涡旋、瞬间压力降等作用力,固相颗粒粒度减小,细胞壁破裂,传质速度加快,在后续提取过程中,与未经此处理的样品相比较,在相同的提取时间、提取温度及料液比内,香菇多糖的提取效率均有增高;动态超高压微射流预处理的最佳条件为压力140MPa、料液比1:60(g/mL)、提取温度90℃,此条件下多糖得率最高,平均可达到6.755%。该研究可为动态超高压微射流在有效成分提取上的应用提供参考。
[1]KUPFAHL C, GEGINAT G, HOF H. Lentinan has a stimulatory effect on innate and adaptive immunity against murine Listeria monocytogenes infection[J]. International Immunopharmacology, 2006, 6(4): 686-696.
[2]CHIHARA G, HAMURO J, MAEDA Y Y, et al. Fractionation and Purification of the polysaccharides with marked antitumor activity, especially lentinan, from Lentinus edodes(Berk.) Sing, (an edible mushroom) [J]. Cancer research, 1970, 30: 2776-2781.
[3]ZHANG Yangyang, LI Sheng, WANG Xiaohua, et al. Advances in lentinan: isolation, structure, chain conformation and bioactivities[J]. Food Hydrocolloids, 2011, 25(2): 196-206.
[4]涂宗财, 王辉, 刘光宪, 等. 动态超高压微射流对卵清蛋白微观结构的影响[J]. 光谱学与光谱分析, 2010(2): 495-498.
[5]涂宗财, 姜颖, 陈钢, 等. 动态超高压微射流对花生球蛋白结构和功能性质的影响[J]. 食品工业科技, 2009, 30(12): 73-75.
[6]LIU Wei, LIU Jianhua, XIE Mingyong, et al. Characterization and highpressure microfluidization-induced activation of polyphenoloxidase from Chinese pear (Pyrus pyrifolia Nakai)[J]. Agricultural and Food Chemistry, 2009, 57(12): 5376-5380.
[7]LIU Wei, LIU Jianhua, LIU Chengmei, et al. Activation and conformational changes of mushroom polyphenoloxidase by high pressure microfluidization treatment[J]. Innovative Food Science and Emerging Technologies, 2009, 10: 142-147.
[8]TUNICK M H, Van HEKKEN D L, COOKE P H, et al. Effect of high pressure microfuidization on microstructure of mozzarella cheese[J]. Lebensm-Wiss u-Technol, 2000, 33(8): 538-544.
[9]LAGOUEYTE N, PAQUIN P. Effects of microfluidization on the functional properties of xanthan on the functional properties of xanthangum [J]. Food Hydrocolloids, 1998, 12: 365-371.
[10]DALGLEISH D G, TOSH S M, WEST S, et al. Beyond homogenization: the formation of very small emulsion droplets during the processing of milk by a microfluidizer[J]. Netherlands Milk and Dairy Journal, 1996, 50(2): 135-148.
[11]涂宗财, 王艳敏, 刘成梅, 等. 动态超高压微射流技术在玉米花粉多糖提取中的应用[J]. 食品工业科技, 2010(6): 212-214.
[12]WANG Xiaohua, XU Xiaojuan, ZHANG Lina. Thermally induced conformation transition of triple-helical lentinan in NaCl aqueous solution [J]. J Phys Chem, 2008, 112: 10343-10351.
[13]YAP A T, NG M L M. An improved method for the isolation of lentinan from the edible and medicinal shiitake mushroom, Lentinus edodes (Berk.)Sing.(Agaricomycetideae)[J]. International Journal of Medicinal Mushrooms, 2001, 3: 6-19.
[14]STAUB A M. Removal of proteins: sevag method[J]. Methods in Carbohydrate Chemistry, 1965, 5: 5-6.
[15]张惟杰. 糖复合物生化研究技术[M]. 杭州: 浙江大学出版社, 1999.
[16]谢红旗. 香菇多糖提取、纯化、结构表征及生物活性的研究[D].长沙: 中南大学, 2007.
Effect of Dynamic High-pressure Microfluidization Pretreatment on the Yield of Lentinan
JIANG Ying,TU Zong-cai*,CHEN Yuan,WANG Qiang,LI Zhi,YIN Yue-bin
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
In order to extend the application of dynamic high-pressure microfluidization technology, this technology was used to the pretreatment of mushroom fruit bodies. The optimal pretreatment conditions were explored by single-factor and orthogonal experiments through evaluating the yield of lentinan. Results indicated that the optimal pretreatment conditions were pretreatment pressure of 140 MPa and material-liquid ratio of 1/60. Under the optimal pretreatment conditions, the yield of polysaccharides was up to 6.755%. Compared with the control group, the extraction rate of polysaccharides was significantly improved.
dynamic high-pressure microfluidization;lentinan;pretreatment;extraction
TS201.1
A
1002-6630(2010)24-0062-04
2010-09-16
国家科技型中小企业技术创新基金项目(10C26213601888)
姜颖(1984—),女,硕士研究生,研究方向为天然产物提取分离。E-mail:maomao242424@126.com
*通信作者:涂宗财(1965—),男,教授,博士,研究方向为食品资源开发与利用。E-mail:tuzc_mail@yahoo.com.cn
