高效毛细管电泳法测定胭脂虫提取物中胭脂红酸
2010-03-23马李一郭元亨
李 坤,张 弘*,郑 华,马李一,赵 虹,郭元亨
(中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用重点实验室,云南 昆明 650224)
高效毛细管电泳法测定胭脂虫提取物中胭脂红酸
李 坤,张 弘*,郑 华,马李一,赵 虹,郭元亨
(中国林业科学研究院资源昆虫研究所,国家林业局资源昆虫培育与利用重点实验室,云南 昆明 650224)
建立高效毛细管电泳法(HPCE)测定胭脂虫提取物中胭脂红酸含量的方法以含5%乙腈、5%乙二醇的40mmol/L Na2HPO4-Na2B4O7·10H2O混合缓冲液(pH9.434)为背景电解质,60cm×75μm未涂层毛细管柱为分离泳道,分离电压20kV,0.5psi×10s压力进样,柱温25℃,检测波长239nm,此条件下,采用峰面积内标法定量;在选定的电泳条件下,胭脂红酸质量浓度在50~500mg/L范围内线性关系良好,线性相关系数R=0.9958,加标回收率为100.86%,方法检出限(RSN=3)为5.00μg/mL。本方法测定胭脂红酸含量试剂用量少,简便、快速、准确,可应用于实际生产中胭脂红酸的测定。
高效毛细管电泳;胭脂红酸;测定含量
胭脂虫(Dactylopius coccus Costa)原产于拉丁美洲,是一种寄生在仙人掌类植物上的经济性资源昆虫,其雌成虫干体可以提取一种珍贵的天然红色素——胭脂虫红色素[1]。该色素主要成分为胭脂红酸,又名洋红酸,属多羟基蒽醌类化合物。胭脂红酸对于光、热、微生物等有着良好的耐受性,尤其在酸性条件下可溶于热水等溶剂,在一定pH值条件下能呈现黄、橙、红、紫等多种艳丽色泽[2]。人类对胭脂红酸的利用有着悠久的历史,在古代人们就用它来做染料和口红等,随着现代科学技术的发展以及人类对它性质了解与开发的不断深入,它已经广泛应用于食品、化妆、医药等众多行业[3-5]。
高效毛细管电泳法是近年来发展起来的一种高效分离分析技术,是经典分离技术与现代微柱分离技术相结合的产物,具有高效、高灵敏度、进样少、低耗、快速、简便等特点[6]。基于这些特点,现在它已越来越多地应用于天然产物中活性物质和有效成分的分离与测定上[7],并显示出了较大的优越性。对于胭脂红酸分离检测的方法,目前液相色谱法和分光光度法已见报道[8-10],虽然国内对于胭脂红酸的高效毛细管电泳分离与检测的方法也有报道,但大多都局限地应用在食品、医药等行业的各类成型产品上[11];对于以胭脂虫为原料,采用现代提取工艺的胭脂红酸提取物的分离与含量的毛细管电泳测定方法,国内外还未见报道。本实验采用高效毛细管电泳方法,用二极管阵列检测器(DAD),以肉桂
酸为内标,建立胭脂虫天然提取物中胭脂红酸含量的测定方法,取得满意的效果,为实际生产中胭脂红酸的分离与检测提供参考。
1 材料与方法
1.1 材料与试剂
胭脂虫雌成虫干体,引自拉丁美洲,由中国林业科学研究院资源昆虫研究所滇中高原试验站提供。
胭脂红酸标准样品(纯度≥96%) 日本三荣源食品工业株式会社;肉桂酸(分析纯) 国药集团化学试剂有限公司;磷酸氢二钠、磷酸二氢钠(分析纯) 上海新华化工厂;硼砂(分析纯) 广东汕头新宁化工厂;硼酸(分析纯) 重庆川江化学试剂厂;碳酸钠、无水乙醇(均为分析纯) 天津市风船化学试剂有限公司;碳酸氢钠(分析纯) 成都市金山化工试剂厂;柠檬酸(分析纯)北京化工厂;柠檬酸纳(分析纯) 天津市致远化学试剂有限公司;乙腈(分析纯) 上海陆都化学试剂厂;乙二醇(分析纯) 天津市化学试剂三厂。
1.2 仪器与设备
Beckman P/ACETMsystem MDQ型高效毛细管电泳仪美国贝克曼-库尔特有限公司;熔融石英毛细管(60cm× 75μm) 河北永年光导纤维厂;PHS-3C精密pH计 上海精密科学仪器有限公司;AB204-S精密型电子天平Mettler Toledo中国有限公司;Prep/scale超滤系统、螺旋卷式再生纤维素膜(截留相对分子质量3k和5k)、螺旋卷式聚醚砜膜(截留相对分子质量10k和30k) 美国Millipore公司;SD1000型喷雾干燥仪 日本东京理化株式会社;Purelab Ultra 超纯水系统 英国ELGA公司。
1.3 样品前处理
称取100g胭脂虫干体,以水为溶剂进行提取后收集滤液[12],再经喷雾干燥制得粉末备用,所有溶液进样前均用0.45μm纤维素膜过滤。
1.4 实验条件
1.4.1 标准溶液和样品液的配制
精密称取胭脂红酸标准品0.1g溶于100mL容量瓶中,用超纯水定容配制质量浓度为1mg/mL标准品贮备液;精密称取肉桂酸标准品0.1g溶于100mL容量瓶中,用乙醇定容配制质量浓度为1mg/mL的内标物贮备液;分别移取内标物贮备液1mL和标准品贮备液0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0mL于10mL容量瓶中,配制内标物质量浓度均为0.1mg/mL、标准品质量浓度分别为0.05、0.1、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50mg/mL的标准溶液备用。
精密称取1.3节中制取的胭脂虫提取物样品0.1g溶于100mL容量瓶中,再分别移取2、3、4、5、6mL于10mL容量瓶中,超纯水定容,配制质量浓度依次为0.2、0.3、0.4、0.5、0.6mg/mL的胭脂红酸样品液备用。
1.4.2 电泳条件
采用未涂层石英毛细管60cm×75μm(有效长度50cm),分离电压20kV,分离时间20min,检测波长239nm,柱温25℃,0.5psi×10s压力进样,含5%乙二醇和5%乙腈的40mmol/L磷酸氢二钠-硼砂混合缓冲液,pH9.434。毛细管使用前依次用甲醇、水、0.1mol/L盐酸、1mol/L氢氧化钠、运行缓冲液冲洗2min,每两次样品运行之间,依次用水、0.1mol/L氢氧化钠、水、电泳缓冲液冲洗5、3、3、5min。
2 结果与分析
2.1 电泳条件的优化
2.1.1 电泳缓冲液的组成和浓度

图1 缓冲液中含5%乙腈和5%乙二醇时胭脂红酸的电泳谱图Fig.1 HPCE separation of carminic acid using a disodium hydrogen phosphate/borax buffer system containing 5% acetonitrile and 5% ethylene glycol
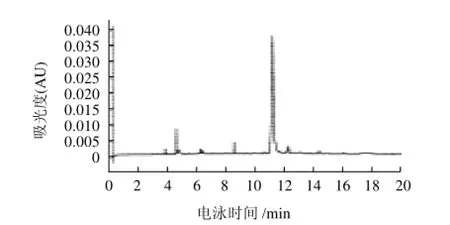
图2 缓冲液中不含添加剂的胭脂红酸的电泳谱图Fig.2 HPCE separation of carminic acid using a pure disodium hydrogen phosphate/borax buffer
由于胭脂红酸为多羟基的蒽醌类羧酸,其蒽醌母核上的羟基不仅具有弱酸性,在一定条件下还可以与缓冲液产生结合,故而缓冲液的组成和浓度对胭脂红酸的分离有着显著的影响,本实验考察了不同浓度的磷酸盐、硼砂、碳酸盐、柠檬酸盐及其混合缓冲体系对胭脂红酸分离效果的影响,结果表明,以40mmol/L Na2HPO4-Na2B4O7·10H2O混合缓冲液为基础电解质时,胭脂红酸保留时间较短,分离效果较好。此外,在选定背景电解质的基础上,还探索了SDS、β-环糊精、正丁醇,乙二醇,乙腈等添加剂对改善分离效果的影响,
如图1、2所示。对比图1、2不难看出,当加入5%乙二醇和5%乙腈时,样品分离度和拖尾现象均得到明显的改善,所以最终选定含5%乙二醇和5%乙腈的40mmol/L磷酸氢二钠-硼砂溶液作为缓冲体系。
2.1.2 缓冲液pH值的选择
在胭脂红酸的粗提样品中,蛋白质是主要的杂质之一,也是贮藏时引起其变质的最主要原因。由此可见,适当的pH值的选择对于分离其中的蛋白质或氨基酸至关重要,因为它不仅影响胭脂红酸的电离,同时对于调整蛋白质和氨基酸的等电点,达到良好的分离效果有着重要的影响。由于胭脂红酸母核上含有1个羧基和4个羟基,为使其较好的电离,应该选择中性或者碱性的缓冲液pH值。本实验探讨了pH值为7.0、7.5、8.0、8.5、9.0、9.434、9.523、9.828、10.0、10.5、11.0的40mmol/L磷酸氢二钠-硼砂缓冲液对分离效果的影响,结果表明,当pH9.434时分离效果最好,故选择pH9.434的缓冲液作为运行介质。
2.1.3 分离电压的选择
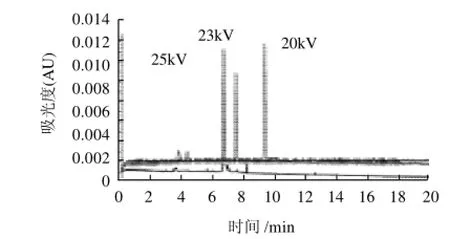
图3 分离电压≥20kV时的谱图对比Fig.3 Comparison among capillary electropherograms of carminic acid at three different separation voltages of more than 20 kV
在选定的缓冲液类型和pH值的条件下,考察了分离电压为10、15、18、20、23、25kV时对分离效果的影响。结果如图3、4所示,当分离电压大于20kV时,随着分离电压的增大,尽管保留时间相对缩短,但由于电渗流的增强,导致峰形拖尾明显,分离度降低;当分离电压小于20kV时,尽管峰形没有明显的差别,但保留时间延长。综合上述因素,故而选择20kV作为缓冲液分离电压为宜。

图4 分离电压≤20kV时的谱图对比Fig.4 Comparison among capillary electropherograms of carminic acid at three different separation voltages of less than 20 kV
2.1.4 检测波长的选择
以含5%乙二醇和5%乙腈的40mmol/L磷酸氢二钠-硼砂混合缓冲体系为参比,对5×10-4mol/L的胭脂红酸溶液进行紫外及可见光区全波长扫描,如图3所示,在紫外区239nm和302nm处有最大吸收,在可见光区534nm处有最大吸收,但肉桂酸醇溶液为无色,在可见光区并没有吸收峰,所以选534nm检测波长不合适;对比电泳谱图发现,当选择239nm作为检测波长时基线稳定、峰型较好,胭脂红酸与肉桂酸均有较强吸收,故以239nm作为检测波长。
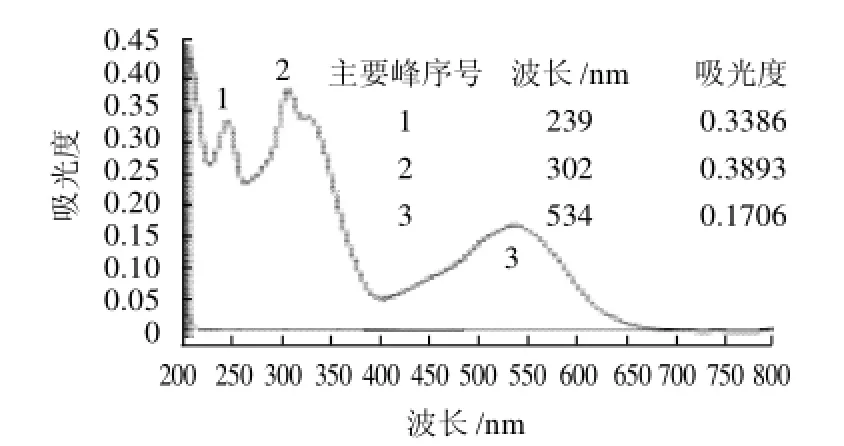
图5 以缓冲溶液为参比的胭脂红酸紫外-可见光区吸光度扫描图Fig.5 UV-visible scanning spectrum of carminic acid using a disodium hydrogen phosphate/borax buffer system containing 5% acetonitrile and 5% ethylene glycol as the reference
2.2 标准曲线的绘制
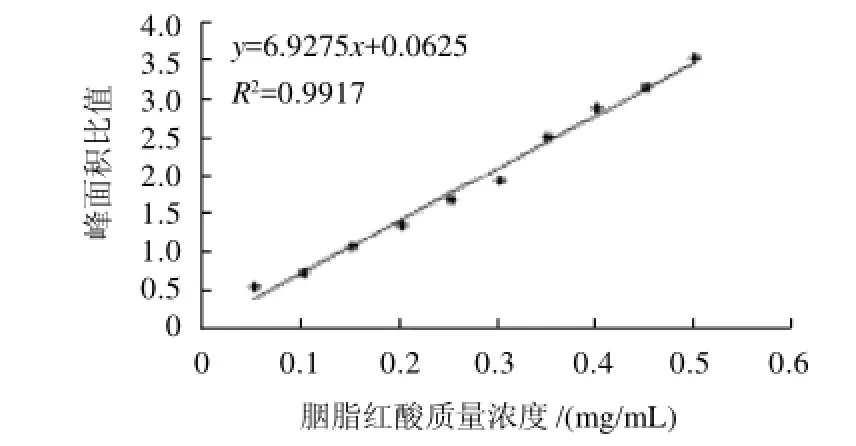
图6 高效毛细管电泳法测定胭脂红酸的标准曲线Fig.6 Standard curve of carminic acid determined by HPCE
分别取1.4.1节所配制的胭脂红酸质量浓度为0.05、0.10、0.15、0.20、0.25、0.30、0.35、0.40、0.45、0.50mg/mL的标准品溶液,按照1.4.2节选定的条件进样。以胭脂红酸和肉桂酸的峰面积比值为纵坐标,胭脂红酸浓度为横坐标进行线性回归,得标准曲线方程y=6.9275x+0.0625(R=0.9958)。
2.3 样品中胭脂红酸含量的测定
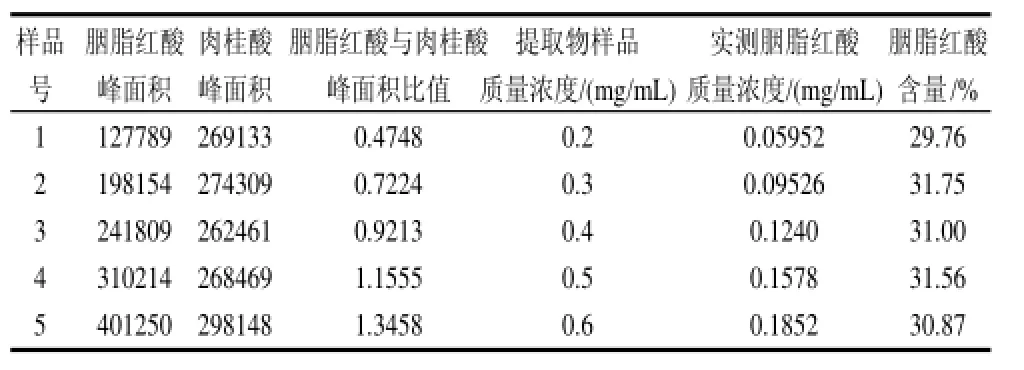
表1 胭脂红酸含量的定量分析结果Table 1 Quantitative determination of carminic acid
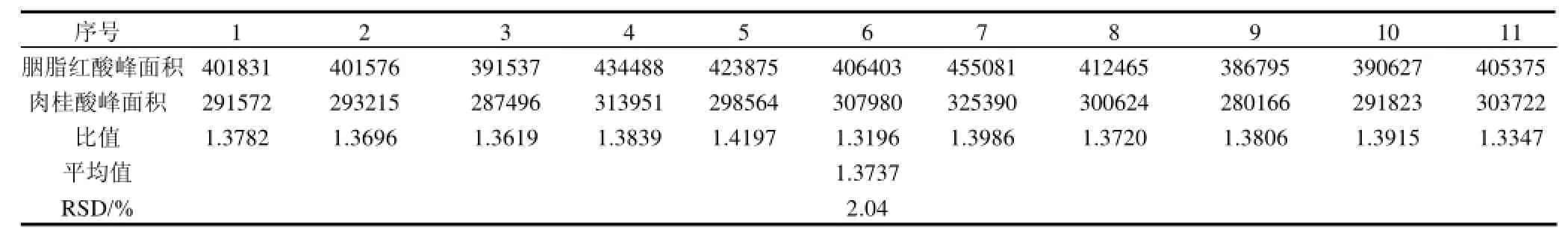
表3 胭脂红酸重现性的分析测定结果Table 3 Repeatability of determining carminic acid by HPCE
取1.4.1节中配制的胭脂红酸质量浓度依次为0.2、0.3、0.4、0.5、0.6mg/mL的样品液,按照1.4.2节的方法测定其在239nm条件下胭脂红酸与肉桂酸峰面积,按2.2中的标准曲线方程计算胭脂红酸的含量,结果见表1。
2.4 稳定性的测定
精确移取胭脂红酸样品液4mL和内标物贮备液1mL于10mL容量瓶中,超纯水定容。按1.4.2节的方法分别测定0、2、4、6、8、10、12、24、36、48h胭脂红酸与肉桂酸的峰面积,计算胭脂红酸与肉桂酸的峰面积比,RSD为0.97%,表明样品在48h内稳定,结果见表2。
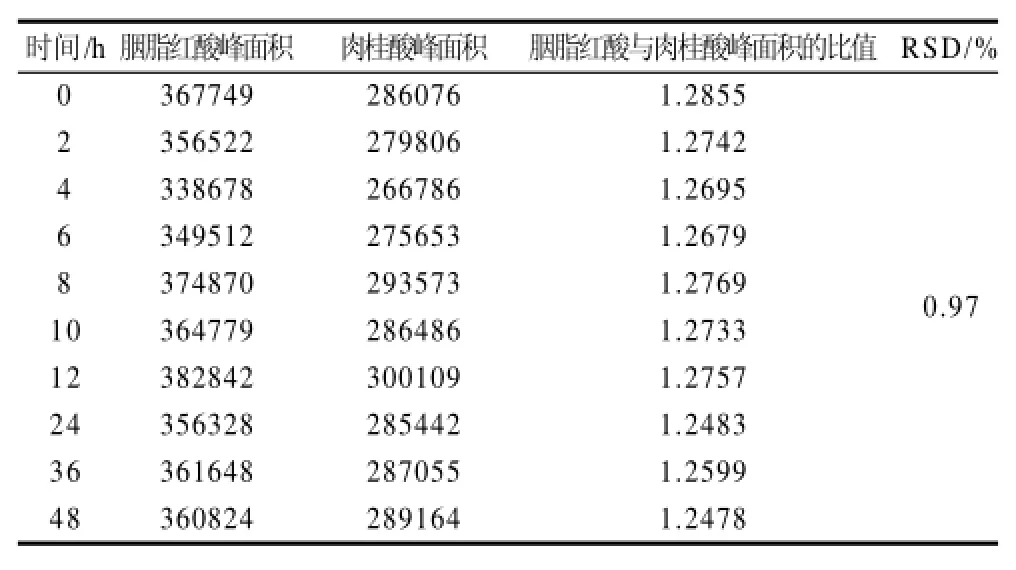
表2 胭脂红酸稳定性的分析测定结果Table 2 Stability of determining carminic acid by HPCE
2.5 重现性的测定
取1.4.1节的的标准品贮备液2.5mL和内标物贮备液1mL于10mL容量瓶中,用超纯水定容。按照1.4.2节的方法分别进样11次,数据如表3所示,测得胭脂红酸与肉桂酸的峰面积比值的RSD为2.04%,表明方法的重现性良好。
2.6 加标回收率
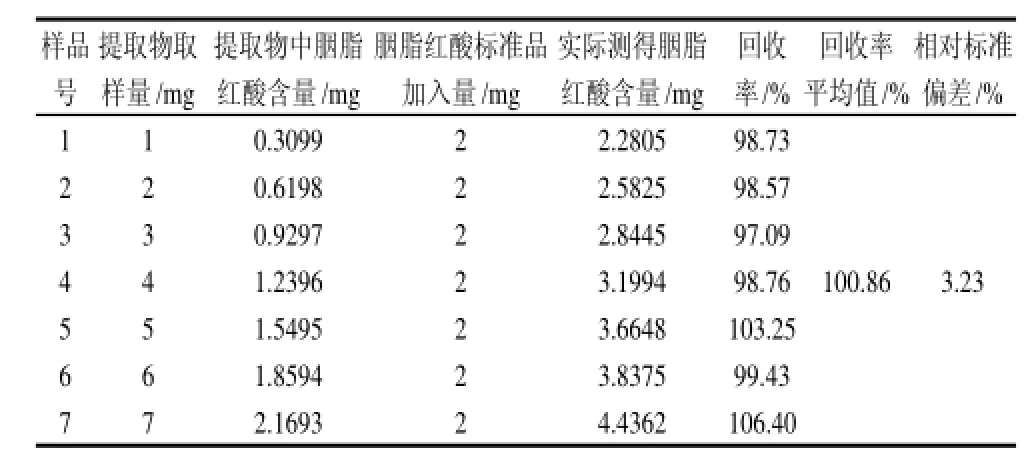
表4 不同浓度样品液中胭脂红酸的回收率Table 4 Average spike recovery rate of determining carminic acid by HPCE
取1.4.1节所配制的胭脂红酸样品贮备液1、2、3、4、5、6、7mL于10mL容量瓶中,并分别加入2mL标准品贮备液和1mL内标物贮备液,按照1.4.2节的方法进样,结果如表4所示。
3 结 论
3.1 建立了高效毛细管电泳测定胭脂虫提取物中胭脂红酸含量的方法,并对电泳条件进行了优化:在239nm检测波长、25℃柱温、0.5psi×10s进样条件下,以含5%乙腈-5%乙二醇的40mmol/L Na2HPO4-Na2B4O7·10H2O混合缓冲液(pH9.434)为背景电解质,60cm×75μm未涂层毛细管柱为分离泳道,实现了对胭脂虫天然提取物中有效成分胭脂红酸的直接有效地测定,方法稳定性、重现性良好,检出限为5.00μg/mL,回收率达到100.86%。
3.2 在进行胭脂红酸等天然提取物的毛细管电泳分离测定时,由于提取物中所含杂质的种类繁多、成分和含量大多未知,所以在选定背景电解质的基础上,应多尝试添加剂对分离效果的影响,往往能得到较好的效果。
[1]郑华, 唐莉英, 张弘, 等. 胭脂虫虫体主要化学组成分析[J]. 食品科学, 2008, 29(11): 510-513.
[2]张弘, 郑华, 陈军, 等. 胭脂虫色素稳定性研究[J]. 食品科学, 2008, 29(11): 59-64.
[3]张忠和, 石雷, 徐珑峰, 等. 世界胭脂虫的研究和利用状况[J]. 林业科学研究, 2002, 15(6): 719-726.
[4]夏明, 杜琪珍. 天然色素研究进展[J]. 食品研究与开发, 2002, 23(6): 38-41.
[5]孙锋, 杨月鹏, 曹红梅. 天然染料胭脂虫色素提取工艺的探讨[J]. 印染助剂, 2005, 22(8): 41-43.
[6]陈义. 毛细管电泳技术[M]. 北京: 化学工业出版社, 2000: 46.
[7]刘展眉, 熊绪杰, 吕钱江. 毛细管电泳及其在天然产物分离分析中的应用进展[J]. 仲恺农业技术学院学报, 2002, 15(3): 59-65.
[8]许元红, 唐亚军, 吴明嘉. 毛细管电泳内标法测定糖果中胭脂红酸[J]. 分析测试学报, 2007, 26(1): 136-138.
[9]ORSKA-GAWRYS J, SUROWIEC I, KEHL J, et al. Identification of natural dyes in archeological Coptic textiles by liquid chromatography with diode array detection[J]. J Chromatogr A, 2003, 989: 239-248.
[10]LANCASTER F E, LAWRENCE J F. High-performance liquid chromatography with diode array detection[J]. J Chromatogr A, 1996, 732: 394-398.
[11]王茜, 王广增. 毛细管电泳技术在食品添加剂分析中的应用[J]. 华北煤炭学院学报, 2006, 8(4): 482-484.
[12]张弘, 卢艳民, 郑华, 等. 水溶法提取胭脂虫红色素工艺及优化[J].食品科学, 2009, 30(16): 115-118.
Determination of Carminic Acid Content in Cochineal Extract by High Performance Capillary Electrophoresis
LI Kun,ZHANG Hong*,ZHENG Hua,MA Li-yi,ZHAO Hong,GUO Yuan-heng
(Key Laboratory of Cultivation and Utilization of Resource Insects, State Forestry Administration, Research Institute of Resource Insects, Chinese Academy of Forestry, Kunming 650224, China)
A method for determining the content of carminic acid in cochineal extract was established using high performance capillary electrophoresis (HPCE). All experiments were carried out on an uncoated capillary column (60 cm × 75 μm, i.d.) under 20 kV and 0.5 psi × 10 s injection pressure at 25 ℃. The detection wavelength was set at 239 nm. Internal calibration method was used for quantification. Under all selected conditions, a good linear relationship of carminic acid was observed over the range of 50 to 500 mg/L, with a linear correlation coefficient of 0.9958. The average recovery rate of carminic acid in 7 parallel cochineal extracts spiked at a level was 100.86% and the detection limit was 5.00 μg/mL. This method is simple, rapid, accurate and can provide a reference for actual production.
high performance capillary electrophoresis (HPCE):carminic acid;content determination
TS202.3;O657.8;S899.3
A
1002-6630(2010)18-0355-04
2010-06-22
国家林业科技成果推广项目([2010]11);科技部农业科技成果转化资金项目(2010GB24320619)
李坤(1987—),男,硕士研究生,主要从事天然资源化学与利用研究。E-mail:langyue1987@163.com
*通信作者:张弘(1963—),男,研究员,学士,主要从事林业生物资源化学与利用研究。E-mail:kmzhhong@163.com
