高效液相色谱法对挂面中食用合成色素的测定
2010-03-23范会平秦学磊
符 锋,范会平*,秦学磊
(1.河南省粮油饲料产品质量监督检验站,河南 郑州 450008;2.河南农业大学食品科学技术学院,河南 郑州 450002)
高效液相色谱法对挂面中食用合成色素的测定
符 锋1,范会平2,*,秦学磊1
(1.河南省粮油饲料产品质量监督检验站,河南 郑州 450008;2.河南农业大学食品科学技术学院,河南 郑州 450002)
通过添加木瓜蛋白酶和α-淀粉酶水解挂面中淀粉和蛋白质,减少淀粉和蛋白质在提取过程中对合成色素的吸附,以研究适合于挂面中食用合成色素的测定方法。结果表明:在加酶的情况下,色素回收率显著提高,并随着加酶种类和含量的不同,色素回收率也有所不同,α-淀粉酶和木瓜蛋白酶组成的复合酶制剂的添加效果优于单一酶制剂。复合酶添加量α-淀粉酶为2%、木瓜蛋白酶为2.5%时,5种色素柠檬黄、苋菜红、胭脂红、日落黄、亮蓝加标回收率均在80%以上,较对照组有显著提高。
高效液相色谱;挂面;合成色素;木瓜蛋白酶;α-淀粉酶
世界各国对食用色素的品种、使用范围和使用量都有严格限制[1]。我国到2004年5月共准许使用11种合成色素,而面制品中则不允许添加合成色素[2-3]。近年来,随着各种花色挂面产品的不断开发,一些不法商贩以食品合成色素替代花色挂面中的蔬菜汁原料,以牟取暴利。
色素的测定方法有紫外-可见分光光度法[4]、薄层层析法[5]、示波极谱法[6]、HPLC法[7-9]等。色素提取操作步骤是关键性操作,要求提取后得到的待测溶液,尽可能不含杂质或含极微量不影响测定的杂质,以减少杂质对检测结果的干扰,并且要求在提取过程中尽可能避免色素的损失[10]。目前只有冷饮、配制酒和硬糖等基质简单的食品色素的国标[11]测定方法,目前尚没有专门针对面制品中食用合成色素的测定方法。
木瓜蛋白酶具有耐高温、活性强、稳定性好、蛋白质水解能力强等特征,是能作用于各类蛋白质的纯天然产物[12],广泛应用于食品、饮料、啤酒、化学、纺织等行业,如用木瓜蛋白酶处理中药材,可促进中药成分的煎出[13]。淀粉酶属于水解酶的一种,其中α-淀粉酶将淀粉长链分子水解成短链分子时,以无规则的方式切断淀粉大分子内部的α-1,4甙键而使淀粉生成糊精、低聚糖等,在我国产量较大,广泛应用于食品、酿造、制药和纺织等领域[14]。蛋白酶和淀粉酶的混合酶制剂也广泛用于工业生产中,以改善工艺、降低成本,谌国莲等[15]采用混合酶制剂用于荔枝汁的澄清。
由于面粉中蛋白质、淀粉含量较高,在提取色素过程中,色素容易被蛋白质、淀粉吸附,使得在检测过程中很难准确计算其中色素的实际含量。因此,开发适宜于面制品中食品合成色素的检测方法显得尤为重要。本研究采用加酶法水解面制品中蛋白质、淀粉以减少其对色素的吸附,再采用高效液相色谱方法进行色
素含量的测定,以期找出适合于面制品中食用合成色素的测定方法。
1 材料与方法
1.1 材料与试剂
挂面 市售。
色素标准溶液 国家标准物质中心;木瓜蛋白酶(≥50万IU) 北京索莱宝科技有限公司;α-淀粉酶(≥4000IU) 北京奥博星生物技术有限责任公司;甲醇(色谱纯);聚酰胺粉(200目);二级水(电导率≤0.10mS/m,25℃);甲醇-甲酸混合溶液(6:4,V/V);无水乙醇-氨水-水混合溶液(7:2:1,V/V);柠檬酸溶液木瓜蛋白酶溶液(0.01g/mL,最适温度为70℃,最适pH值为5~7);α-淀粉酶溶液(0.01g/mL,最适温度为65℃,最适pH值为5~7);质量分数为20%的柠檬酸溶液;体积分数为36%的乙酸溶液。
1.2 仪器与设备
1100高效液相色谱仪 安捷伦公司;BS224S电子天平 北京赛多利斯有限公司;DZKW-4型电热恒温水浴锅、FW-100高速万能粉碎机 北京中兴伟业仪器有限公司;TDC-40B离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 样品前处理
取适量的挂面经磨粉机磨后待用。取100g挂面粉加入1mL色素标液(0.5mg/mL)溶液,充分混合后晾干,将晾干后的挂面粉放入磨粉机磨碎,得到含色素为5μg/g的加标挂面粉,装入样品瓶中待测。
1.3.2 样品提取
称取5g(精确到0.01g)加标样品,放入100mL的锥形瓶中加一定体积的酶溶液,用20%柠檬酸调pH6,补加水至50mL,将锥形瓶放入65℃水浴锅中加热15min,然后将试液放入离心机,于2000r/min离心5min取上清液移入150mL锥形瓶中,将离心后的残渣用少量水洗2~3次,所得水洗液合并入150mL锥形瓶中。将依法制成的样品溶液调pH6,放入水浴锅中加热到60℃,将1g聚酰胺粉加少量水调成糊状,倒入样品溶液中,搅拌片刻,以G3垂融漏斗抽滤,用60℃ pH4的水洗涤3~5次,然后用甲醇-甲酸溶液洗涤3~5次,再用水洗至中性。用乙醇-氨水-水混合溶液解吸3~5次,每次3mL,收集解吸液,用36%乙酸溶液调节至中性,水浴加热至近干。加水定容至5mL。经0.45μm微孔滤膜过滤,取10μL在高效液相色谱仪上进行测定[11]。
1.3.3 样品测定
样品测定参照GB/T 5009.35—2003《食品卫生检验方法理化部分(一)》[11]食品中合成色素的检验方法。
色谱柱:YWG-C1810μm不锈钢柱:4.6mm(i.d)× 250mm,柱温为40℃;流动相:甲醇、乙酸铵溶液(0.02mol/L);梯度洗脱:甲醇体积分数在0~5min为20%~35%(3%/min),5~12min为35%~98%(9%/min),12~18min为98%,18.01~30min为20%。流速:1mL/min;紫外线检测器,254nm波长测定。
取相同体积样液和合成色素标准液分别在高效液相色谱仪上测定,根据保留时间定性,外标峰面积法定量。
2 结果与分析
2.1 方法的分离效果、线性关系

图1 5种食用合成色素混标高效液相色谱图Fig.1 HPLC chromatogram of mixed five synthetic food pigments standards
图1 为在1.3.3节色谱条件下,5种食用合成色素混合标准品的分离效果,可以看出,5种色素在设定的色谱条件下,分离效果良好。以5种色素的峰面积(Y)对质量浓度(X)绘制标准曲线,得到的标准曲线方程、线性范围、检出限和相关系数见表1。结果表明,5种常用食用合成色素标准曲线线性关系良好。
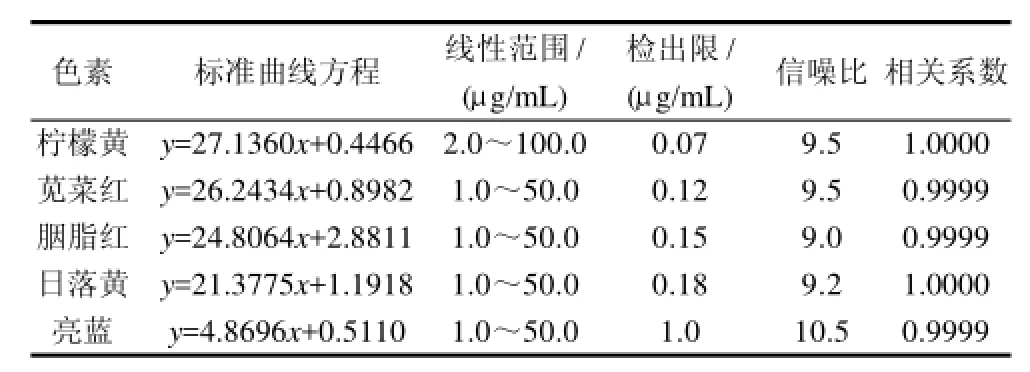
表1 5种食用合成色素标准曲线方程(n=5)Table 1 Standard curve equations and their figures of merit of 5 synthetic food pigments (n=5)
2.2 色素提取条件
在测定挂面中食用合成色素时,由于色素容易被蛋白质、淀粉所吸附,从而不能够准确检测合成色素的实际含量。本实验采用酶法分解蛋白质、淀粉以减少其对色素的吸附作用,较好地解决了面制品中色素提取回收率较低的问题,以加入胭脂红为例进行讨论。
2.2.1 α-淀粉酶对色素提取的影响
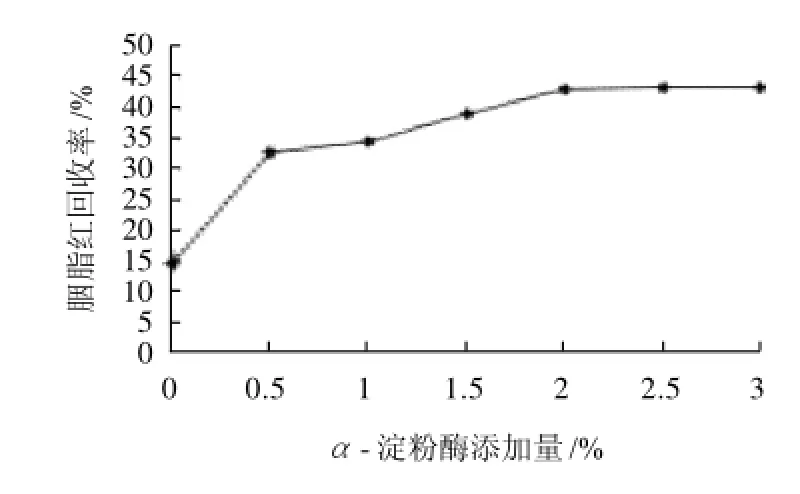
图2 α-淀粉酶添加量对胭脂红回收率的影响Fig. 2 Effect ofα-amylase amount on the recovery of carmine
由图2可知,当单独加入α-淀粉酶时,该酶可分解挂面中的淀粉,从而减少了淀粉对色素的吸收;当α-淀粉酶的添加量(均以试样为100%计)由0增加到3.0%时测得的胭脂红含量随着酶添加量的增多而变化,当酶添加量为2%时,胭脂红回收率为43.30%,当酶添加量大于2%时,随酶添加量的增加胭脂红的回收率无显著变化。根据添加量最少,提取效果最佳的原则综合分析,可知当酶添加量2%时较为适宜。
2.2.2 木瓜蛋白酶对色素提取的影响

图3 木瓜蛋白酶添加量对胭脂红回收率的影响Fig.3 Effect of papain amount on the recovery of carmine
由图3可知,当单独加入木瓜蛋白酶时,该酶可分解挂面中的蛋白质,使得蛋白质对色素的吸附明显减少;当木瓜蛋白酶的添加量(均以试样为100%计)由0增加到3.0%时,胭脂红的提取回收率随着酶添加量的增加而增大,当酶添加量2.5%时,胭脂红回收率达到68.98%,随酶添加量的进一步增大,胭脂红的回收率略有上升,但变化不大。综合考虑酶添加量和提取效果两种因素,可知酶添加量为2.5%时效果较好。
2.2.3 复合酶对色素提取的影响
在考虑单独加入一种酶对实验的影响后,再考虑加入α-淀粉酶和木瓜蛋白酶共同作用对面制品中色素测定效果的影响,由于已确定加入2%淀粉酶和2.5%蛋白酶可达到较理想效果,因此在考虑添加复合酶时,选择在添加2%淀粉酶和2.5%蛋白酶附近几个点进行实验。
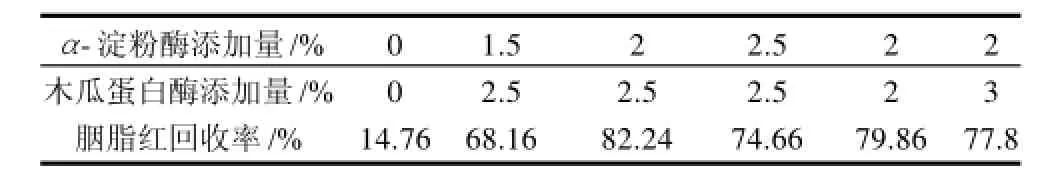
表2 复合酶添加量对胭脂红回收率的影响Table 2 Effect of combined use of papain and α-amylase on the recovery of carmine
由表2可知,添加α-淀粉酶和木瓜蛋白酶复合酶比单独添加其中一种酶的效果更好,两种酶共同添加更好地减少了蛋白质和淀粉对色素的吸附,故胭脂红的回收率明显提高;当添加α-淀粉酶2%、木瓜蛋白酶2.5%时,测得的胭脂红含量最多,而酶空白处理对照中胭脂红的回收率仅为14.76%。由此可知,用酶分解法对挂面粉前处理,对挂面中食用合成色素的检测有良好效果,其中复合酶的作用效果优于单一酶,且由2.2.1节和2.2.2节可以看出,蛋白酶在减少样品中色素吸附中起着更为主要的作用。酶的添加量为α-淀粉酶2%、木瓜蛋白酶2.5%时,复合酶的作用效果最好,胭脂红的回收率达到80%以上。
2.35 种色素的回收率测定
将添加有5种色素标样的挂面粉采用复合酶添加量为α-淀粉酶2%、木瓜蛋白酶2.5%(进行前处理,再按照1.3.2节方法对酶解后的样品提取液进行吸附,解吸处理。取样液5μL注入高效液相色谱仪中检测,加标回收率如表3所示。

表3 5种色素加标回收率测定结果Table 3 Spike recoveries of five synthetic food pigments
由表3可知,对柠檬黄、苋菜红、胭脂红、日落黄、亮蓝5种色素做加标回收率实验时,测得5种色素的检测结果有所不同,但是这5种色素的回收率均在80%以上,基本满足面制品中食用合成色素测定要求。
3 结 论
本实验采用酶法水解挂面粉中的蛋白质和淀粉,以减少它们在提取过程中对合成色素的吸附。结果表明,复合酶添加量α-淀粉酶为2%、木瓜蛋白酶为2.5%时,5种色素柠檬黄、苋菜红、胭脂红、日落黄、亮蓝加
标回收率均在80%以上。本研究较好的解决了挂面中色素提取效率过低的问题,为挂面中食品合成色素的检测方法的建立提供了较好的理论依据和实践指导。
[1]郑毅, 张宜友, 刘淳. 食品中合成色素检验技术[J]. 中国卫生检验杂志, 2000, 10(6): 663-667.
[2]GB 2760—1996食品添加剂使用卫生标准[S].
[3]中华人民共和国卫生部公告. 2004年第6号[B]. 2004-04-12.
[4]李必斌, 张海霞, 潘连富. 紫外-可见吸收光谱法定性定量测定食用合成色素[J]. 中国卫生检验杂志, 2001, 11(1): 58-60.
[5]丁来欣, 陈里. 薄层色谱法分离测定辣椒红色素中的辣椒红[J]. 色谱, 1995, 13(4): 295-296.
[6]文君, 缪红, 范柯. 示波极谱法测定食品中人工合成色素赤藓红[J].食品研究与开发, 2001, 22(3): 63-64.
[7]刘丽珍, 徐晓枫, 杨剑业, 等. 高效液相色谱等梯度测定食品中柠檬黄、苋菜红、胭脂红、日落黄[J]. 医学动物防制, 2007, 23(2): 101-102.
[8]刘奋, 林奕芝, 戴京晶, 等. 高效液相色谱多波长测定人工合成着色剂[J]. 现代预防医学2001, 28(1): 81-82.
[9]陈晓红, 李小平, 姚浔平. 高效液相色谱-质谱联用法测定饮料中人工合成色素的研究[J]. 中国卫生检验杂志, 2005, 15(8): 941-942.
[10]郑毅, 王克利, 李明元. 食品中合成色素的检验技术新编(连载一) [J].口岸卫生控制, 2005, 10(4): 45-45.
[11]GB/T 5009.35—2003食品卫生检验方法理化部分(一)[S]. 北京: 中国标准出版社, 2003.
[12]乙引, 张显强, 唐金刚, 等. 木瓜蛋白酶的纯化和性质[J]. 贵州师范大学学报: 自然科学版, 2002, 20(1): 11-14.
[13]曾惠芳, 苏子仁, 肖省娥, 等. 木瓜蛋白酶对补骨脂有效成分煎出的影响[J]. 时珍国医国药, 1998, 40(9): 312-313.
[14]赵其明. α-淀粉酶在浆料助剂和淀粉预处理中的应用[J]. 印染助剂, 2003, 20(5): 34-36.
[15]谌国莲, 陈穗, 孙远明, 等. 混合酶在澄清荔枝汁中的应用研究[J].食品工业科技, 2001, 22(2): 32-34.
HPLC Determination of Synthetic Food Pigments in Dried Noodles
FU Feng1,FAN Hui-ping2,*,QIN Xue-lei1
(1. Henan Station for Supervision and Inspection of Grain, Oil and Feed Product Quality, Zhengzhou 450008, China;2. College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, China)
A HPLC method was established to determine synthetic food pigments in dried noodles. Papain hydrolysis for protein removal and α-amylase for starch removal from dried noodles were done in case of their adsorption to pigments during extraction. Pigment recovery was significantly improved due to the use of enzymatic hydrolysis. Both enzyme kind and amount made a difference to pigment recovery. Combined treatment with papain and α-amylase was more efficient than single treatment with either of them. When 2% α-amylase and 2.5% papain were used together, the recoveries of five pigments, i.e., lemon yellow, amaranth red, carmine, sunset yellow and bright blue, were all above 80%, which were significantly higher than that of control.
HPLC;dried noodle products;synthetic food pigment;papain;α-amylase
TS202.3
A
1002-6630(2010)18-0325-04
2010-06-04
符锋(1973—),男,工程师,本科,主要从事粮油饲料产品的检验监督研究。E-mail:690853526@qq.com
*通信作者:范会平(1972—),女,讲师,博士,主要从事农产品加工研究。E-mail:fanhuiping1972@hotmail.com
