鱿鱼肝脏蛋白水解液及ACE抑制肽的制备
2010-03-23裘晓华林娅萍
谢 超,林 琳,裘晓华,林娅萍
(浙江海洋学院食品与药学学院,浙江 舟山 316000)
鱿鱼肝脏蛋白水解液及ACE抑制肽的制备
谢 超,林 琳,裘晓华,林娅萍
(浙江海洋学院食品与药学学院,浙江 舟山 316000)
为高效利用鱿鱼及其下脚料肝脏蛋白水解物,采用酶解技术和凝胶过滤分离等技术对鱿鱼肝脏蛋白水解液中抑制肽进行研究。结果表明:胃蛋白酶为鱿鱼肝脏蛋白水解的最佳酶类,同时以水解度和ACE抑制活性为指标,得出胃蛋白酶水解的最佳条件:在36℃条件下酶解22h,酶与底物的质量比2%,底物质量分数2.5%。经过上述条件处理的水解液再经超滤处理(截留分子质量为20kD)后,用Sephadex G-50进行分离,洗脱得到5个峰,其中组分B的ACE抑制活性最高,其半抑制浓度(IC50)达到1.80mg/mL。
鱿鱼肝脏蛋白;酶解液;ACE抑制肽
鱿鱼加工过程中有约占鱿鱼体质量30%的头、足、肝脏及表皮等废弃物产生。对于这些废弃物,一般的处理方法是加工鱼粉,或者掩埋,这不但是对渔业资源的巨大浪费,而且还存在着环境污染的问题[1-3]。在国外,如西班牙和日本对于鱿鱼肝脏的利用采用自身酶解发酵法生产鱿溶浆、鱿鱼粉等作为鱼类饲料。在国内鱿鱼肝脏的利用和研究还有比较大的发展空间,目前仅有鱿鱼肝脏干粉的加工,并且是用作饲料,技术水平不高[4-5]。
目前,已有从鱿鱼皮制备胶原蛋白活性肽,产品具有很强的生物活性,可用于制备抗氧化、降血压、抗动脉粥样硬化的保健食品或药品,但均是从鱿鱼皮中提出来的。通常ACE抑制肽的生产方法有以下几种:一是从生物体中分离各类天然ACE抑制肽;二是通过酶制剂水解蛋白质获得;三是利用分子生物技术合成抑制肽。当前水解蛋白质生成ACE抑制肽因其安全性高、水解过程容易受控制、并且水解条件比较温和等特点,被广泛应用在ACE抑制肽的生产中[6-7]。同时水解酶类是酶解法生产抑制肽的关键环节,目前广泛使用的蛋白酶类有碱性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶等。本研究的目的是从废弃的鱿鱼肝脏中提取蛋白质和生物活性肽——ACE(血管紧张素转换酶)抑制肽,制备消化吸收效率更高的蛋白质水解产物,而且制备的生物活性肽还可应用于疾病的防治,用于食品与医药行业,为维护人类的健康作贡献[8-14]。
1 材料与方法
1.1 材料、试剂与仪器
冷冻秘鲁鱿鱼(解冻后取其肝脏,-18℃冷冻保存)市购。胃蛋白酶(1000IU/g)、中性蛋白酶(100000IU/g)、木瓜蛋白酶(1000000IU/g)、风味蛋白酶(1000IU/g)、复合蛋白酶(10000IU/g)、胰蛋白酶(2000IU/g) 广西南宁庞博生物有限公司。CF16RX高速冷冻离心机、U-2800紫外检测仪、AL104分析天平、LC600反相高效液相色谱仪 日本日立公司、Labscale TFF超滤装置 美国伯乐公司。
1.2 鱿鱼肝脏蛋白的制备
将适量鱿鱼冷冻肝脏按照质量比1:2加水,充入氮气10min,并加入0.1%的L-抗坏血酸-6-棕榈酸酯防止其氧化,再将其放入高压锅中(121℃,0.2MPa)加热20min,然后在6000r/min条件下离心25min左右,去掉最上层的鱼油层。用丙酮洗涤,真空干燥后既得脱脂鱿鱼肝脏蛋白。
1.3ACE抑制活性的测定
ACE抑制活性的测定借鉴Cushman等的方法[15]。首先用含608mmol/L NaCl的0.2mol/L硼酸盐缓冲液(pH8.3)将底物Hip-His-Leu配成7.6mmol/L的溶液。然后在0.5mL的Eppendof管中分别加入5μL样品或硼酸缓冲液和15μL ACE(60mU/mL)在37℃静置5min,再加入25μL底物反应25min,最后加入5μL 0.1%三氟乙酸(TFA)溶液,终止反应后自然冷却。最后应用反相高效液相色谱测定ACE与底物反应生成马尿酸的量,以此判断对ACE的抑制活性。ACE活性抑制50%时所需要的抑制剂的浓度称为IC50。

1.4 鱿鱼肝脏蛋白的水解
1.4.1 蛋白水解液标准曲线
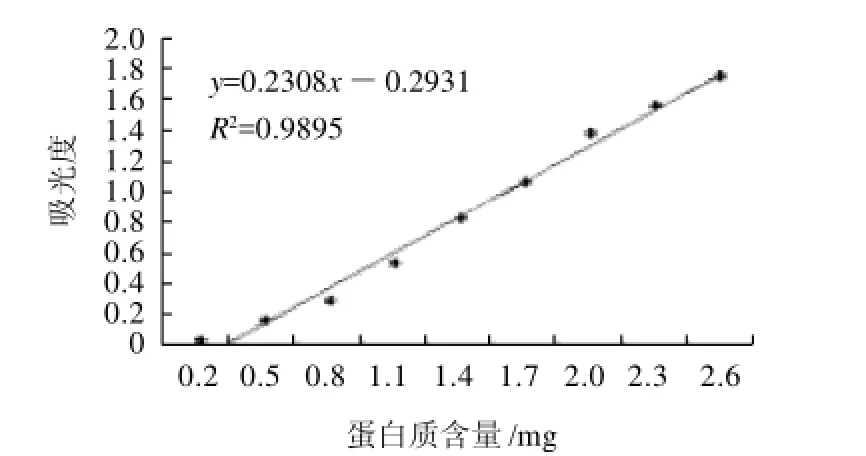
图1 蛋白水解液标准曲线Fig.1 Standard curve of protein
取完全酶解液0.2~2mL于比色管中,用蒸馏水稀释至4mL,加pH8的磷酸盐缓冲液1mL,茚三酮溶液1mL,沸水浴加热15min,冷却,用蒸馏水稀释至25mL。360nm波长处测吸光度。以蒸馏水为参比,另取25mg蛋白质,加水25mL,振荡均匀后过滤,取相应体积的滤液,按上述方法测吸光度,其与相同体积样品的吸光度之差对蛋白质含量做工作曲线,见图1。由图1可以看出,蛋白质含量与吸光度呈线性关系,线性方程为y=0.2308x-0.2931,相关性R2=0.9895。
1.4.2 鱿鱼肝脏蛋白酶解液水解度的测定
首先取水解后灭酶的水解液1mL,用蒸馏水稀释至100mL,经过滤,取滤液2.5mL,再加水至4mL,加pH8缓冲溶液1mL,茚三酮1mL,以沸水浴加热15min,冷却后再用蒸馏水稀释至25mL,用以于280nm波长处测吸光度。
以蒸馏水做对比,取相同浓度未水解蛋白溶液2mL,按以上方法测吸光度,以二者吸光度之差从工作曲线上查蛋白质含量,计算水解度(DH):
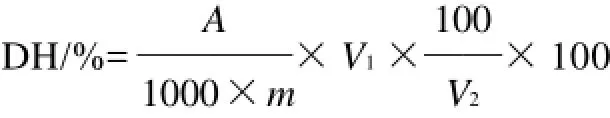
式中:A为查表得蛋白质质量/mg;m为称样质量/g;V1为水解液总体积/mL;V2为显色时所用稀释液体积/mL。
1.4.3 鱿鱼肝脏蛋白酶制剂的筛选
用胃蛋白酶、木瓜蛋白酶、复合蛋白酶、胰蛋白酶、中性蛋白酶、风味蛋白酶进行酶解比较。在相同的鱿鱼肝脏蛋白溶液中加入2%的各种蛋白酶制剂,维持恒温,在各种酶最适合的pH值条件下水解22h。酶解后将溶液pH值调为中性,离心过滤,上清液即为鱿鱼肝脏蛋白酶解液。测定酶解液的ACE抑制活性,根据抑制ACE活性的来确定所用蛋白酶制剂。
1.4.4 胃蛋白酶酶解条件的优化研究
1.4.4.1 酶与底物质量比的优化
在温度37℃、pH2.0、底物质量分数2.5%、酶与底物的质量比分别为0%、0.5%、1.0%、2%、5%条件下水解22h,测定酶解液的水解度和对ACE的抑制活性。
1.4.4.2 底物质量分数的优化
在温度36℃、pH2.0、酶与底物质量比2%、底物质量分数分别在1%、2.5%、5.0%、7.5%、10%条件下水解22h,测定酶解液的水解度和对ACE的抑制活性。
1.4.4.3 酶解时间的优化
在温度36℃、pH2.0、以酶与底物质量比2%、底物质量分数2.5%的条件下,处理时间分别为2、7、12、17、22、27、32h,测定酶解液的水解度和对ACE的抑制活性。
1.5 鱿鱼肝脏蛋白酶解液的制备
将脱脂肝脏蛋白,按照体积比1:2的比例加入去离子水,用胃蛋白酶酶解22h,条件为温度36℃、pH2.0、底物质量分数2%。随后在90℃条件保持20min终止酶解,冷却后以超滤膜过滤除去分子质量高于20kD的产物。收集水解产物,以4℃条件保存待用。
1.6 ACE抑制肽的分离及其ACE抑制活性分析
1.6.1 鱿鱼肝脏蛋白酶解液的超滤处理
超滤装置连接好后,用恒流泵将鱿鱼肝脏蛋白的酶解液在室温下压入截留分子质量20kD的滤膜,收集小分子滤液。截留液用蒸馏水适当稀释后继续超滤,将合并收集的超滤液进行冷冻干燥待用。
1.6.2 用Sephadex G-50分离ACE抑制肽
取超滤后冻干样品溶解,用Sephadex G-50分离ACE抑制肽,并测定各肽的ACE的抑制活性。将适量超滤冻干样品配成溶液,用Sephadex G-50凝胶柱对其进行分离,再用蒸馏水进行洗脱,流速24滴/min,在波长280nm处测定各肽的ACE的抑制活性。
2 结果与分析
2.1 鱿鱼肝脏脱脂蛋白的制备结果
将鱿鱼肝脏中的鱼油分离后,鱿鱼肝脏蛋白中还含有一定量的脂肪。脂肪的存在会对产品的色泽、风味产生不良影响,且易造成水解液浑浊。为了消除这些不良影响,实验采取丙酮浸提法。经过丙酮浸提3~5次后,得到脱脂后的鱿鱼肝脏蛋白。计算得率约为18%。
2.2 蛋白酶制剂的筛选
将各种蛋白酶处理鱿鱼肝脏蛋白。检测各种酶制剂所得酶解产物的ACE抑制活性,结果见表1。

表1 各种酶解液的ACE抑制活性Table 1 Effect of protease type on the ACE inhibitory activity of the hydrolysate
从表1可以看出,用胃蛋白酶、复合蛋白酶和中性蛋白酶酶解后的溶液ACE抑制活性较高。通过测定这3种酶解液的水解度,分别为胃蛋白酶酶解液24.6%、复合蛋白酶酶解液20.8%、中性蛋白酶酶解液22.2%。根据ACE抑制活性和水解度的大小,选择酶解液水解度最高、ACE抑制活性较高的胃蛋白酶作为生产酶制剂。
2.3 胃蛋白酶酶解鱿鱼肝脏蛋白的优化
2.3.1 底物质量分数对蛋白酶解效果的影响

图2 底物质量分数对水解度和ACE抑制活性的影响Fig.2 Effect of substrate concentration on the degree of hydrolysis and ACE inhibitory activity of the hydrolysate
当胃蛋白酶底物质量分数在1%~2.5%时,其值增加有利于反应速度的升高,导致水解度的上升(图2)。但当底物质量分数在2.5%~10%时,伴随着底物质量分数的升高,蛋白水解度反而呈下降的趋势。可能是由于底物质量分数较大时,在不断受热情况下,蛋白质分子产生交联聚合现象。导致蛋白酶分子与底物蛋白分子之间的接触机会减少,影响酶解反应的速度,从而导致水解度下降。同时,实验结果表明:底物质量分数的变化对抑制ACE活性的影响变化不大,因此,通过综合考虑选用2.5%为蛋白水酶解反应的底物质量分数。
2.3.2 反应时间对蛋白酶解效果的影响

图3 酶解时间对水解度和ACE抑制活性的影响Fig.3 Effect of hydrolysis duration on the degree of hydrolysis and ACE inhibitory activity of the hydrolysate
由图3可以看出,当反应时间在2~22h时,蛋白水解度随着时间的延长而显著增加,但在22h后,蛋白水解度随反应时间的延长变化细微。同时,通过研究发现,反应时间的延长对抑制ACE活性的影响变化不大,综合考虑上述两个因素确定选用酶解时间为22h。
2.3.3 酶与底物质量比对反应效果的影响
当酶与底物质量比在0~2%时,蛋白水解液的水解度呈上升趋势,由图4可以看出,当蛋白酶加入量较低时,水解度增长速度较快。当酶与底物质量比达2%~5%时,水解度变化不是很明显,由于酶加入量较高
时,它与蛋白质分子肽链的接触机率就越多,导致底物转化为产物肽的可能性增加。同时,通过实验得出,酶与底物比的变化对抑制ACE活性的影响变化也不大,综合考虑各方面的因素,研究选用2%作为酶与底物的质量比。
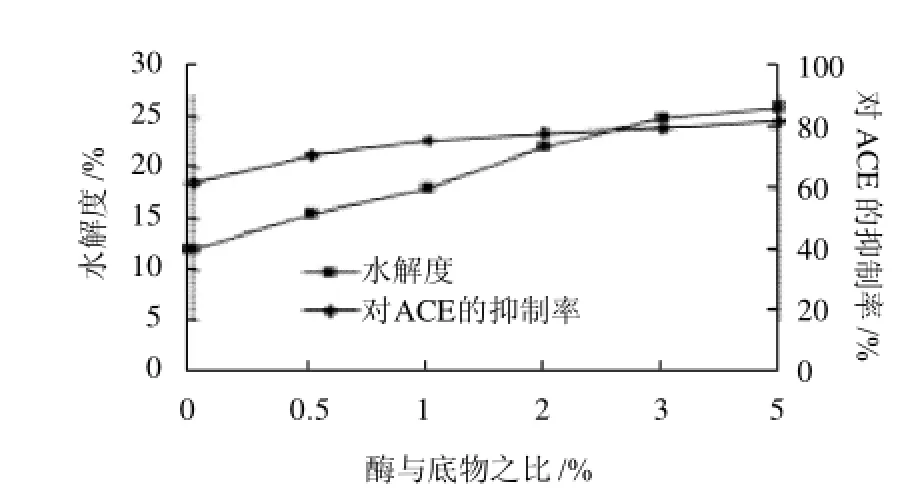
图4 酶与底物比对水解度和ACE抑制活性的影响Fig.4 Effect of enzyme/substrate ratio on the degree of hydrolysis and ACE inhibitory activity of the hydrolysate
2.4ACE抑制肽的初步分离
采用凝胶过滤法分离鱿鱼肝脏蛋白酶解的产物。本实验使用葡聚糖凝胶。葡聚糖凝胶是由一定平均分子质量的葡聚糖(右旋糖)和甘油基以醚桥(—O—CH2—CH—CH2—O)形式相互交联形成的三维空洞网状结构。通过控制交联剂环氧氯丙烷和葡聚糖的配比以及交联时的反应条件可控制交联度而获得具有不同网眼的凝胶,网眼的大小决定了被分离物质能够自由出入凝胶内部的分子量范围。
Sephadex G-50的分离范围是3~10kD。用Sephadex G-50初步分离鱿鱼肝脏蛋白酶解液,用30%的甲醇作为洗脱液,以24滴/min的恒速进行洗脱,在洗脱过程中,大分子不能进入凝胶内部而沿着凝胶颗粒间的空隙最先流出柱外,从而使样品中分子大小不同的物质得到分离。实验中,有5个峰被检测到,如图5所示峰值A、B、C、D、E。对每个峰分别收集、真空浓缩、冷冻干燥后测定其ACE抑制活性。

图5 酶解液在Sephadex G-50上的洗脱图Fig.5 Sephadex G-50 fractionation of the target hydrolysate

表2 Sephadex G-50初步分离各片断ACE抑制活性和回收率Table 2 IC50values and recoveries of Sephadex G-50 fractions of the target hydrolysate
如表2所示,第A、B、C区洗脱下来的蛋白具有ACE抑制活性,其IC50分别为2.26、1.80、5.08mg/mL。结果表明分子质量较大的多肽具有较好的ACE抑制活性。
3 结 论
3.1 胃蛋白酶为鱿鱼肝脏蛋白水解的最佳酶类,其水解的最优条件为在36℃酶解22h、酶与底物的质量比2%、底物质量分数2.5%,此时酶解效果最好。3.2经过上述条件处理后的水解液经超滤处理(截留分子质量为20kD)后,用Sephadex G-50进行分离,洗脱得到5个峰,检测各峰值的抑制活性,其中组分B的ACE抑制活性最高,其半抑制浓度(IC50)达到1.80mg/mL。
[1]袁亚辉, 姚美君. 利用鱿鱼内脏生产海味素的研究[J]. 渔业现代化, 2002(1): 28-29.
[2]FAO. Fishery statistics: capture production[M]. Food and Agriculture Organization of UN, 1998: 46-49.
[3]陈意. 鱿鱼的营养及食用价值[J]. 食品与药品, 2006, 8(6): 75-76.
[4]赵红伟. 鱿鱼肝脏的综合利用: 鱿鱼肝脏在虾饲料中的应用研究[D].大连: 大连水产学院, 2003.
[5]秦玉青, 刘承初, 王慥. 鱿鱼皮胶原蛋白的测定与回收[J]. 上海水产大学学报, 2002, 11(2): 138-144.
[6]陈修, 陈维洲, 曾贵云. 心血管药理学[M]. 3版. 北京: 人民卫生出版社, 2003: 346-348.
[7]GOMEZ-RUIZ J A, RAMOS M, RECIO I. Identification and formation of angiotensin-converting enzyme-inhibitory peptides in Manchego cheese by high-performance liquid chromatography tandem masss pectrometry [J]. Journal of Chromatography A, 2004, 1054: 269-277.
[8]MORIMURA S, NEGATE H, UEMURA Y, et a1. Development of an effective process for utilization of collagen from livestock and fish waste [J]. Process Biochemistry, 2002, 37: 1403-1412.
[9]程云辉, 文新华. 生物活性肽制备的研究进展[J]. 食品与机械, 2001 (4): 4-7.
[10]吴建平, 丁霄霖. 食品蛋白质降血压肽的研究进展[J]. 中国粮油学报, 1998, 13(5): 10-14.
[11]陈吉球. 血管紧张素转换酶[J]. 桂林医学院学报, 1997, 10(1): 131-134.
[12]赵海珍. 天然食品来源的血管紧张素转换酶抑制肽的研究进展[J]. 中国生化药物杂志, 2004, 25(5): 315-317.
[13]何海伦, 陈秀兰, 孙彩云, 等. 血管紧张素转化酶抑制肽的研究进展[J]. 中国生物工程杂志, 2004, 24(9): 7-11.
[14]范俊峰, 李里特, 张艳艳, 等. 2种蛋白酶的大豆蛋白水解物对血管紧张素转换酶的抑制作用[J]. 食品与发酵工业, 2004, 30(1): 80-84.
[15]CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotennsin I converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20: 1637-1648.
Preparation and Separation of ACE Inhibitory Peptides from Hydrolyzed Squid Liver Protein
XIE Chao,LIN Lin,QIU Xiao-hua,LIN Ya-ping
(College of Food and Pharmacology, Zhejiang Ocean University, Zhoushan 316000, China)
Squid liver as a byproduct of squid processing was processed into protein. The protein was enzymatically hydrolyzed and ACE inhibitory peptides were obtained from the hydrolysate after ultrafiltration and Sephadex G-50 fractionation. Pepsin was found optimal for the hydrolysis of squid liver protein. The optimal pepsin hydrolysis conditions for both higher degree of hydrolysis and ACE inhibitory ratio were as follows: substrate concentration 2.5%; enzyme/substrate ratio 2%; and temperature 36 ℃ for a hydrolysis duration of 22 h. The smaller molecular weight fractions after ultrafiltration through a membrane with 20 kD molecular weight cutoff (MWCO) were fractionized on Sephadex G-50 column, resulting in five elution peaks. Among them, fraction (peak) B presented the highest ACE inhibitory activity, with an IC50of 1.80 mg/mL.
squid liver protein;hydrolysate;ACE inhibitory peptides
R151.1
A
1002-6630(2010)18-0139-04
2010-06-23
浙江省重大科技专项(2009C12025);浙江省公益基金项目(2009C22023);2009年舟山市重大项目(092033)
谢超(1975—),男,讲师,硕士,研究方向为水产品加工。E-mail:xc750205@163.com
