脂肪酶催化猪油合成L-抗坏血酸脂肪酸酯工艺条件
2010-03-23吕凤霞赵海珍刘建伟别小妹陆兆新
张 宇,吕凤霞*,赵海珍,刘建伟,别小妹,陆兆新
(南京农业大学食品科技学院酶工程研究室,江苏 南京 210095)
脂肪酶催化猪油合成L-抗坏血酸脂肪酸酯工艺条件
张 宇,吕凤霞*,赵海珍,刘建伟,别小妹,陆兆新
(南京农业大学食品科技学院酶工程研究室,江苏 南京 210095)
研究一种L-抗坏血酸脂肪酸酯酶法合成的新途径。以廉价的猪油和L-抗坏血酸作为反应底物,探讨酶法合成L-抗坏血酸脂肪酸酯的工艺条件。结果表明,在该酶促反应中,混合有机溶剂体系中底物转化率高于相应纯有机溶剂体系中的转化率,最佳反应体系为30%叔戊醇:70%异辛烷(V/V)。研究各反应因素对转化率的影响,确定最适反应条件为底物L-抗坏血酸与复合猪油甲酯的物质的量比为1:10、酶量10%、温度55℃、反应时间24h,转化率可达到(52.7±2.8)%。
脂肪酶;猪油;酶法合成;抗坏血酸脂肪酸酯
L-抗坏血酸脂肪酸酯(L-ascorbyl fatty acid esters,AFAE)是一种新型的多功能食品添加剂。由于其既含有亲水性的L-抗坏血酸,又含有亲油性的脂肪酸链,使得它兼具脂溶性抗氧化剂和食品乳化剂的特性,在食品工业中具有广泛的用途[1-2]。
L-抗坏血酸脂肪酸酯的合成主要有化学合成法[3]和酶催化合成法[4]两类。其中化学合成法因成本低、收率高等优点在工业生产上广泛应用。但化学合成方法副反应多,得到的产品有害物质含量高,很难达到绿色食品添加剂的要求,而且该工艺还存在能耗高、对设备要求高、环境污染较为严重等问题。与化学合成法相比,L-抗坏血酸脂肪酸酯的酶法合成具有反应选择性高、反应条件温和、副反应少、转化率高和产品下游分离操作相对简单、对设备要求不高等优点,完全符合绿色化工的发展趋势。尽管目前酶法合成L-抗坏血酸脂肪酸酯的工业化生产因酶的应用环境以及成本高的问题还没有实现,但它代表了未来产业的发展方向。
在酶催化法合成L-抗坏血酸脂肪酸酯的研究中,脂肪酶和溶剂的选择、最佳反应条件的确定以及经济性底物的采用成为酶催化合成法发展的关键。以廉价的畜牧业加工副产品——猪油和L-抗坏血酸为原料,利用生物催化手段制备的L-抗坏血酸脂肪酸酯是一种混合性酯。该混合性酯既含有不饱和脂肪酸,又有饱和脂肪酸,在抗氧化的同时还具有可以提供给人体多种脂肪酸和L-抗
坏血酸的生理学效价的特性,属于一种高效、营养、多功能食品添加剂,符合目前绿色食品添加剂安全、营养、多功能的发展趋势。目前,有关脂肪酶催化猪油合成抗坏血酸脂肪酸酯的研究,国内外尚未见报道。
本实验探索以脂肪酶为催化剂以及猪油甲酯和L-抗坏血酸为反应底物,酶法合成L-抗坏血酸脂肪酸酯的新途径,为研制开发新型食品添加剂提供参考。
1 材料与方法
1.1 材料与试剂
脂肪酶:固定化脂肪酶Lipozyme TL IM(T. lanuginosus)、Novozyme 435(Candida Antarctica)、Lipozyme RM IM(Rhizomucor miehei) 丹麦Novozyme酶制剂公司。游离态粉末脂肪酶FAP-15(Rhizopus oryzae)、Amnao10(Mucor javanicus) 日本Amnao酶制剂公司。
精制猪油 连云港油脂有限公司;L-抗坏血酸棕榈酸酯标样 德国Sigma-Aldrich公司;其他L-抗坏血酸脂肪酸酯标样由本实验室自制;其他试剂和有机溶剂均为分析纯或色谱纯。
1.2 方法
1.2.1 复合猪油甲酯的制备
取干净的三口烧瓶,加入100g精制猪油,再加入20.6mL甲醇和0.5g NaOH,装上回流和搅拌装置,在反应温度60℃,充分搅拌下反应2h。反应结束后蒸馏出过量的甲醇,并移入分液漏斗,静置后分离出下层的甘油。将得到的粗猪油甲酯用水洗涤数次至中性后,再用NaCl饱和水溶液洗涤一次,可得到油状的复合猪油甲酯,备用。
1.2.2 L-抗坏血酸脂肪酸酯的合成
典型反应为:0.1mmol/L L-抗坏血酸、0.2mmol/L的复合猪油甲酯加入装有20mL反应介质的具塞三角瓶中,在反应温度下预热使反应物溶解并混合均匀,然后加入10%固定化脂肪酶。反应混合物在55℃旋转水浴锅中以180r/min的转速反应24h。所有反应进行两个重复,取其平均值。
1.2.3 L-抗坏血酸脂肪酸酯的HPLC分析
取20 μL反应液进行HPLC分析。HPLC系统为美国Agilent公司仪器,配有UV检测器和ZORBAX SB C18色谱柱(4.6mm×250mm,5μm),柱体温度保持在30℃,以乙腈-甲醇(1‰三氟乙酸)-水(1‰三氟乙酸)作为洗脱液,流动相流速保持在1.0mL/min,检测器波长245nm,整个洗脱过程约45min。采用外标法进行产物的定量。标准L-抗坏血酸脂肪酸酯的HPLC图谱见图1。
1.2.4 转化率的测定
以反应体系中生成的L-抗坏血酸脂肪酸酯的量计算转化率(转化率均以L-抗坏血酸为基准进行计算):
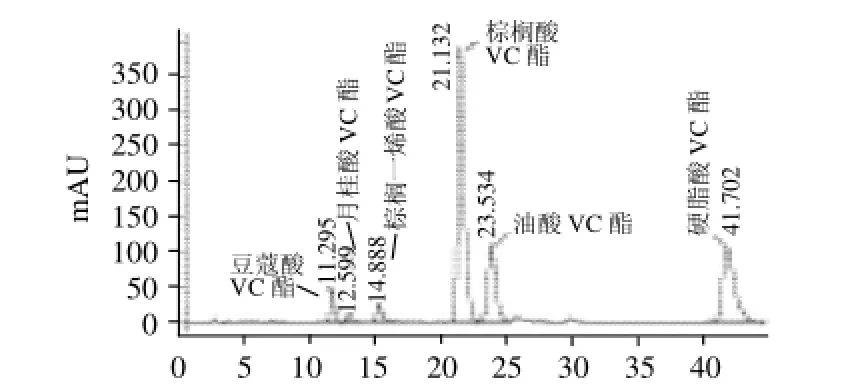
图1 L-抗坏血酸脂肪酸酯的HPLC图谱Fig.1 HPLC chromatogram of standard AFAE

2 结果与分析
2.1 脂肪酶的筛选
在酯交换反应中用于催化反应的脂肪酶类型,对于产物产率和组成而言是一个决定性因素。为了确定一种催化活性最佳的脂肪酶,按1.2.2节方法对Lipozyme TL IM、Novozyme 435、Lipozyme RM IM、FAP-15和Amnao10等脂肪酶进行筛选。结果见图2。
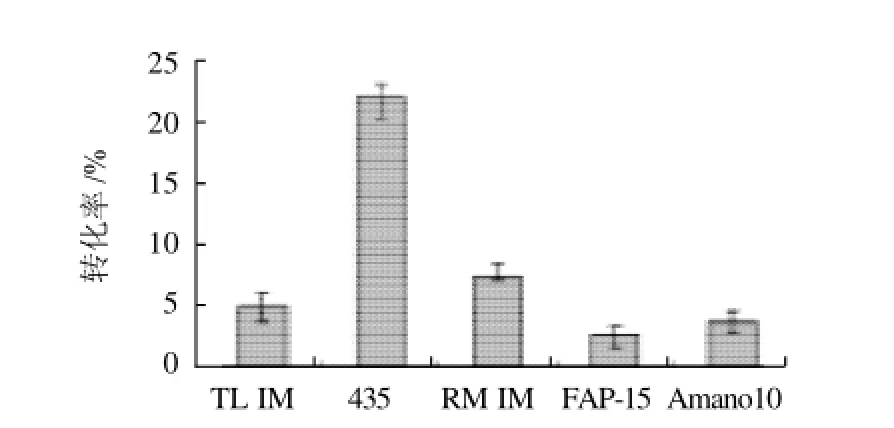
图2 脂肪酶对反应转化率的影响Fig.2 Effect of lipase type on the conversion ratio of L-ascorbic acid
由图2可以看出,不同脂肪酶催化的反应转化率不同。在叔戊醇反应体系中,5种脂肪酶的催化活性从高到低依次:Novozyme 435>Lipozyme RM IM>Lipozyme TL IM>Amnao10>FAP-15。以固定化脂肪酶Novozyme 435的催化活性最高,而游离酶的催化活性比较低。这可能是因为酶固定化之后,提高了其对外界环境如温度、pH值等的稳定性,从而在反应体系中保持了比较高的催化活性。而游离酶由于直接同有机溶剂接触,酶的活性位点容易受到有机溶剂破坏或改变,从而导致酶活的降低或失活。总之,由于固定化酶Novozyme 435表现出了高的催化活性,因此就选用固定化酶Novozyme 435作为催化剂进行下一步的研究。
2.2 反应体系对转化率的影响
大量的研究表明,有机溶剂作为酶反应的反应介质
会直接影响酶的催化活性和稳定性[5-8]。Laane等[6]用有机溶剂的极性参数lgP来描述有机溶剂对酶反应的影响(lgP是该有机溶剂在正辛醇-水体系中的分配系数的对数)。结果发现,lgP<2的极性溶剂不适合作为反应介质,因为溶剂极性极强,容易夺取酶分子表面水层而使酶活性降低;lgP在2~4之间的溶剂对酶的必需水有微弱破坏,对酶活性有影响但很难预测,酶在溶剂中一般可以表现出中等活性;lgP>4的非极性溶剂一般不破坏酶分子表面水层,这类溶剂是较为理想的。本实验选择了3种常用的有机溶剂和其混合溶剂作为反应介质,其转化率见表1。
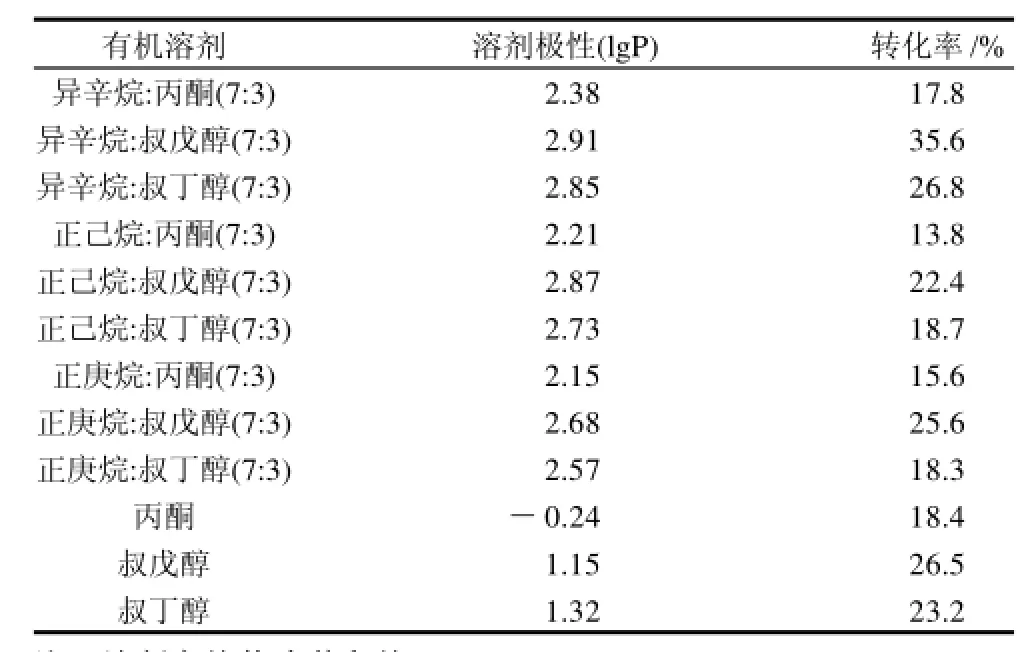
表1 有机溶剂对转化率的影响Table 1 Effect of reaction medium composition on the conversion ratio of L-ascorbic acid
由表1可见,在相同的反应条件下,混合溶剂中的转化率要高于单纯溶剂中的转化率,这主要是因为在酶促复合脂肪酸甲酯与L-抗坏血酸合成L-抗坏血酸脂肪酸酯的过程中,反应副产物甲醇的存在可能导致酶催化活力的下降。为了解决这个问题,需要从反应体系中除去甲醇,而极性有机溶剂如叔丁醇(lgP=0.8)已经被用来消溶甲醇[9]。所以采用溶剂设计(solvent engineering)的方法[10],选择一种混合溶剂作为反应介质,这种混合溶剂由可以提供酶催化反应所需适合微环境的非极性溶剂和可以消溶甲醇的极性溶剂组成,如由叔戊醇和异辛烷混合而成的溶剂。
表2表明,叔戊醇混合溶剂中L-抗坏血酸的转化率>叔丁醇混合溶剂中的转化率>丙酮混合溶剂中的转化率。随着混合溶剂中极性溶剂含量的增加,反应转化率也随之提高。当到达一定值后又随之降低,这可能是因为极性溶剂消溶甲醇的能力已经达到极限,甲醇重新开始影响酶催化活性。这一趋势在不同混合溶剂体系中都是一致的。然而,在相同溶剂比例的情况下,同一溶剂中加入不同的极性溶剂并没有使酯交换反应产生相同的反应转化率。例如,在溶剂比例为3:7,丙酮和异辛烷的混合溶剂中反应转化率为17.8%,而异辛烷和叔戊醇的混合溶剂中转化率为35.6%。这可能是由于不同的极性溶剂对甲醇的消溶能力不同。
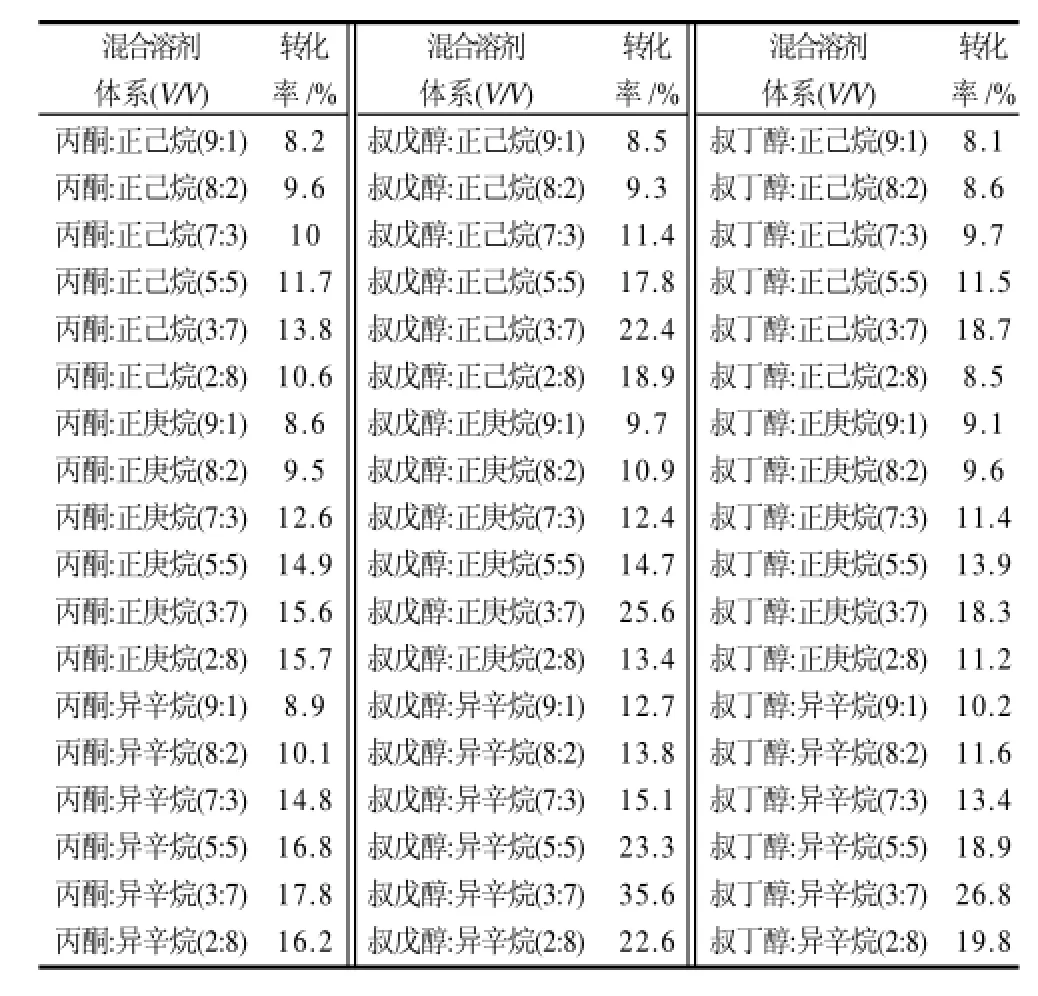
表2 在不同混合溶剂介质中酶催化L-抗坏血酸与猪油甲酯的酯交换反应Table 2 Effect of reaction medium polarity on the conversion ratio of L-ascorbic acid
2.3 酶量对L-抗坏血酸转化率的影响
在酶催化反应中,酶量对于反应进程的快慢有着决定性影响。在本实验中,脂肪酶固体颗粒直接悬浮于有机溶剂中,酶的加入量对于反应进行的程度有相当大的影响。酶量上升增加接触面积,促使酶促反应加快,缩短反应时间。随着反应时间延长酶活性降低,增大酶量保证反应能最大化。酶量对于L-抗坏血酸转化率的影响见图3。
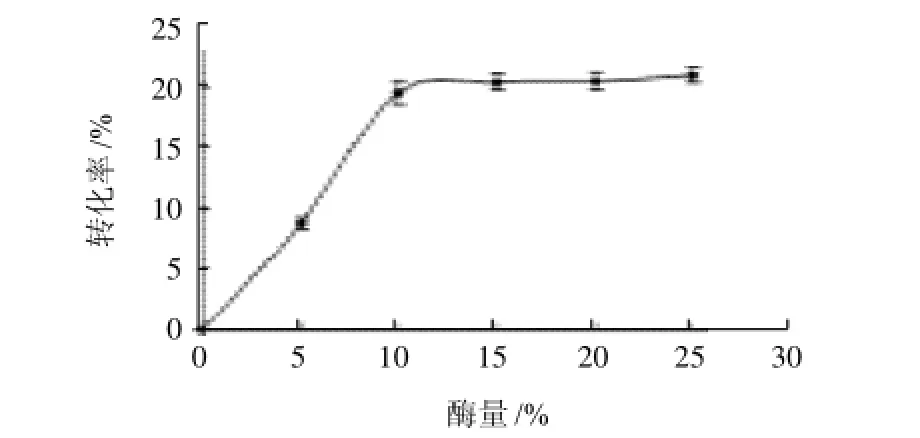
图3 酶量对L-抗坏血酸转化率的影响Fig.3 Effect of enzyme amount on the conversion ratio of L-ascorbic acid
从图3可知,在反应体系中,当酶量为5%时,L-抗坏血酸转化率比较低,但是随着酶量的继续增大,L-
抗坏血酸转化率明显提高,当酶量超过15%时L-抗坏血酸转化率变化逐渐趋于稳定。不断提高反应体系中的酶量可以加快酯交换反应的进程,但与此同时逆反应进程也相应加快。另外,过高的酶量还会带入体系过多的水分,增加水解副反应的发生。因此,过高的酶量并不一定有利于产物产量的提高,而应该从各个方面考虑来选择合适的酶量。
2.4 底物比率对L-抗坏血酸转化率的影响
脂肪酶催化的L-抗坏血酸和复合猪油甲酯的酯交换反应生是一种可逆反应。反应物过量或者在反应中不断除去某反应产物,可使反应向正方向进行。当L-抗坏血酸达到饱和时,溶剂中存在的过量的没有溶解的L-抗坏血酸会阻碍传质,使L-抗坏血酸转化率降低,造成L-抗坏血酸的浪费[11]。同时由于L-抗坏血酸易氧化和发生其他副反应,用量过多也会引起副反应的增加。

图4 底物物质的量比对L-抗坏血酸转化率的影响Fig.4 Effect of L-ascorbic acid/lard methyl ester molar ratio on the conversion ratio of L-ascorbic acid
保持L-抗坏血酸的量不变(0.1mmol/L),改变复合猪油甲酯的量(0.2~1.4mmol/L),以最佳的底物比率获得最大L-抗坏血酸转化率。由图4可以看出,随着底物含量的提高,L-抗坏血酸的转化率也在增加,当底物比率小于10时,转化率升高较快。随着底物比率的继续提高,L-抗坏血酸的转化率并没有表现出明显的提高。原因可能有以下几个方面:在比较高的底物比率下,所有酶分子己经有效地与底物结合,酶已经饱和,即使进一步加入底物,提高底物比率对酶的催化速度也不再有影响[12];高浓度的复合猪油甲酯不能完全溶入混和溶剂体系,提高了反应体系的黏度,增加了反应体系的传质阻力;酶活降低或酶部分失活,这主要是由于复合猪油甲酯中可能含有未处理干净的游离脂肪酸,而高浓度的游离酸使酶分子周围水相酸化或使酶表层结合水被剥夺,使酶催化微环境或酶的空间构象发生改变[13]。
2.5 反应时间对L-抗坏血酸转化率的影响
反应时间对L-抗坏血酸转化率也是一个重要的影响因素。通过不同反应时间2、4、6、12、24、36、48h对脂肪酶Novozyme 435催化活性的变化情况,结果见图5。
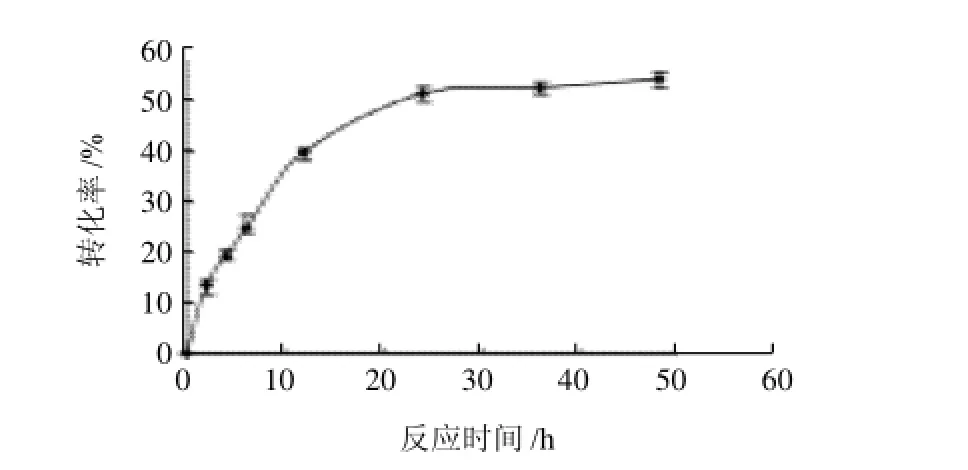
图5 反应时间对L-抗坏血酸转化率的影响Fig.5 Effect of reaction time on the conversion ratio of L-ascorbic acid
由图5可以看出,开始反应的前24h内,虽然L-抗坏血酸转化率都比较低,但是变化非常明显,即酶促反应速度非常快。当反应进行到2h时,L-抗坏血酸转化率是13.6%,但当反应进行到24h时,L-抗坏血酸转化率已达到了51.3%,相当于2h时的3.8倍。随后,随着反应时间的延长,L-抗坏血酸转化率变化不再明显,呈现一种渐近趋势。研究结果表明,反应进行到24h时已处于平衡状态,继续延长反应时间对提高L-抗坏血酸转化率己不再有意义。当然,反应到达平衡态所需时间的长短还与反应温度有关。反应温度越高,酶催化速率越快,所需反应时间就越短;反之,则越长。
2.6 反应温度对L-抗坏血酸转化率的影响

图6 反应温度对L-抗坏血酸转化率的影响Fig.6 Effect of reaction temperature on the conversion ratio of L-ascorbic acid
在有机溶剂中固定化酶具有较高的热稳定性,其在有机溶剂中的最适温度比水中的要高,当温度升高时酶反应的速度增加;但是当温度继续升高,酶分子的变性失活速度也会增加。为确定复合猪油甲酯与L-抗坏血酸酯交换反应中Novozyme 435的最佳温度范围,在45~80℃之间研究反应温度对L-抗坏血酸转化率的影响,结果如图6所示。
由图6可以看出,在反应体系中,当反应在45~65℃之间进行时,L-抗坏血酸转化率转化率没有明显改变,但当反应温度高于65℃时,转化率明显降低。这种现象可以通过化学反应动力学Arrehenius方程来解释:

式中:K为酶反应速率常数;A为阿仑尼乌斯常数;E为酶催化反应所需活化能;T为反应温度;R为气体常数。由方程可以看出,随着反应温度的升高,酶催化反应速率加快。同时这一方程也可以用来描述酶失活动力学,失活速率常数可表示为公式:

式中:Kd为酶动力学失活速率常数;Ad为阿仑尼乌斯常数;Ed为酶失活反应活化能;T为反应温度;R为气体常数。公式表明,随着反应温度的升高,酶失活速率也加快。
对于本研究而言,由于温度对L-抗坏血酸的稳定性影响较大,要避免过高反应温度,故选择比较低的55℃作为反应体系中的最适反应温度。
2.7 酶的稳定性
固定化酶的使用寿命是决定工业化过程生产成本的一个重要影响因素。在最佳条件下,使用Novozyme 435连续反应9个批次,结果如图7所示。

图7 酶的稳定性Fig.7 Effect of repeated use of Novozyme 435 lipase on the conversion ratio of L-ascorbic acid
从图7可以看出,连续反应9个批次后转化率仍可达到47%以上,说明该固定化酶在此反应体系中稳定,可以通过多次使用来降低成本。
3 讨论与结论
目前国内外生产的L-抗坏血酸脂肪酸酯产品主要是化学合成的L-抗坏血酸棕榈酸酯。由于酶法生产L-抗坏血酸脂肪酸酯具有反应条件温和、环境污染小、选择性高等诸多优点,已成为研究的热点之一。汤鲁宏等[14]以脂肪酶Novozyme 435为催化剂,叔戊醇为介质,在转速200r/min、温度55℃、水分含量0、酶量12.5%的条件下催化L-抗坏血酸和棕榈酸或棕榈酸甲酯合成了L-抗坏血酸棕榈酸酯;孙燕等[15]在底物棕榈酸甲酯与L-抗坏血酸的摩尔比1.3:1.0、反应温度36℃、反应时间24h、脂肪酶浓度15%、含水量1%的条件下,以黑曲霉脂肪酶为催化剂获得VC的转化率为23%。Humeau等[4]以棕榈酸为反应底物,在叔戊醇反应体系中使用Novozyme 435催化合成了L-抗坏血酸棕榈酸酯,反应转化率为68%;Song等[16]以亚油酸为底物催化合成了L-抗坏血酸亚油酸酯,反应转化率为33.5%;Chang等[17]采用RSM优化的方法,以月桂酸为反应底物,得到了高达93%的底物转化率。以上所有的研究报道都集中于利用脂肪酶催化L-抗坏血酸与脂肪酸或脂肪酸甲酯/乙酯直接酯化或转酯化反应合成L-抗坏血酸脂肪酸酯,都是采用单一脂肪酸或其甲酯/乙酯作为底物来源,而这些物质的价格都比较高,尤其是多不饱和脂肪酸。
与已报道的研究相比,本研究采用天然动物油脂——猪油首先得到复合猪油甲酯,然后利用脂肪酶催化反应合成L-抗坏血酸脂肪酸酯,并采用溶剂设计的方法解决了反应副产物甲醇对脂肪酶催化活性的抑制,得到了较高的L-抗坏血酸转化率。最佳反应条件是固定化酶Novozyme 435作为催化剂、反应介质为30%叔戊醇:70%异辛烷、酶用量10%、底物L-抗坏血酸与复合猪油甲酯的摩尔比1:10、反应温度55℃、反应时间24h。在此条件下,转化率可达到(52.7±2.8)%,与Humeau等[4]研究结果相近。由于猪油含有多种不饱和脂肪酸,其中油酸含量为43.2%,不稳定的双键结构可能会对酶的催化产生不利的影响,降低了底物转化率。这一现象与Song等[16]的报道相符,其原因还有待于进一步研究。
[1]STAMATIS H, SERETI V, KOLISIS F N. Studies on the enzymatic synthesis of lipophilic deriv,atives of natural antioxidants[J]. Journal of the American Oil Chemist s Society, 1999, 76(12): 1505-1510.
[2]SONG Qingxun, WEI Dongzhi. Study of vitamin C ester synthesis by immobilized lipase from Candida sp.[J]. Journal of Molecular Catalysis B: Enzymatic, 2002, 18(4/6): 261-266.
[3]COUSINS R C, SEIB P A, HOSENEY R C. Synthesis of 6-fatty acid esters of L-ascorbic acid[J]. JAOCS, 1977, 54(8): 308-312.
[4]HUMEAU C, GIRARDIN M, COULON D, et al. Synthesis of 6-O-palmitoyl L-ascorbic acid catalyzed by Candida antarctica lipase[J]. Biotechnol Lett, 1995, 17(10): 1091-1094.
[5]WELSH W F, MURRAY W D, WILLIAMS R E, et al. Microbiological and enzymatic production of flavor and fragrance chemicals[J]. Crit Rev Biotechnol, 1989, 9(2): 105-169.
[6]LAANE C, BOEREN S, VOS K , et al. Rules for optimization of biocatalysis in organic solvents[J]. Biotechnol Bioeng, 1987, 30(1):81-87.
[7]KLIBANOV A M. Enzymatic catalysis in anhydrous organic solvents [J]. Trends Biochem Sci, 1989, 14(4): 141-149.
[8]HIRATA H, HIGUCHI K, YAMASHINA T. Lipase-catalyzed transesterificaiton in organic solvent: effect of water and solvent, thermal stability and some applications[J]. J Biotechnol, 1990, 14(2): 157-167.
[9]ROYON D, DAZ M, ELLENRIEDER G, et al. Enzymatic production of biodiesel from cotton seed oil using t-butanol as a solvent[J]. Bioresour Technol, 2007, 98(3): 648-653.
[10]SU Erzheng, WEI Dongzhi. Improvement in lipase-catalyzed methanolysis of triacylglycerols for biodiesel production using a solvent engineering method[J]. J Mol Catal B: Enzym, 2008, 55(3/4): 118-125.
[11]徐凤杰, 谭天伟. 生物法合成抗坏血酸棕榈酸酯[J]. 生物工程学报, 2005, 21(6): 988-992.
[12]罗贵民. 酶工程[M]. 北京: 化学工业出版社, 2003.
[13]AKOH C C, MIN D B. Food lipids: chemistry, nutrition and biotechnology[M]. 3rd ed. New York: CRC Press, 2008.
[14]汤鲁宏, 张浩. 非水相脂肪酶催化合成L-抗坏血酸棕榈酸酯的研究Ⅰ[J]. 生物工程学报, 2000, 16(3): 363-366.
[15]孙燕, 夏木西·卡玛尔, 吾满江·艾力. 酶促反应合成棕榈酸VC酯[J]. 生物技术, 2006, 16(2): 63-65.
[16]SONG Qingxun, WEI Dongzhi, ZHOU Wenyu, et al. Enzymatic synthesis and antioxidant properties of L-ascorbyl oleate and L-ascorbyl linoleate[J]. Biotechnol Lett, 2004, 26: 1777-1780.
[17]CHANG S W, YANG C J, CHEN F Y, et al. Optimized synthesis of lipase-catalyzed L-ascorbyl laurate by Novozyme 435[J]. J Mol Catal B: Enzym, 2009, 56: 7-12.
Lipase-catalytic Synthesis of L-Ascorbyl Fatty Acid Esters in Mixed Organic Media
A novel way for the synthesis of L-ascorbyl fatty acid esters (AFAE) from low-cost lard and L-ascorbic acid under the catalysis of lipase was developed and the optimal reaction conditions were investigated. It was found that a higher substrate conversion ratio was obtained in single organic solvents than in their pairwise combinations and the optimal solvent system consisted of t-pentanol and isooctane (30:70, V/V). The optimal reaction conditions for maximum substrate conversion ratio were as follows: L-ascorbic acid/lard methyl ester molar ratio 1:10; enzyme amount 10%; and reaction temperature 55 ℃ for a reaction duration of 24 h. The conversion ratio of L-ascorbic acid under these reaction conditions reached up to (52.7±2.8)%.
lipase;lard;enzymatic synthesis;L-ascorbyl fatty acid esters
TS201.1;TQ466.3
A
1002-6630(2010)18-0134-05
2010-05-11
国家“863”计划项目(2007AA100401;2008AA10Z309);江苏省科技支撑计划项目(BE2008308)
张宇(1983—),男,硕士研究生,主要从事食品生物技术研究。E-mail:zhangyu1983323@yahoo.cn
*通信作者:吕凤霞(1963—),女,副教授,博士,主要从事酶工程研究。E-mail:lufengxia@163.com
