αs1-酪蛋白IgE抗原决定簇的识别
2010-03-23丛艳君任发政云战友
丛艳君,任发政*,云战友
(1.北京工商大学化学与环境工程学院,北京 100048;2.中国农业大学食品科学与营养工程学院,北京 100083;3.内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010080)
αs1-酪蛋白IgE抗原决定簇的识别
丛艳君1,任发政2,*,云战友3
(1.北京工商大学化学与环境工程学院,北京 100048;2.中国农业大学食品科学与营养工程学院,北京 100083;3.内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特 010080)
以αs1-酪蛋白氨基酸序列为模板,错位合成αs1-酪蛋白多肽,以收集到的牛乳过敏患者血清为抗体,鉴定αs1-酪蛋白IgE抗原决定簇,分析影响致敏性的关键氨基酸,探讨牛乳过敏机理。结果表明:αs1-酪蛋白IgE抗原决定簇有5条,它们在αs1-酪蛋白的定位分别为aa21~35、aa26~40、aa91~105、aa141~155、aa186~200。影响αs1-酪蛋白致敏性的关键氨基酸为组氨酸、谷氨酸、脯氨酸。说明特异性水解抗原决定簇或定点修饰过敏原氨基酸实现脱敏的方法是可行的。
牛奶;αs1-酪蛋白;IgE;抗原决定簇
酪蛋白大约占牛乳总蛋白的80%,是牛乳主要过敏原之一[1],它由αs1-、αs1-、β-、κ-酪蛋白4种组分构成,4种酪蛋白以37%、37%、1%和13%相对恒定的比例聚合成微粒-酪蛋白胶束,悬浮于乳清中[2]。αs1-酪蛋白是一条单链的磷酸化蛋白质,由199个氨基酸构成,脯氨酸含量较高[3],没有二硫键,三级结构比较简单[4],这些结构特点决定了αs1-酪蛋白的抗原决定簇以线性为主。
本研究应用固相合成肽的方法合成αs1-酪蛋白多肽,以收集到的牛乳过敏患者血清中的IgE为探针,鉴定定位过敏原抗原决定簇,探讨牛乳过敏机理。
1 材料与方法
1.1 材料与试剂
αs1-酪蛋白多肽 实验室合成;链霉亲和素(streptavidin,SA) 北京博奥森生物技术有限公司;HRP标记的鼠抗人IgE(ε链特异性)、四甲基联苯胺(TMB)、三氟乙酸(TFA) 美国Sigma公司;96孔聚苯乙烯酶标板 美国Costar公司。
1.2 仪器与设备
Bio-Rad 550型酶标仪 Bio-Rad公司;PSH500A生化培养箱 中国重庆银河实验仪器有限公司;Th-80D-2B型冻干机 北京天地精仪科技有限公司;高效液相Vydac C18柱 美国Vydac公司。
1.3 方法
1.3.1 多肽的合成[5]
采用Fmoc固相肽合成法,将C-末端氨基酸连接到一种合适的固相载体上,采用常规Fmoc法进行逐步缩合。合成结束后,用强酸将序列从固相载体上切割下来,经HPLC纯化,冷冻干燥后备用。
1.3.2 合成肽纯度的鉴定
采用高效液相色谱(RP-HPLC)和质谱进行分析。色谱柱:C18柱(4.6mm×250mm,5μm),流动相:A为体积分数0.1% TFA水溶液,B为乙腈,采用按体积分数梯度洗脱程序:0~5min,15% B;5~10min、20% B;10~30min,40% B。流速:1.0mL/min、检测波长:220nm;柱温:20℃。质谱条件:采用ESI离子源;喷雾压力:15psi;干燥气温度:350℃;流速:5L/min;扫描质量范围:m/z 500~2200。
1.3.3 牛奶过敏患者血清的收集
按照文献[1]相关参数(典型的食物过敏史、皮肤点刺实验、Immunol CAP实验)筛选牛乳过敏患者血清。6份牛乳过敏患者血清用来识别αs1-酪蛋白IgE抗原决定簇,以A~F表示。另外取5份血清等体积混合分析影响αs1-酪蛋白致敏性的关键氨基酸。
1.3.4 酶联免疫吸附实验(ELISA)鉴定抗原决定簇及关键氨基酸
合成肽致敏性的检测在96孔微板上进行,每孔均先用链霉亲和素包被,分别依次加入待进行抗原决定簇鉴定的肽系列,再用抗体检测,于450nm波长处测定光密度,具体操作参考文献[6]。
2 结果与分析
2.1 αs1-酪蛋白肽的合成

表1 合成αs1-酪蛋白肽的氨基酸序列Table 1 Sequences of synthesized peptides based onαs1-casein
以αs1-酪蛋白氨基酸序列为模板,用Fmoc固相合成法错位合成αs1-酪蛋白37条,见表1。
2.2 合成肽的纯度鉴定
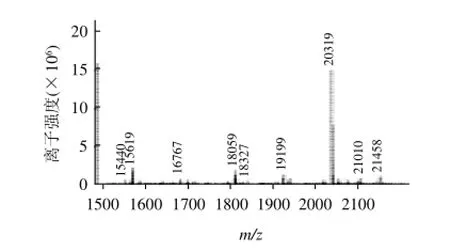
图1 Biotin-LNENLLRFFVAPFPE的MS图谱Fig.1 MS spectrum of Biotin-LNENLLRFFVAPFPE
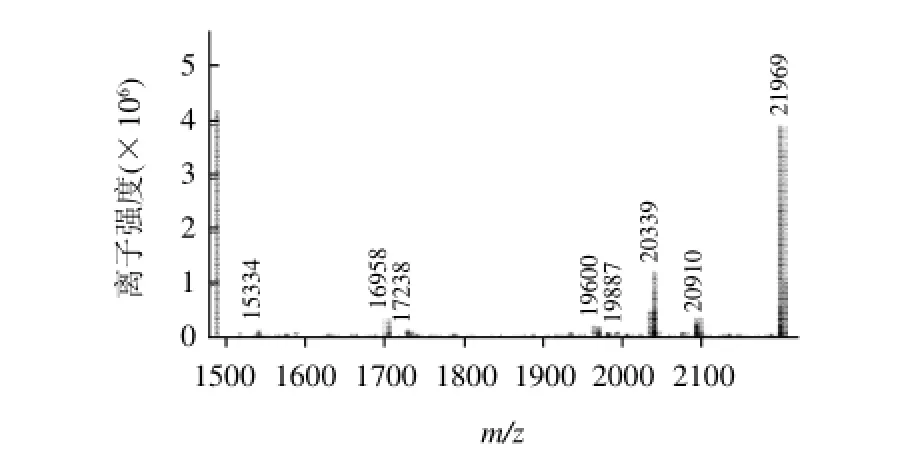
图2 Biotin-RQFYQLDAYPSGAWY的MS图谱Fig.2 MS spectrum of Biotin-RQFYQLDAYPSGAWY
合成的多肽通过高效液相纯化,纯度都达到了80%以上,进一步通过质谱鉴定多肽的相对分子质量(加上生物素的相对分子质量),图1、2表明多肽相对分子质量误差均小于5%,本实验代表性地附上了两条多肽(偶联生物素)的质谱图。
2.3 αs1-酪蛋白的IgE抗原决定簇
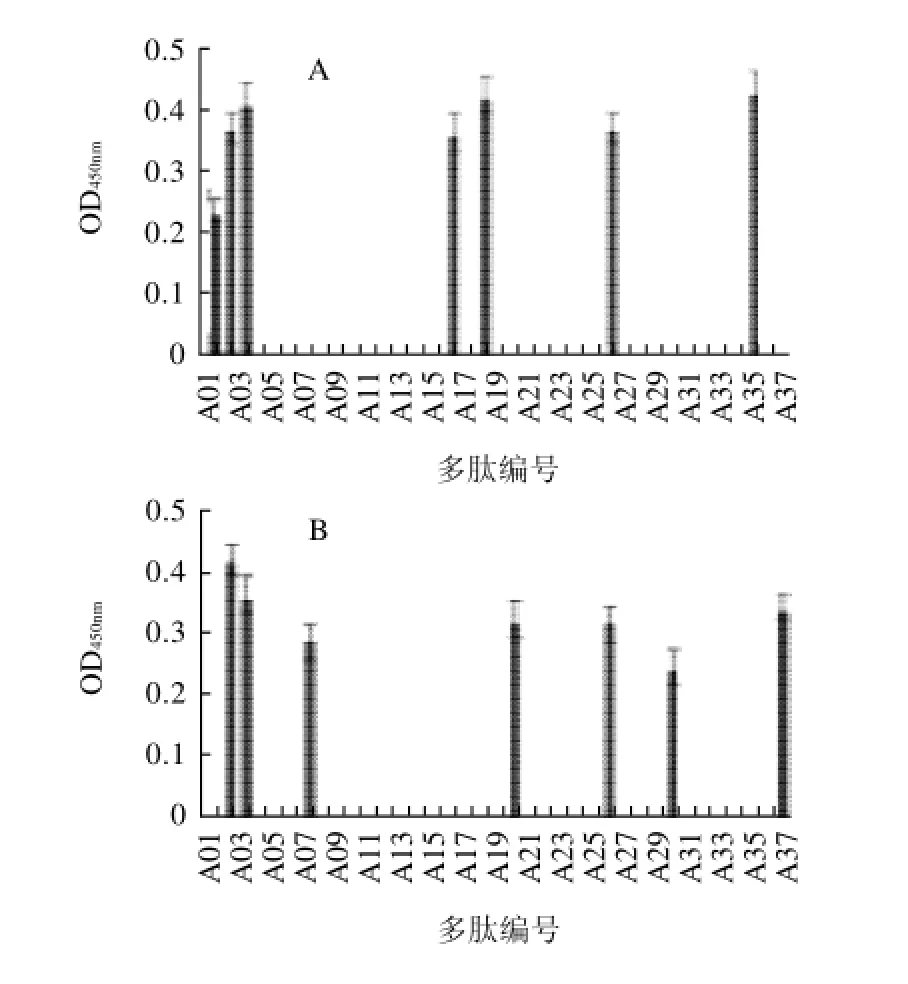

图3 A~F牛乳过敏患者识别αs1-酪蛋白IgE抗原决定簇Fig.3 Identification ofαs1-casein epitopes in cow milk allergic patients
由图3可知,A患者识别到的抗原决定簇为A01、A02、A03、A16、A18、A26、A35;B患者识别到的抗原决定簇为A02、A03、A07、A20、A26、A30、A37;C患者识别到的抗原决定簇为A05、A13、A16、A26、A35;D患者识别到的抗原决定簇为A02、A05、A16、A22、A26、A31、A35;E患者识别到的抗原决定簇为A02、A03、A16、A18、A26、A35;F患者识别到的抗原决定簇为A02、A03、A07、A16、A18、A26、A35。
从图3还可以看出,不同牛乳过敏患者识别到的抗原决定簇不同,A26的识别率为100%(6/6,即与6份血清均发生免疫反应),A02、A16、A35的识别率为83.3% (5/6),A03的识别率为66.7%(4/6),个别过敏患者对A18、A07、A20、A22也有免疫反应,A26、A02、A16、A35、A03的识别率在60%以上,故为αs1-酪蛋白的IgE抗原决定簇,它们的氨基酸序列分别为:GIHAQQKEPMIGVNQ、IKHQGLPQEVLNENL、VEQKHIQKEDVPSER、TQYTDAPSFSDIPNP、LPQEVLNENLLRFFV,这些抗原决定簇在αs1-酪蛋白的氨基酸序列定位分别为aa141~155、aa21~35、aa91~105、aa186~200、aa26~40(图4粗体部分)。用非牛乳过敏患者血清识别抗原决定簇的光密度值均小于0.1。

图4 IgE抗原决定簇在αs1-酪蛋白序列中的定位Fig.4 Locations of IgE epitopes in the sequence ofαs1-casein
2.4 显性抗原决定簇(GIHAQQKEPMIGVNQ)关键氨基酸的分析
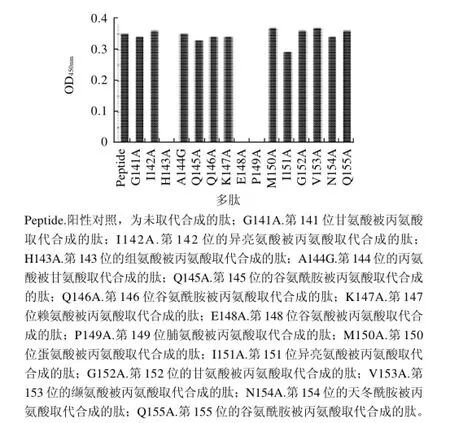
图5 影响αs1-酪蛋白致敏性的关键氨基酸Fig.5 Critical amino acids for the allergenicity ofαs1-casein
为了找到影响致敏性的关键氨基酸,本研究选用分
子较小的中性丙氨酸作为取代氨基酸(遇到丙氨酸以甘氨酸作取代)。用丙氨酸依次取代GIHAQQKEPMIGVNQ抗原决定簇的氨基酸,以未取代的抗原决定簇作空白对照,由图5可知,第143位的组氨酸(H)被丙氨酸取代合成的肽光密度值接近零,第148位的谷氨酸(E)被丙氨酸取代合成的多肽及第149位的脯氨酸(P)被丙氨酸取代合成的多肽的IgE结合能力消失,其他氨基酸被取代后合成的多肽IgE结合能力与对照差异不显著。因此组氨酸、谷氨酸、脯氨酸是影响αs1-酪蛋白致敏性的关键氨基酸。
3 讨 论
牛奶酪蛋白组分是引起成年人和年长儿童过敏的主要过敏原,这表明酪蛋白在持续性牛乳过敏疾病中发挥着重要作用[7-8]。一般认为过敏原的致敏性是由蛋白的初级、二级及三级结构决定的。通过尿素、盐酸、氢氧化钠、硫酸钠或加热方式处理α-酪蛋白,打破其二、三级结构,但是并未显著影响到α-酪蛋白的致敏性[9],这表明α-酪蛋白的初级结构(序列抗原决定簇)对其致敏性变化影响最显著。
Chatchatee等[10]采用96个重叠十肽,确定了αs1-酪蛋白6个主要和3个次要IgE抗原决定簇。Elsayed等[11]用溴化氢将αs1-酪蛋白裂解为7个肽段,除了一个肽段只含3个氨基酸外,其余均可以被T细胞识别,从而确定了7个T细胞识别表位。在此基础上,Ruiter等[12]采用了32个重叠肽分析T细胞识别表位,其中肽链43~66位、73~96位、91~114位、127~180位均可被3个病人的T细胞所识别,而肽链133~156位则被50%以上过敏病人的T细胞所识别,说明此区域为T细胞主要识别表位。本研究识别到αs1-酪蛋白IgE抗原决定簇5条,这些抗原决定簇在αs1-酪蛋白的氨基酸序列定位分别为aa141~155、aa21~35、aa91~105、aa186~200、aa26~40,抗原决定簇aa91~105与Ruiter等[12]发现的肽链91~114位是一致的,抗原决定簇aa141~155、aa21~35、aa186~200、aa26~40是之前研究没有报道过的。
关于αs1-酪蛋白抗原决定簇的关键氨基酸的研究报道很少。Cocco等[13]研究表明:以牛乳过敏患者混合血清为抗体,取代αs1-酪蛋白单个氨基酸可以降低或消除抗原决定簇IgE结合能力,这与本研究的结论是一致。
4 结 论
本研究识别的αs1-酪蛋白IgE抗原决定簇定位分别为aa141~155、aa21~35、aa91~105、aa186~200、aa26~40,通过对肽链141~155取代分析表明,取代单个氨基酸可以降低或消除αs1-酪蛋白IgE结合能力。
[1] DOCENA G H, FERNANDEZ R, CHIRO F G, et al. Identi,fication of casein as the major allergenic and antigenic protein in cow s milk[J]. Allergy, 1996, 51(6): 412-416.
[2] BERNARD H, CREMINON C, YVON M, et al. Specificity of th,ehuman IgE response to the different purified caseins in allergy to cow s milk proteins[J]. Int Arch Allergy Immunol, 1998, 115(3): 235-244.
[3] SWAISGOOD H E. Characterization of edible fluids of animal origin: milk[M]//FENNEMA O R. Food chemistry, 2nd ed. New York: Marcel Dekker, 1985: 791-827.
[4] KUMOSINSKI T F, BROWN E M, FARRELL H M. Three-dimensional molecular modeling of bovine caseins: αs1-casein[J]. J Dairy Sci, 1991, 74: 2889-2895.
[5] BARNETT D, BALDO B A, HOWDEN M E. Multiplicity of allergens in peanuts[J]. J Allergy Clin Immunol, 1983, 72(1): 61-68.
[6] 哈洛E, 莱恩D. 抗体技术实验指南[M]. 沈关心, 龚非力, 译. 北京:科学出版社, 2002: 240.
[7] SICHERER S H, SAMPSON H A. Cow , s milk protein-specific IgE concentrations in two age groups of milk-allergic children and in children achieving clinical tolerance[J]. Clin Exp Allergy, 1999, 29(4): 507-512.
[8] STOGER P, WUTHRICH B. Type Ⅰ allergy to cow milk proteins in adults: a retrospective study of 34 adult milk- and cheese-allergic patients [J]. Int Arch Allergy Immunol, 1993, 102: 399-407.
[9] KOHNO Y, HONMA K, SAITO K, et al. Preferential recognition of primary protein structures of alpha-casein by IgG and IgE antibodies of patients with milk all.e.rgy[J]. Ann Allergy, 1994, 73(5): 419-422.
[10] CHATCHATEE P, JARVINEN K M, BARDINA L, et al. Identification of IgE- and IgG-binding epitopes on αs1-casein: Differences in patients with persistent and transient cow , s milk allergy[J]. J Allergy Clin Immunol, 2001, 107(2): 379-383.
[11] ELSAYED S, HILL D J, DO T V. Evaluation of the allergenicity and antigenicity of bovine milk αs1-casein using extensively purified synthetic peptides[J]. Scandinavian Journal of Immunology, 2004, 60(5): 486-493.
[12] RUITER B, TREGOAT V, M, RABET L, et al. Characterization of T cell epitopes in αs1-casein in cow , s milk allergic, atopic and non-atopic children[J]. Clinical and Experimental Allergy, 2006, 36(3): 303-310.
[13] COCCO R R, JA..RVINEN K M, SAMPSON H A, et al. Mutational analysis of major, sequential IgE-binding epitopes in αs1-casein, a major cow ,s milk allergen[J]. J Allergy Clin Immunol, 2003, 112(2): 433-437.
Identification of IgE-binding Epitopes on αs1-Casein
CONG Yan-jun1,REN Fa-zheng2,*,YUN Zhan-you3
(1. School of Chemical and Environmental Engineering, Beijing Technology and Business University, Beijing 100048, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China;3. Inner Mongolia Yili Industrial Group Co. Ltd., Hohhot 010080, China)
A series of casein overlapping decapeptides (offset by 5 amino acids) were synthesized on the basis of the sequence of αs1-casein. IgE-binding epitopes were identified using individual sera from cow milk allergic patients. Moreover, the critical amino acids (AAs) for IgE binding were explored. The results indicated that five IgE-binding epitopes were identified to locate in the sequence of aa21-35, aa26-40, aa91-105, aa141-155 and aa186-200, respectively. In addition, histidine, glutamic acid and proline were the critical amino acids for the allergenicity of αs1-casein.
cow milk;αs1-casein;IgE;epitope
TS252.1
A
1002-6630(2010)17-0232-04
2010-01-02
“十一五”国家科技支撑计划项目(2006BAD04A06)
丛艳君(1978—),女,讲师,博士,主要从事功能乳制品研究。E-mail:congyj@th.btbu.edu.cn
*通信作者:任发政(1962—),男,教授,博士,主要从事功能乳制品研究。E-mail:renfazheng@263.net
