应用PCR 技术快速测定食品中单核细胞增生李斯特氏菌毒力
2010-03-23于丰宇王文斟刘晓朋
于丰宇,李 林,王 红,王文斟,何 源,刘晓朋,凌 华
(1.西南大学食品科学学院,重庆 400715;2.重庆市疾病预防控制中心,重庆 400042)
应用PCR 技术快速测定食品中单核细胞增生李斯特氏菌毒力
于丰宇1,李 林1,王 红2,王文斟2,何 源2,刘晓朋2,凌 华2
(1.西南大学食品科学学院,重庆 400715;2.重庆市疾病预防控制中心,重庆 400042)
目的:采用PCR技术准确、快速测定单核细胞增生李斯特菌(单增李斯特氏菌)分离株的毒力基因,鉴别强毒株和弱毒株或无毒株,以有效地限制李斯特氏菌病的传播。方法:以单增李斯特氏菌相关毒力基因(hly、plcB、inlA、inlB、inlC、inlJ、prfA)设计引物,检测重庆市2007—2009年分离的40株单增李斯特氏菌分离株中的毒力基因携带率,并进行小鼠毒力实验。结果:40株分离株中有15株7种毒力基因检测结果均为阳性,6株hly基因阴性,4株plcB基因阴性,4株prfA基因阴性,5株inlA、inlB基因阴性,11株inlC基因阴性,9株inlJ基因阴性,1株inlA、inlB、inlC、inlJ基因均为阴性。4株分离株的毒力与标准菌株ATCC191161E相当,小鼠LD50在1.2×108~6.0×108CFU/mL之间,为强毒株。筛选出弱毒株09-132,LD50为1.7×1011CFU/mL。结论:重庆市存在发生李斯特菌食物中毒的潜在危险,内化素基因(inlA、inlB、inlC、inlJ)的缺失可能是导致菌株毒力降低的原因,而prfA和plcB基因与菌株毒力的相关性较小。
单核细胞增生李斯特菌;毒力;基因;聚合酶链式反应
单核细胞增生李斯特氏菌(Listeria monocytogenes,简称单增李斯特氏菌)属于李斯特氏菌属(Listeria),是一种人畜共患的病原菌,可穿越宿主三道屏障,引起人和动物的胃肠炎、脑膜炎、败血症、流产等,发病率不高,死亡率可达20%~30%[1]。自1926年首次分离出单增李斯特氏菌后,李斯特氏菌病现已呈世界性分布。近年来随着人们生活节奏的加快,我国冷藏、速冻食品消费量迅速增多,食品中单增李斯特氏菌的潜在危险性也越来越大。目前,美国、欧盟等一些国家对食品中单增李斯特氏菌的污染非常重视,我国近年也将食品中单增李斯特氏菌的污染检测作为一项必检的安全指标。由于不同来源的单增李斯特氏菌毒力差异较大,
有些菌株致病性很强,而有些菌株毒力较弱甚至无致病性[2],因此准确、快速测定单增李斯特氏菌分离株的毒力具有重大意义,其可有效地限制李斯特氏菌病的传播以及减少不必要的食品召回。
单增李斯特氏菌致病力的测定包括小鼠毒力实验、体外培养细胞实验和毒力相关蛋白及基因的检测。小鼠毒力实验为体内检测细菌致病力的方法,是其他毒力检测方法的金标准,但实验成本高、且耗时,体外培养细胞实验相对于小鼠毒力实验成本较低,且操作简便,虽然具有重要的细菌毒力预测价值但相对费时。随着单增李斯特氏菌及无害李斯特氏菌全基因组序列的测定,己鉴定出若干新的毒力相关基因,使通过基因检测测定单增李斯特氏菌的致病力成为可能。Liu等[3]借助比较基因组学方法分析强毒株中特有的毒力基因lmo2821、lmo0733,建立了相应的PCR方法以鉴别强毒株和弱毒株(或无毒株)。
本实验采用PCR技术,对重庆市2007—2009年分离到的40株单增李斯特氏菌食品分离株进行毒力基因检测,分析不同食品样品中菌株的毒力基因携带情况,并结合小鼠毒力实验,鉴别强毒株和弱毒株或无毒株,拟建立相应的评估指标,为该病原菌的监控、预警及爆发食物中毒后追踪感染源及传播途径提供理论支持。
1 材料与方法
1.1 材料
1.1.1 菌株与试剂
单增李斯特氏菌标准菌株CMCC 54004和 ATCC 191161E 由重庆市疾病预防控制中心微生物检验所提供。40株单增李斯特氏菌自重庆市各大农贸市场的生鲜食品中分离所得,均经GB/T4789.30—2008《食品卫生微生物学检验 单核细胞增生李斯特氏菌检验》标准方法检测确认。
Taq DNA 聚合酶、dNTP 宝生物工程(大连)有限公司;琼脂糖 TaKaRa 公司;API Listeria 生化鉴定试剂条 法国生物梅里埃公司;李斯特氏菌显色培养基 郑州博赛公司。
1.1.2 实验动物
ICR小鼠(雌性,体质量20~22g)由重庆市中药研究院实验动物中心提供。
1.1.3 仪器与设备
PTC-200 核酸扩增仪 美国MJ 公司;TGL-16高速台式离心机 南京艾赛特科技发展有限公司;DYY-11型电泳仪 杭州汇尔仪器有限公司;Chemi DocXRS凝胶成像仪 美国伯乐公司;微量移液器 法国吉尔森公司。
1.2 PCR 方法
1.2.1 引物合成
针对单增李斯特氏菌的hly、plcB、inlA、inlB、inlC、inlJ、prfA基因选取7 对特异性引物[4-8],委托生工生物工程(上海)有限公司合成,其序列见表1。

表1 单增李斯特氏菌相关毒力基因的引物Table 1 Primers used in the PCR assay forL. monocytogenesgenes
1.2.2 模板DNA 制备
将待检菌株划线接种脑心浸液琼脂培养基平板,37℃培养24h,挑取菌落溶于1mL无菌纯水的离心管中制成浓菌悬液,100℃煮沸10min,12000r/min离心5min,取上清保存于-20℃备用。
1.2.3 PCR 反应体系和参数
反应体系:模板DNA 2μL、10μmol/L上下游引物各1μL、各25mmol/L dNTP 1μL、5U/μL Taq 酶0.2μL、25mmol/L MgCl21.5μL、10×buffer 2.5μL、纯水15.8μL,总体积25μL。
PCR 反应参数:94℃预变性10min;再按94℃变性1min,退火20s (退火温度按表1),72℃延伸20s,共进行30个循环;最后72℃延伸8min。
1.2.4 PCR 扩增产物的电泳
将PCR 扩增产物及100bp DNA Ladder Marker分别上样5μL,电泳。胶块在溴化乙锭中浸泡20min,观察电泳结果,并对其进行分析。
1.3 小鼠LD50实验
将待检菌株过夜培养物8000r/min离心5min以收集菌体。沉淀用PBS反复离心漂洗3次,用无菌生理盐水进行稀释,以麦氏比浊法进行细菌计数,调节菌浓度至约1×108CFU/mL,并进行一系列的10倍梯度稀释,平板计数以确定实际接种量。同时选取不同的稀释度腹腔接种于ICR雌性小鼠,剂量为0.2mL,每组接种6只
小鼠,共4组,并分别于接种后每隔12h进行一次观察,连续观察7d,以Karber法[9]计算LD50。
1.4 血清学实验
血清分型是一种传统的细菌分型方法。根据菌体O抗原和鞭毛H 抗原,可将单增李斯特氏菌分为16 个血清型:1/2a、1/2b、1/2c、3a、3b、3c、4a、4ab、4b、4c、4d、4e、5、6a、6b 和7。参照单增李斯特氏菌诊断血清使用说明书,O抗原采用玻片凝集法,H抗原采用试管凝集法。
2 结果与分析
2.1 PCR检测结果
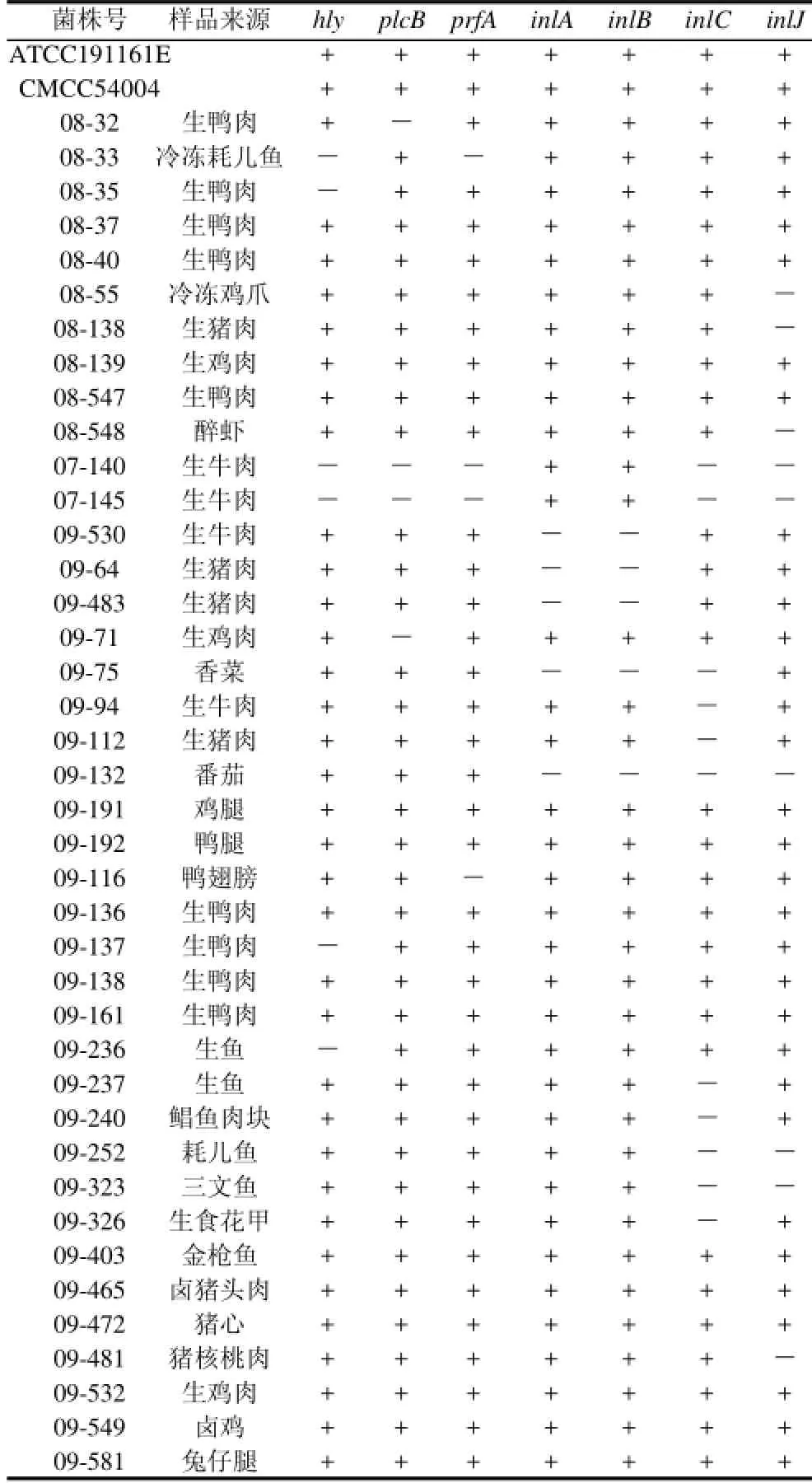
表2 单增李斯特氏菌毒力基因PCR检测结果Table 2 PCR results of virulence-associated genes ofListeria monocytogenes
单增李斯特氏菌标准株及40株单增李斯特氏菌分离株毒力基因PCR 检测结果见表2。
由表2可知,40株单增李斯特氏菌分离株中有15株7种毒力基因检测结果均为阳性,6株hly基因阴性,4株plcB基因阴性,4株prfA基因阴性,5株inlA、inlB基因阴性,11株inlC基因阴性,9株inlJ基因阴性,其中有1株inlA、inlB、inlC、inlJ基因均为阴性。结合菌株来源分析,可知生禽肉中单增李斯特氏菌内化素基因(inlA、inlB、inlC、inlJ)阳性率高于生畜肉。各基因PCR扩增结果见图1~7。
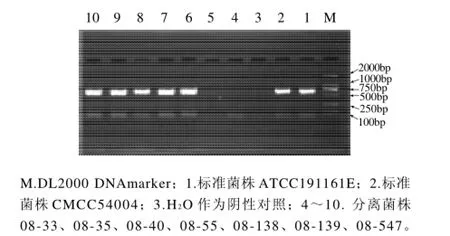
图1 hly的PCR扩增结果Fig. 1 Agarose gel electrophoregrams of PCR amplification products ofhly
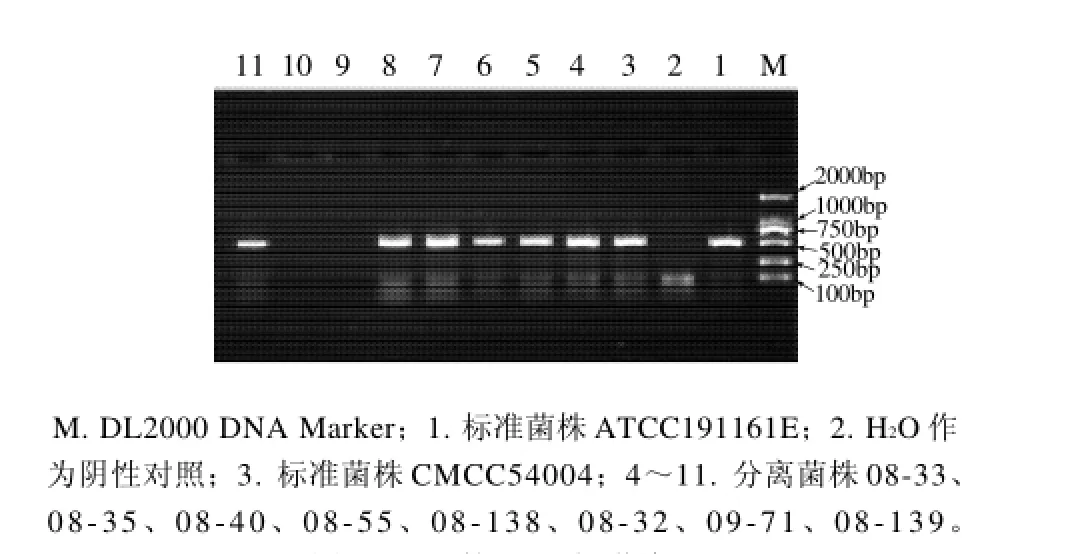
图2 plcB的PCR扩增结果Fig.2 Agarose gel electrophoregrams of PCR amplification products ofplcB
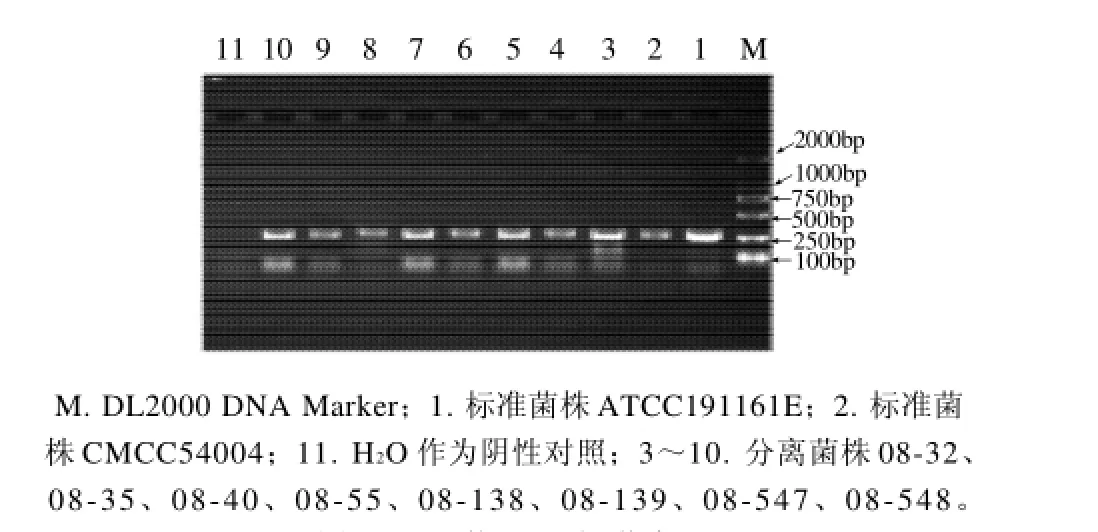
图3 inlA的PCR扩增结果Fig.3 Agarose gel electrophoregrams of PCR amplification products ofinlA
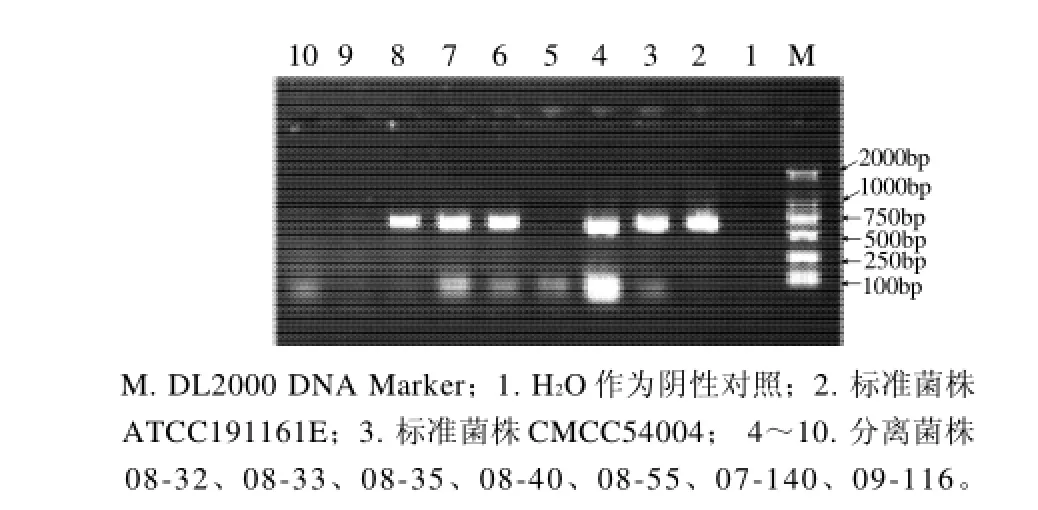
图4 prfA的PCR扩增结果Fig.4 Agarose gel electrophoregrams of PCR amplification products ofprfA
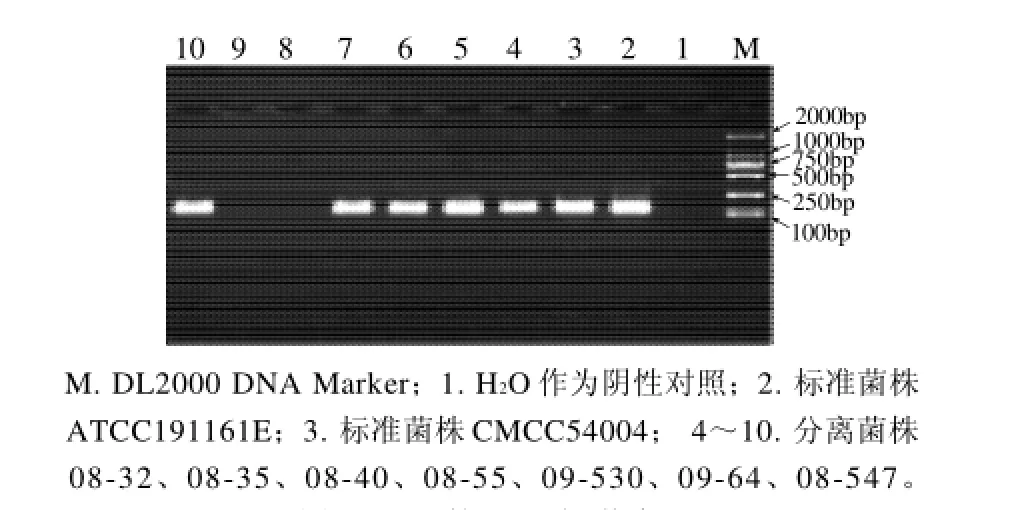
图5 inlB的PCR扩增结果Fig.5 Agarose gel electrophoregrams of PCR amplification products ofinlB
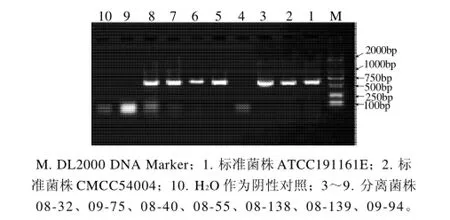
图6 inlC的PCR扩增结果Fig.6 Agarose gel electrophoregrams of PCR amplification products ofinlC

图7 inlJ的PCR扩增结果Fig.7 Agarose gel electrophoregrams of PCR amplification products ofinlJ
2.2 小鼠毒力实验结果
从40株单增李斯特氏菌分离株中选取21株毒力基因携带具有差异性的菌株进行小鼠毒力实验,结果见表3。

表3 小鼠毒力实验结果Table 3 Results of toxicity test in mice
如表3所示,番茄分离株09-132毒力最弱(LD50为1.7×1011CFU/mL)。有4株单增李斯特氏菌分离株(08-32、09-137、09-116、09-465)的毒力与标准菌株ATCC191161E相当,LD50在1.2×108~6.0×108CFU/mL之间。其他分离株的毒力弱于标准菌株ATCC191161E,LD50介于2.1×109~7.3×1010CFU/mL之间。
2.3 单增李斯特氏菌毒力基因与毒力的相关性分析
食品分离株的毒力强弱与血清型无关。一般研究认为,食源性李斯特氏菌病发生多由血清4b型引起,其次是1/2a、1/2b[10],但本实验发现少数4d、4c血清型菌株的毒力强于4b、1/2a及1/2b血清型的菌株,它们同样具有引起食源性李斯特氏菌病发生的可能性。通过血清分型来排除弱毒株的方法是不可行的。
从速冻食品中分离出的单增李斯特氏菌,发现有特异型缺乏hly、prfA的菌株,但这些菌株的毒力与标准强毒株的毒力相比没有明显降低,可能是变异产生了其他未知的毒力因子,有待于进一步研究。 有一株生肉中分离出的单增李斯特氏菌(07-140),缺失hly、plcB、inlC、inlJ、prfA基因,小鼠LD50为 6.0×109CFU/mL,其毒力较强毒株ATCC191161E(2.5×108CFU/mL)略低,可见inlA、inlB所产生的毒力因子对菌株致病力的贡献较大。
缺失plcB基因的菌株毒力(6.0×108CFU/mL)较其他毒力基因携带完整的菌株略低,但不存在显著的相关性。
内化素基因(inlA、inlB、inlC、inlJ)缺失的菌株与携带完整毒力基因的菌株相比相对毒力差异较大,内化素基因的缺失可能是导致菌株毒力降低的原因,缺失不同内化素基因的菌株毒力差异见表4。

表4 缺失不同内化素基因的菌株毒力Table 4 Mouse virulence ofListeria monocytogenesstrains losing different internalized genes
由表4可知,内化素基因inlA、inlB、inlJ、inlC与菌株毒力存在显著相关性,inlC对菌株毒力的影响较大,可作为区分强毒株和弱毒株的标志基因。但不同内化素基因与毒力的相关性还需进一步研究。
3 讨 论
单核细胞增生李斯特氏菌为一嗜冷菌,能在食品低温冷藏过程中生长繁殖。美国每年大约有2500人因感染单增李斯特氏菌继发严重的疾病,大约有500人死亡[11]。我国食品污染物监测网从2000 年起开展对食品中单增李斯特氏菌的监测,随着对该菌的重视和检测技术的提高,食品中单增李斯特氏菌的检出率明显提高。
实验中有2株分离株API Listeria生化试剂条结果为单增李斯特氏菌,但7种毒力基因均未被检测到,因此认为此两株菌可能是单增李斯特氏菌,未将其计入实验统计数据。可见传统的生化检验并不完全准确,单增李斯特氏菌的毒力基因检测可以是传统鉴定方法的一个补充,建立PCR方法检测毒力基因对快速诊断食物中毒具有现实意义。
目前有关报道表明所有致病性的单增李斯特氏菌都含有inlA、inlB[12-13],本实验结果显示同时含有inlA、inlB内化素基因的菌株约占89.7%,可见该地区存在着该菌引起李斯特氏菌病的潜在危险,尤其是速冻食品、肉制品和水产品中同时含有inlA、inlB的菌株所占比例较大,番茄中的单增李斯特氏菌不含有inlA、inlB,自然界中可能存在已发生变异的非典型的单增李斯特氏菌,缺失或改变了这些基因,这些变异对它的生存、繁殖、致病性等方面到底有何影响需要进一步研究。
随着inlA、inlB、inlC、inlJ天然缺失株的出现,可以推测单增李斯特氏菌某些对致病力起决定作用的毒力基因正在消失。病原菌这种向着毒力减弱或消失方向进化的例子比较罕见。但从理论上讲,像单增李斯特氏菌这样亦可在自然界(如水、土壤、植物等) 自由生活的细菌,与致病力相关的基因对其并非必需,将其缺失并不影响细菌的生存与增殖[14],因此这样的基因片段可以看作一种不必要的负荷,即“基因垃圾”;在自然选择的压力下,这种垃圾基因可能会被清除,以使细菌能更好地适应生存环境。
[1]柳增善. 食品病原微生物学[M]. 北京: 中国轻工业出版社, 2007: 258.
[2]JIANG Lingli, CHEN Jianshun, XU Jingjing, et al. Virulence characterization and genotypic analyses of Listeria monocytogenes isolates from food and processing environments in eastern China[J]. International Journal of Food Microbiology, 2008, 121(1): 53-59.
[3]LIU Dongyou, LAWRENCE M L, AINSWORTH A J, et al. Toward an improved laboratory definition of Listeria monocytogenes virulence[J]. International Journal of Food Microbiology, 2007, 118: 101-115.
[4]胡杨峰. 食源性单核增生性李斯特氏菌分布及其内化素基因分布研究[D]. 保定: 河北农业大学, 2009.
[5]RAWOOL D, MALIK S, SHAKUNTALA I, et al. Detection of multiple virulence-associated genes in Listeria monocytogenes isolated from bovine mastitis cases[J]. International Journal of Food Microbiology, 2007, 113(2): 201-207.
[6]张辉, 王兴龙. 食品中单核细胞增生性李斯特氏菌PCR快速检测[J].食品科学, 2008, 29(4): 324-327.
[7]陈巧妙, 陈健舜, 吴迪天, 等. 天然缺失inlAB的非典型单核细胞增多性李斯特菌生物学特性鉴定[J].微生物学报, 2009, 49(8): 1033-1039.
[8]RODRIGUEZ-LAZARO D, JOFRE A, AYMERICH T, et al. Rapid quantitative detection of Listeria monocytogenes in meat products by real-time PCR[J]. Applied and Environmental Microbiology, 2004, 70: 6299-6301.
[9]LIU Dongyou. Listeria monocytogenes: comparative interpretation of mouse virulence assay[J]. FEMS Micro-Biology Letters, 2004, 233(1): 159-164.
[10]ZHOU Xiaohui, JIAO Xinan. Molecular grouping and pathogenic analysis of Listeria monocytogenes of clinical and food origin[J]. Food Control, 2005, 16: 867-872.
[11]KESSEL J S V, KARNS J S, GORSKI L, et al. Prevalence of Salmonellae, Listeria monocytogenes, and fecal coliforms in bulk tank milk on US dairies[J]. Journal Dairy Science, 2004, 87(9): 2822-2830.
[12]祝仁发, 叶长芸. 单核细胞增生李斯特菌的毒力因子[J]. 中国食品卫生杂志, 2007, 19(2): 158-162.
[13]陈健舜, 江玲丽, 方维焕. 李斯特菌毒力因子及其进化[J]. 微生物学报, 2007, 47(4): 738-742.
[14]RAGON M, WIRTH T, HOLLANDT F, et al. A new perspective on Listeria monocytogenes evolution[J]. Plos Pathog, 2008, 4(9): e1000146 (1-14).
Rapid PCR Detection of Listeria monocytogenes Virulence in Food
YU Feng-yu1,LI Lin1,WANG Hong2,WANG Wen-zhen2,HE Yuan2,LIU Xiao-peng2, LING Hua2
(1. College of Food Science, Southwest University, Chongqing 400715, China;2. Chongqing Center for Disease Control and Prevention, Chongqing 400042, China)
Objective: The virulence-associated genes of Listeria monocytogenes (L.m) isolates were detected by PCR amplification assay in order to provide experimental
for evaluating the virulence of L.m isolates and effectively limiting the transmission of L.m. Methods: Forty strains of L.m isolated in Chongqing from 2007 to 2009 were subjected to the PCR detection of seven virulence-associated genes (hly, plcB, inlA, inlB, inlC, inlJ, prfA) and toxicity test in mice. Results: The PCR assay revealed that 15 of the 40 L.m isolates possessed all the seven virulence-associated genes, 6 strains were hly-, 4 strains were plcB-, 4 strains were prfA-, 5 strains were inlA-, inlB-, 11 strains were inlC-, 9 strains were inlJ-, and 1 strain was negative for inlA, inlB, inlC and inlJ. Four isolates were defined as virulent strains, whose virulence was equivalent to the standard strain, ATCC 1961E with a mouse LD50 between 1.2 × 108CFU/mL and 6.0 × 108CFU/mL. The LD50 of the screened low virulent strain 09-132 was 1.7 × 1011CFU/mL . Conclusions: There is a potential risk of Listeria food poisoning in Chongqing City, and the internalized gene (inlA, inlB, inlC, inlJ) loss may lead to virulence declination, while the prfA and plcB genes are less relevant to the virulent isolates.
Listeria monocytogenes;virulence;gene;PCR
TS 207.7
A
1002-6630(2010)23-0164-05
2010-08-02
于丰宇(1985— ),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:1985yufengyu@163.com
