基于罗丹明-噻吩类化合物的汞离子荧光探针的研究
2010-03-23张卫军王作茂渠凤丽
张卫军,王作茂,渠凤丽*
(1.湖南科技学院,湖南永州425100)
(2.曲阜师范大学化学与化工学院,山东省生命有机分析重点实验室,山东曲阜273165)
0 引言
汞元素是一种重金属元素,以多种形态(游离态、无机和有机汞)存在于自然界中。二价汞离子(Hg2+)比一价汞离子(Hg+)更为常见,具有很强的腐蚀性和致癌性,是常见的环境污染物之一。有机汞(特别是甲基汞)可以在海洋生物体内累积,能通过食物链转移到人体内,导致大脑损伤和其它慢性疾病,最典型的例子就是在日本发生的水俣病[1]。因此,汞离子作为一种水体污染物的检测就显得非常重要。
目前很多分析方法已被用来测定汞离子,如原子吸收光谱法[2]、电感耦合等离子体质谱法[3]、冷原子荧光光度法[4]、电感耦合等离子体原子发射光谱法[5]、电化学方法[6]以及紫外可见光谱法[7]等。尽管这些方法的灵敏度比较高但都具有检测成本高、样品前处理复杂、费时,不适用于实时和现场检测等缺点。由于荧光探针在选择性、检测成本等方面具有绝对的优势,目前设计和使用荧光探针来检测汞离子引起了分析工作者的广泛关注。
汞离子能和荧光分子自旋轨道进行耦合,猝灭荧光分子的荧光[8],是一种常见的荧光猝灭剂。故大多数测定汞离子的荧光探针都是基于荧光猝灭机理进行的[9],其灵敏度低于增强型的探针。但是在已经报道荧光探针中,只有很少一部分是基于荧光增强原理来测定汞离子的[10]。因此,对荧光增强型汞离子探针的研究仍是一个比较活跃的领域,同时也是一个挑战。罗丹明及其衍生物具有摩尔消光系数大、荧光量子产率高[11]、相对长的激发波长(>500 nm)和发射波长等优点,这些优点使其具备了成为荧光探针载体的潜力。目前已经报道了一些基于罗丹明的荧光探针,它们可以通过颜色和荧光信号的变化来检测Cu2+[12],Pb2+[13],Cr3+[14]和Fe3+[15]等金属离子。其检测机理是离子加入前后探针的结构发生了变化:加入离子之前探针以罗内酰胺的结构存在并且不显示荧光,颜色为无色,加入离子之后探针的罗内酰胺结构被打开发出强的荧光,颜色变为红色;离子是通过可逆的配位反应或不可逆的化学反应使得探针的罗内酰胺结构被打开。利用上述原理,该文报道了一种基于罗丹明-噻吩类化合物的新型汞离子荧光探针,并对其测定的具体条件进行了研究。
1 实验部分
1.1 仪器与试剂
所有的荧光测定在Perkin Elmer LS55荧光光谱仪上进行(激发狭缝:10.0 nm,发射狭缝:10.0 nm);紫外可见光谱在UV-2450紫外仪上测定;核磁共振谱在Varian INOVA-400光谱仪上获得(用CDCl3作溶剂),溶液的pH值用Mettler toledo delta 320 pH计测定。
2-氨乙基噻吩(TEA)购买于Alfa Aesar公司,罗丹明B从上海国药集团有限公司购得。除特别指明外,其它的化学药品都是分析纯试剂,不需要进一步的纯化和处理,可以直接使用。实验过程中所用的水均为二次水。
1.2 化合物的合成
化合物1的合成路线见图1。
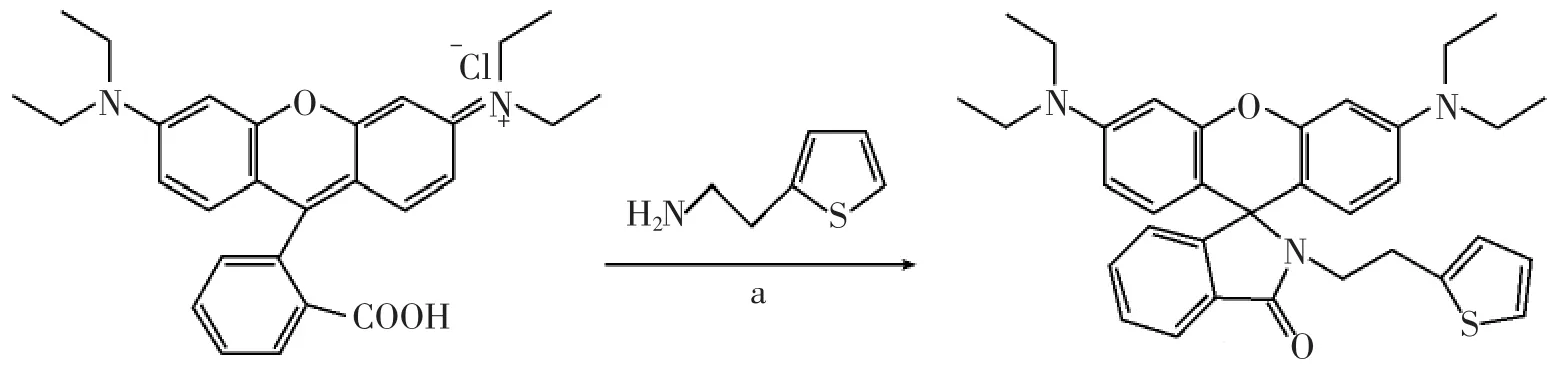
图1 化合物1的合成(a),甲醇,60℃,12 h,11%Fig.1 Synthesis of compound 1.(a)methanol,60℃,12 h,11%
化合物1(RBTEA)的合成:罗丹明B(96 mg,0.20 mmol)和2-氨乙基噻吩(25 mg,0.20 mmol)加入到15 mL的甲醇中,然后在60℃搅拌反应12 h。混合物冷却至室温后减压蒸馏去除溶剂,以二氯甲烷/乙醇(体积比为20∶1)为洗脱剂经柱层析得到固体(1)12 mg,产率为11%。1H NMR(400 MHz,CDCl3),δ(ppm):1.16(t,J=7.2 Hz,12 H),2.68(t,J=8.0 Hz,2 H),3.31~3.39(m,10 H),6.25~6.27(m,2 H),6.40~6.45(m,4 H),6.34(d,J=2.4 Hz,1 H),6.80~6.82(m,1 H),7.01~7.03(m,1 H),7.09~7.12(m,1 H),7.44~7.46(m,2 H),7.91~7.93(m,1 H)。13C NMR(400 MHz,CDCl3):12.89,28.89,42.45,44.66,65.26,98.12,108.47,123.07,123.59,124.09,124.35,125.13,126.94,128.33,129.17,131.81,132.62,142.21,149.12,153.73,168.020。MS(ESI)m/z:552.3(M+H)。
1.3 荧光强度的测量
将适量的化合物1溶解于乙睛中制得5.0×10-5mol/L化合物1的标准溶液。
用pH为6.0的Tris-HNO3缓冲溶液逐级稀释1.0×10-2mol/L硝酸汞溶液得到5×10-7~1×10-3mol/L Hg2+工作液。
不同pH的溶液是用HNO3或者NaOH调节0.05 mol/L Tris-HNO3溶液制得的。
在10 mL的容量瓶中加入4.0 mL 5.0×10-5mol/L化合物1的标准溶液和1.0 mL不同浓度的Hg2+溶液,然后用Tris-HNO3定容。这样得到的溶液中含有2×10-5mol/L化合物1和5×10-8~1×10-4mol/L Hg2+,化合物1的空白溶液是在相同条件下制备的,但不加入Hg2+。所有溶液在4℃下避光保存,以备下一次使用。
荧光强度测定时,固定激发波长为520 nm,记录540~650 nm范围内的荧光强度的变化。每次测量前,混合溶液放置5 min,以便络合完全。
2 结果和讨论
2.1 光谱性质
在25℃,记录探针1(2×10-5mol/L)在乙腈/水(体积比为1∶1)的0.05 mol/L Tris-HNO3(pH6.00)缓冲溶液中荧光发射光谱的变化。图2是荧光探针1在不同浓度Hg2+溶液中的荧光发射光谱图。

图2 不同浓度的汞离子存在时化合物1(20 μmol/L)的荧光发射光谱图(汞离子的浓度从1到12依次是0,0.05,0.1,0.25,0.5,1,2.5,5,10,25,50,100 μmol/L,实验测定是在pH6.00的Tris-HNO3中测定)Fig.2 Changes of the fluorescence spectra of probe 1(20 μmol/L)in the prescence of various concentrations of Hg2+:0,0.05,0.1,0.25,0.5,1,2.5,5,10,25,50,100 μmol/L from 1 to 12(λex=520 nm).These spectra were measured in 0.05 mol/L Tris-HNO3buffer(pH6.00)
从图2中可以看出:在Hg2+加入之前,化合物1在580 nm处有一个微弱的荧光发射峰;加入Hg2+之后,化合物1在该波长处的荧光发射强度显著增加,并且该荧光发射强度随着Hg2+浓度的增加而增加直至达到最大值。当过量的Hg2+存在时,化合物1在580 nm处的荧光发射强度增加了14.5倍。这些实验结果表明化合物1和Hg2+发生了相互作用,该文正是基于此来测定Hg(Ⅱ)浓度的。
为了进一步弄明白化合物1和汞离子的响应机理,进一步研究了探针1在Hg2+前后溶液的紫外吸收光谱,实验结果见图3。从图3中可以看出:没有Hg2+存在时,化合物1在560 nm处有微弱的吸收峰,这说明化合物1在没Hg2+存在时可能是以罗内酰胺形式存在的;当存在10-5mol/L Hg2+时,化合物1在560 nm出现强的吸收峰,这说明Hg2+存在时化合物1的罗内酰胺结构可能被打开。紫外可见吸收光谱表明Hg2+和化合物1发生相互作用使得化合物1的罗内酰胺结构被打开。
2.2 测定原理
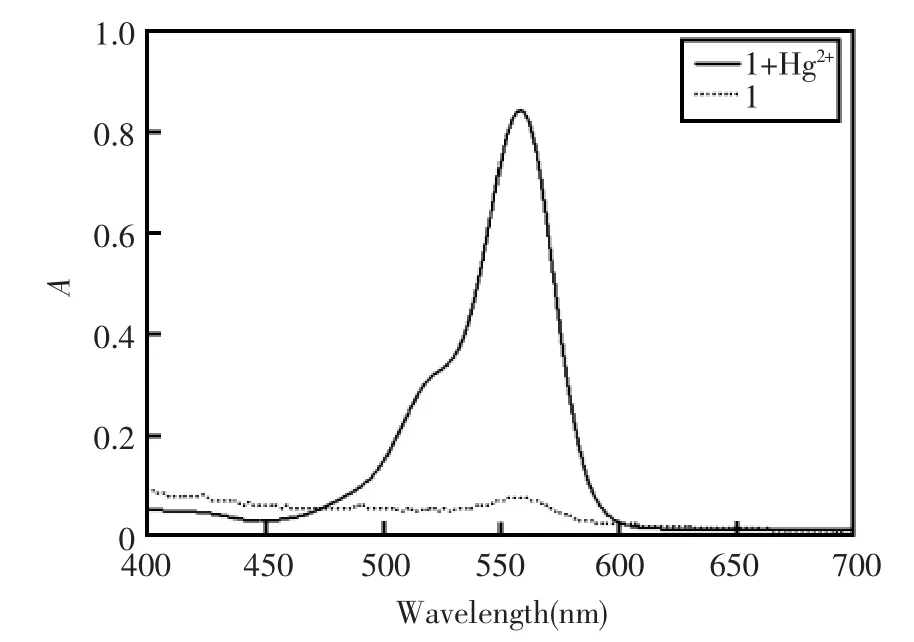
图3 汞离子(20 μmol/L)加入前后化合物1(20 μmol/L)的紫外可见光谱图(其中虚线表示加入Hg2+之前,实线表示加入Hg2+之后)Fig.3 UV-spectra of probe 1(20 μmol/L)before(…)and after(—)the addition of Hg2+(20 μmol/L)in pH6.0 Tris-HNO3buffer
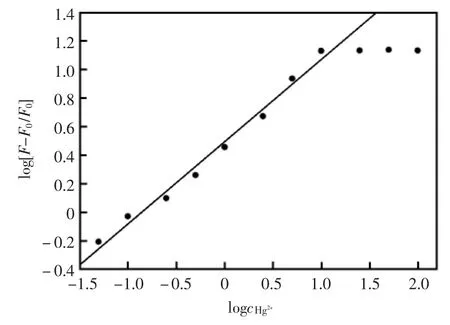
图4 log[(F-F0)/F0]和logcHg2+的关系曲线图(F0和F分别代表加入汞离子前后化合物1的荧光强度值)Fig.4 Plot of log[(F-F0)/F0]as a function of the logcHg2+.F0and F are the fluorescence intensity of 1 in the absence and presence of Hg2+,respectively
如图4所示,化合物1的荧光强度随着汞离子浓度的增加而增加,当汞离子和化合物1物质的量比为1∶2时其荧光强度保持不变。在汞离子浓度为5×10-8~1×10-5mol/L的范围内log[(F-F0)/F0]与logcHg2+呈良好的线性关系,其校正曲线可用式(1)表示:
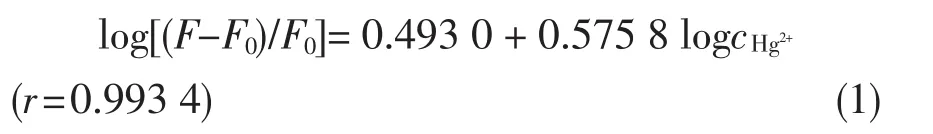
其中r代表线性相关系数,F0指化合物1的空白溶液的荧光强度值,F代表加入汞离子之后化合物1的荧光强度值,cHg2+代表加入的汞离子浓度。经荧光滴定曲线可计算Hg2+和化合物1的结合常数是7.50×105mol/L,检测下限是2.0×10-8mol/L。
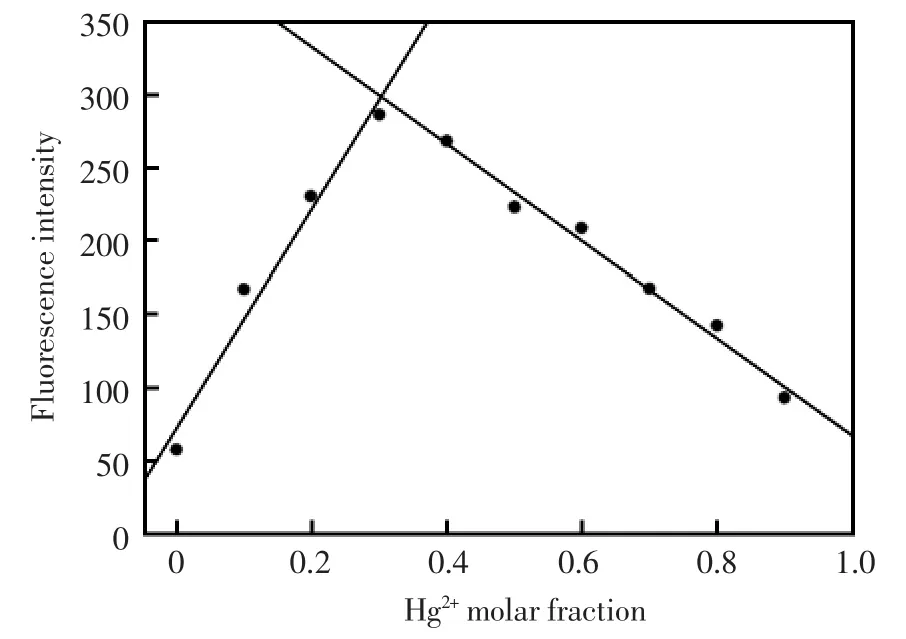
图5 化合物1的Job曲线图Fig.5 Job's plot for probe 1 in 0.05 mol/L tris-HNO3buffer(V(acetonitrile)∶V(water)=1∶1,pH6.00).The totalconcentration of 1 and Hg2+was 30 μmol/L(λex=520 nm)
为了更好地研究化合物1与汞离子的配比,研究了Job曲线图。实验结果见图5。从图5可以看出当汞离子的摩尔百分比在0.33时化合物1的荧光强度达到最大值,这也表明汞离子和化合物1是以1∶2配位的。因此,提出了化合物1和汞离子形成2∶1络合物的可能结构模型(如图6所示)。
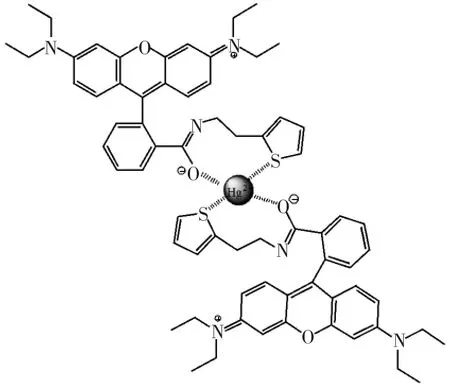
图6 化合物1和汞离子可能的结合模型Fig.6 Possible coordination mode for probe 1 with Hg2+
2.3 pH的影响
图7显示了加入汞离子(浓度为1×10-5mol/L)前后不同的pH值对化合物1荧光强度的影响。
图7 不同pH值在加入Hg2+前后对化合物1荧光发射强度的影响(其中实线表示加入Hg(Ⅱ)之前,虚线表示加入Hg2+之后,Hg(Ⅱ)的浓度固定在10 μmol/L)Fig.7 pH dependence of the fluorescence intensity of 20 μmol/L probe 1 in the absence and presence of Hg2+.The excitation wavelength was 520 nm
从图7中可以看出,当没有Hg2+时化合物1的荧光强度在pH(4~12)之间保持不变;在pH小于4时化合物1的荧光强度随pH的减少而增加,这可能在强酸性条件下化合物1的罗内酰胺开环导致其荧光增强。当存在1×10-5mol/L Hg2+时化合物1的荧光强度在pH(4~7)之间保持不变;当pH(7~8)之间,荧光强度随pH的增加而减小,这可能是在碱性条件下,Hg2+会形成Hg(OH)2,从而减少了其和化合物1的配位;在pH(8~12)之间荧光强度基本保持不变且和pH(4~12)之间不加Hg2+的化合物1的荧光差不多。这些实验结果表明,在pH(4~7)范围内,化合物1对Hg2+的测量不受pH的影响。考虑到灵敏度和反应速度,选择pH6.0的Tris-HNO3为最佳实验条件。
2.4 选择性
研究了探针1(2×10-5mol/L)在不同金属阳离子(1×10-5mol/L)单独存在时荧光发射强度的变化,从而探讨探针1对汞离子的选择性,实验结果见图8黑色柱状图。从图8的黑色柱状图中可以看出,当Hg2+加入时探针1的荧光强度大大增强,而加入Cu2+后,探针1的荧光强度有微弱的增强。其它离子对探针1的荧光强度基本没有影响。进一步考察了在其它金属离子和汞离子共存时对汞离子测定的影响,如图8的白色柱状图。从图8的白色柱状图中可以看出,除了Cu2+,其它金属离子对Hg2+的测定基本没影响。因此,除铜离子干扰外,化合物1对汞离子有好的选择性。
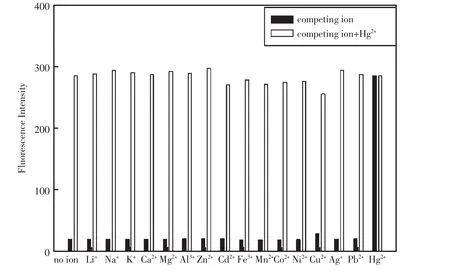
图8 化合物1对金属离子的选择性(所有离子的浓度均为10 μmol/L,黑色柱状图代表加入不同的金属离子,白色柱状图代表在汞离子存在时加入不同的金属离子)Fig.8 Metal ion selectivity of probe 1(20 μmol/L).All data were obtained at pH6.0 Tris-HNO3buffer(V(acetonitrile)∶V(water)=1∶1).The conentration of ions added to probe 1 was10 μmol/L for all ions.The excitation wavelength was 520 nm.Black bars:different metal ions were added.White bars:different metal ions in the presence of Hg2+were added
2.5 初步的分析应用
将所制备的荧光探针用于湘江水及自来水中汞离子回收率的测定。湘江水和自来水在经简单过滤处理后用所制荧光探针测定汞离子含量,得知其中不含汞离子,然后分别加入不同浓度的Hg2+的标准溶液。结果列于表1。从表1中可以看出,该荧光探针对湘江水及自来水中Hg2+回收率的测定结果令人满意,所以该探针可用于实际样品中Hg2+的分析测定。
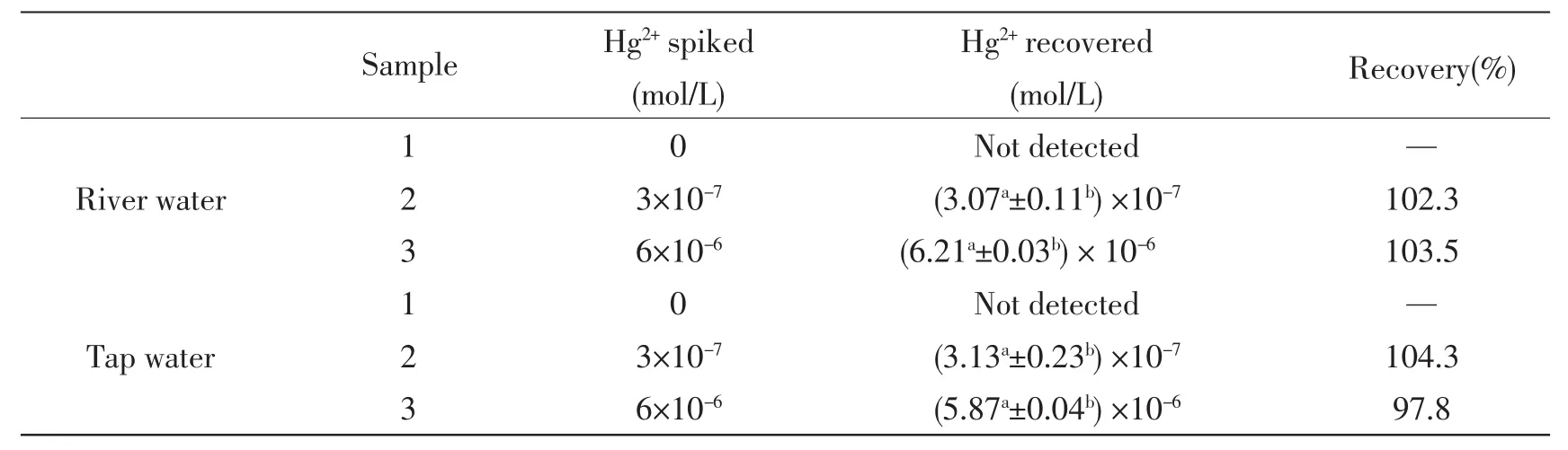
表1 湘江水和自来水的回收率实验Tab.1 Determination of Hg2+in tap and river water samples with probe 1
3 结论
该文制备了一个基于罗丹明-噻吩类化合物的汞离子荧光探针,当汞离子存在时该探针荧光发射强度增强同时溶液由无色变为粉红色,从而实现Hg2+的选择性识别。该探针对Hg2+的线性响应范围是5×10-8~1×10-5mol/L,检测下限是2.0×10-8mol/L,pH工作范围是4.0到7.0。该探针对汞离子检测具有较高的灵敏度和较好的选择性,已被用于检测自来水和河水中的汞离子,测定结果令人满意。
[1]Petanen T,Romantschuk M.Use of bioluminescent bacterial sensors as an alternative method for measuring heavy metals in soil extracts[J].Analytica Chimica Acta,2002,456(1):55~61.
[2]Tseng C M,De Diego A,Martin F M,et al.Rapid determination of inorganic mercury and methylmercury in biological reference materials by hydride generation,cryofocusing,atomic absorption spectrometry after open focused microwave-assistedalkalinedigestion[J].Journal of Analytical Atomic Spectrometry,1997,12(7):743~750.
[3]Li Y,Chen C,Li B,et al.Elimination efficiency of different reagents for the memory effect of mercury using ICPMS[J].Journal of Analytical Atomic Spectrometry,2206,21(1):94~96.
[4]Vallant B,Kadnar R,Goessler W.Development of a new HPLC method for the determination of inorganic and methylmercury in biological samples with ICP-MS detection[J].Journal of Analytical Atomic Spectrometry,2007,22(3):322~325.
[5]Chen Y W,Tong J,D'Ulivo A,et al.Determination of mercury by continuous flow cold vapor atomic fluorescence spectrometry using micromolar concentration of sodium tetrahyroborate as reductant solution[J].Analyst,2002,127(11):1 541~1 546.
[6]Anthemidis A N,Zachariadis G A,Michos C E,et al.Time-based on-line preconcentration cold vapour generation procedure for ultra-trace mercury determination with inductively coupled plasma atomic emission spectrometry[J].Analytical and Bioanalytical Chemistry,2004,379(5-6):764~769.
[7]Perez-Marin L,Otazo-Sanchez E,Macedo-Miranda G,et al.Mercury(Ⅱ)ion-selective electrode.Study of 1,3-diphenylthiourea as ionophore[J].Analyst,2000,125(10):1 787~1 790.
[8]Tan J,Yan X P.2,1,3-Benzoxadiazole-based selective chromogenic chemosensor for rapid naked-eye detection of Hg2+and Cu2+[J].Talanta,2008,76(1):9~14.
[9]McClure D S.Spin-orbitinteractioninaromatic molecules[J].The Journal of Chemical Physics,1952,20(4):682~686.
[10]Metivier R,Leray I,Valeur B.Lead and mercury sensing by calixarene-based fluoroionophores bearing two or four dansyl fluorophores[J].Chemistry-A European Journal,2004,10(18):4 480~4 490.
[11]Nolan E M,Lippard S J.A“turn-on”fluorescent sensor for the selective detection of mercuric ion in aqueous me-dia[J].Journal of the American Chemical Society,2003,125(47):14 270~14 271.
[12]Lakowicz J R.Principles of Fluorescence Spectroscopy,3rd ed[M].Springer:New York,2006;pp 67~69.
[13]Swamy K M K,Ko S K,Kwon S K,et al.Boronic acidlinked fluorescent and colorimetric probes for copper ions[J].Chemical Communications,2008,(45):5 915~5 917.
[14]Kwon J Y,Jang Y J,Lee Y J,et al.A highly selective fluorescent chemosensor for Pb2+[J].Journal of the American Chemical Society,2005,127(28):10 107~10 111.
[15]Mao J,Wang L,Dou W,et al.Tuning the selectivity of two chemosensors to Fe(Ⅲ)and Cr(Ⅲ)[J].Organic Letters,2007,9(22):4 567~4 570.
