Pt/CNT修饰的TiO2纳米管在甲醇催化氧化中的应用
2010-03-23刘绍欢康青杨丽霞蔡青云
刘绍欢,康青,杨丽霞,蔡青云
(湖南大学化学化工学院,化学生物传感与化学计量学国家重点实验室,长沙410082)
0 引言
由于具有高能量、实用性、可携带性等优点,直接甲醇燃料电池(DMFCs)在移动电源、电动汽车和交通运输等方面有良好应用前景。用阳极催化剂制备DMFC方面,已有大量研究文献作了报道[1~4]。一般使用的催化剂是Pt,但是其价格昂贵,而且由于在阳极氧化中间产物CO易使Pt催化剂中毒,降低Pt的催化活性。因此,研究高催化活性和能抗中毒的阳极催化剂是一很重要的课题。一些研究组报导了PtRu,PtSn和PtNi等铂的复合催化剂对提高甲醇氧化的电催化活性和防止由于甲醇氧化中间产物引起的中毒现象有较好的作用[5~11]。这些电催化剂通过“双官能团效应”在Ru或其它元素活性位吸附含氧基团,促使CO等中间物在Pt上氧化除去;或通过Ru或其它元素对Pt的“电子效应”(杂化效应),改变Pt的电子特性促使CO等氧化脱除,恢复电催化剂催化活性。为了得到分散性好、利用率高、稳定的纳米金属催化剂,催化剂载体的选择便显得十分重要。相对于纯金属催化剂,负载型催化剂具有更高的催化活性和稳定性。在直接甲醇燃料电池阳极催化剂中,经常使用最多的载体是碳黑。除此之外,碳纳米管、碳纳米纤维等由于具有独特的机械和电子特性,在催化、能源等方面具有较好的应用前景。已有大量的文献报道了以石墨[12~13]、碳纳米管(CNT)[14~15]、Nafion离子交换膜[16]为载体制取高分散,高催化活性Pt颗粒复合催化电极,降低了Pt的用量和提高了电极材料对甲醇阳极氧化的催化性能。
近年来,TiO2作为半导体材料,在光催化、能量转换等领域有大量应用,但电催化方面应用较少。Liu等[17]发现TiO2和Pt之间有协同作用,使CO易于氧化。Yang等[18]证实Pt/C修饰的TiO2纳米管,是一种性能优异的甲醇催化氧化反应阳极材料,为以后的DMFC的开发和应用探出了一条新的途径。Wang等[19]利用TiO2纳米管制备了新型的Pt/TiO2纳米管电催化剂,相对纯Pd、Pd-TiO2纳米颗粒催化剂其在酸性介质中对甲醇具有极好电催化氧化活性。TiO2纳米管作为具有特殊管状结构的半导体材料,Mor等[20]已经研究了其作为光催化剂在光解水制氢领域的应用。
该文以TiO2纳米管阵列作为载体,用化学气相沉积法,镍作为催化剂,在TiO2纳米管阵列的表面上修饰了具有一定石墨化程度的碳纳米管(CNT),再利用电沉积修饰Pt纳米颗粒,简称Pt/CNT/TiO2纳米管,构建了一种新的DMFC的阳极材料。
1 实验部分
1.1 试剂与仪器
钛片(99.8%,厚0.127 mm)购买于Aldrich(Milwaukee,WI)公司。NaF、NaHSO4聚乙二醇6000、Ni(NO3)2、CH3OH、NaOH、H2PtCl6等试剂均为分析纯。制备了10 mmol/L的H2PtCl6。所有溶液均用二次蒸馏水配制。
所有电化学测试均采用CHI电化学工作站(上海辰华仪器公司)在三电极体系的电解池中进行。对电极为铂丝,参比电极为饱和甘汞电极,Pt/CNT/TiO2为工作电极。JSM-6700F型扫描电子显微镜及其携带的能谱仪(日本JEOL公司)观察TiO2/CNT电极的微观形貌及电极元素含量的分析。
1.2 Pt/CNT/TiO2纳米管阵列电极制备
实验采用纯度为99.8%的钛箔(厚度为0.127 mm),裁剪成1 cm×1 cm,钛片依次在无水乙醇和丙酮溶液中超声振荡5 min,然后用二次蒸馏水冲洗待用。室温下,铂片作对电极,钛片为阳极,在0.1 mol/L NaF和0.5 mol/L NaHSO4电解液中,采用15 V直流电压阳极氧化3 h,制得的样品用大量的水冲洗,自然干燥。
然后,以TiO2纳米管为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝为对电极。采用恒电流法,将Ni纳米粒子电沉积于TiO2孔径内。沉积条件:5 mmol/L NiSO4,沉积的电流密度0.005 A/s,负载量通过时间调控,分别为17 s,34 s,51 s。再以聚乙二醇为碳源,Ni纳米颗粒为催化剂,以1℃/min的升温速率至600℃,保温3 h,以1°C/min的降温速率降至室温,即可获得CNT修饰的TiO2纳米管(CNT/TiO2)。采用循环伏安法,2.5 mmol/L K3Fe(CN)6+2.5 mmol/L K4Fe(CN)6的水溶液中来研究所制备材料的电催化性能。
采用上述的三电极体系,CNT/TiO2为工作电极恒电流法沉积铂纳米颗粒。沉积条件:5 mmol/L H2PtCl6镀液;沉积的电流密度0.005 A/s,负载量通过时间调控,分别为10 s,20 s,30 s。Pt/CNT/TiO2的有效电极面积是1 cm2。
1.3 电化学测试
监测甲醇的催化氧化反应所用的循环伏安法(CV)实验都在电化学工作站上进行。甲醇的催化氧化是在2 mol/L CH3OH+0.5 mol/L NaOH溶液中进行,正向扫描,扫描的速度是100 mV s-1。每次电化学实验前先向溶液中通入高纯氮气15 min,以除去溶解在水中的氧气。
2 结果与讨论
2.1 电极形貌的表征
研究发现,TiO2纳米管阵列可在长度为2~1 000 μm之间调控,长的纳米管阵列在光催化应用上效果良好,但在甲醇催化氧化的应用中,所用电极应有良好的导电性,引导电子的传输,所以短的TiO2纳米管阵列更适合应用于该电化学反应。

图1 复合材料的SEM和Raman图谱图1(a)纯的TiO2纳米管阵列;(b)CNT/TiO2纳米管阵列;(c)Pt/CNT/TiO2纳米管阵列的SEM图;(d)CNT/TiO2纳米管阵的Raman图Fig.1 SEM of(a)pure TiO2NTs;(b)CNT/TiO2NTs;(c)Pt/CNT/TiO2NTs;and Raman spectra of(d)CNT/TiO2NTs
图1为TiO2纳米管阵列和CNT/TiO2及CNT/Pt/TiO2电极的SEM图和Raman图谱。如图1(a)所示,TiO2纳米管阵列的孔径为90 nm,长300 nm。图1(b)为无序的CNT生长在TiO2纳米管阵列的形貌。CNT相互缠绕连接形成多孔网络状结构附着在TiO2纳米管阵列上,但又没有完全堵塞TiO2纳米管阵列。Liu等[21]发现聚乙二醇热解后,以二氧化钛为模板可以形成碳纳米棒。而实验中先在TiO2纳米管上修饰Ni纳米颗粒,作为聚乙二醇裂解碳化的催化剂,同时TiO2纳米管阵列表面形貌均一、多孔洞的纳米管阵列结构,在一定程度上与Ni纳米颗粒共同影响CNT的形貌。TiO2/CNT载体不仅比表面积大,同时导电性能十分优异,有利于Pt纳米颗粒的均相电沉积,使Pt均一地分布在载体中,有利于提高催化剂的利用率和对甲醇的电催化氧化活性。如图1(c)所示,Pt纳米颗粒的粒径大概是5~15 nm,均匀分布在TiO2/CNT载体的表面。实验中还研究了Ni对碳的石墨化影响,如图1(d)所示,出现了碳的D带(不规则的石墨层,1 320 cm-1)和G带(规则的石墨层,1 589 cm-1)的拉曼振动峰,表明部分的碳已经石墨化。当Ni的负载量不断增加时,无定形结构和石墨结构的晶型的峰高强度增加。其中无定形结构的碳会增加CNT/TiO2纳米管阵列表面对-OH的吸附力,而石墨碳会增加材料的导电性能,两者共同促进了甲醇的催化氧化。
2.2 CNT/TiO2纳米管阵列的电学性能研究
图2是CNT修饰的TiO2纳米管阵列的复合电极在5 mmol/L Fe2+/Fe3+的水溶液中的循环伏安曲线图。图中呈现峰形对称的氧化还原峰,说明电极的导电性能良好。
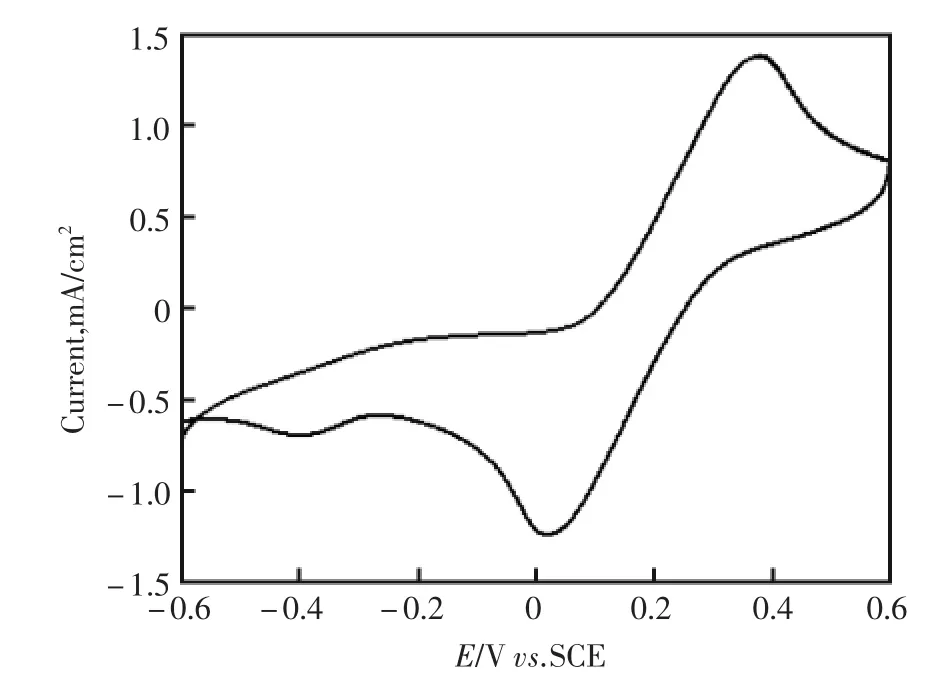
图2 CNT/TiO2纳米管阵列电极在5 mmol/L Fe2+/Fe3+溶液中的循环伏安曲线图Fig.2 CV of CNT/TiO2NTs in 5 mmol/L Fe2+/Fe3+solution
2.3 镍负载量对甲醇催化氧化反应速率的影响

图3 Ni做为碳催化剂,其负载量分别为(a)25.26 μg、(b)50.52 μg和(c)75.78 μg的Pt/CNT/TiO2纳米管陈列电极的循环伏安曲线图Fig.3 CV of Pt/CNT/TiO2NTs loaded with(a)25.26 μg,(b)50.52 μg,(c)75.78 μg,Ni as carbon catalyst,respectively
图3是固定Pt的量为50.52 μg时,Ni作为碳催化剂的负载量分别是(a)25.26 μg、(b)50.52 μg和(c)75.78 μg获得的CNT/TiO2纳米管阵列在碱性甲醇电解液中的MOR典型的循环伏安(CV)曲线图。如CV图所示,随着Ni负载量的增加,MOR的峰电流先增大后减少。当Ni负载量为50.52 μg时获得最大峰电流。这可能是因为Ni作为聚乙二醇分解碳化的催化剂,其负载量不同会影响碳源碳化的程度。但是MOR起峰的电位发生正移,这在DMFC的实际应用中是一个非常不利的因素,将会显著增加DMFC自身的耗能量。造成甲醇氧化峰电位正移的原因是:当镍的负载量增加时,Ni纳米颗粒会聚集,尺寸增加,会阻塞TiO2纳米管,减少TiO2纳米管的表面积,不利于碳纳米管的沉积,导致有效催化活性位点数量降低,不能充分的催化氧化吸附在Pt纳米颗粒上的甲醇分子,从而需要更高的电压来铺助甲醇氧化反应。此外,图3所示,在负扫过程中会发现一个小的氧化峰,这个小峰归因于正扫过程中产生的CO类物质的氧化,而CO类产物是Pt催化剂中毒并失去活性的主要原因。总的来说,当Ni负载量为50.52 μg时获得的CNT/TiO2纳米管阵列能很好的催化氧化甲醇,并能防止Pt催化剂中毒。
2.4 铂负载量对甲醇催化氧化反应速率的影响
图4是固定Ni的含量为50.52 μg时,Pt的含量分别是25.26 μg、50.52 μg和75.78 μg,甲醇催化氧化的CV图。如图所示,Pt的负载量增多,可以促进甲醇的催化氧化,甲醇氧化的峰电流越大。但是随着Pt的负载量的继续增大也存在氧化电位正移的不利现象。造成这一现象的原因是:Pt负载量的增加降低了CNT/TiO2纳米管阵列基底的比表面积,同时Pt纳米颗粒也会发现聚集,粒子的尺寸增加,不能充分催化氧化吸附在催化剂表面的甲醇分子。

图4 铂负载量分别为(a)25.26 μg、(b)50.52 μg和(c)75.78 μg的Pt/CNT/TiO2纳米管阵列电极的循环伏安曲线图Fig.4 CV of Pt/CNT/TiO2NTs loaded with(a)25.26 μg,(b)50.52 μg and(c)75.78 μg Pt,respectively
2.5 Pt/CNT/TiO2纳米管阵列的恒电位氧化曲线
图5为Pt/CNT/TiO2管阵列电极在2 mol/L CH3OH+0.5 mol/L NaOH溶液中的计时电流曲线,其中:(a)Pt负载量为75.78 μg cm-2,(b)Pt负载量为50.52 μg cm-2。由图可知,实验开始后甲醇氧化电流都呈现明显的下降趋势,这主要是因为随着氧化的不断进行,Pt氧化甲醇的毒性中间产物CO类不断在电极表面吸附聚集,使Pt中毒,活性位点减少的缘故。Pt/CNT/TiO2纳米管阵列在1 000 s的测试时间内表现出了较高的稳定性,说明Pt/CNT/TiO2纳米管阵列应用于MOR的优越性。从电镜图(图1)中可以看出CNT在TiO2纳米管上是围绕着纳米管的孔弯曲生长的,CNT与CNT之间的结合较疏松,从而加快了粒子之间的传递速度。另外,有着巨大表面积的纳米管结构更有利于Pt的电沉积反应在其上面进行,并使得沉积的Pt颗粒尺寸更小,分散性更好。从而保证了Pt催化剂的稳定性。

图5 不同Pt负载量的Pt/CNT/TiO2纳米管阵列电极的电流随时间的变化曲线(a)75.78 μg cm-2;(b)50.52 μg cm-2Fig.5 Chronoamperometry curves obtained on Pt/CNT/TiO2NTs loaded with(a)75.78 and(b)50.52 μg cm-2Pt
据Goodenough等[22]的催化氧化理论可知,在第一次正向扫描时甲醇等中间产物没有被完全氧化,在反向扫描时会进一步被氧化,得到第二个氧化峰。用Ipf表示第一次或正扫时的电流峰值,Ipb表示第二次或反扫时的电流峰值,Ipf与Ipb的比值可以用来描述催化剂抗毒能力的大小。较低的Ipf/Ipb值意味着甲醇氧化的中间产物在电极表面容易聚集,催化剂对甲醇的二次氧化能力较差,Ipf/Ipb值较高,则说明Pt催化剂催化活性好。表1总结了Pt负载量不同时所获得的Pt/CNT/TiO2纳米管阵列电极的Ipa/Ipf比值。由表可知,当Pt的负载量为50.72 μg cm-2时,Ipa/Ipf比值最高(8.02);单位质量Pt的MOR峰电流为3 527.3 mAcm-2(mg Pt)-1。但是综合比较发现,该电极b的氧化反应起峰的位置和最高峰电位相对于电极a发生正移,会降低DMFC的输出效率,而且Pt的负载量是电极a的二倍。电极a获得的Ipa/Ipf同样比较高(6.71),单位质量Pt的MOR峰电流仍可以达到5 229.6 mAcm-2(mg Pt)-1。因此实验中采用电极a作为最佳的Pt/CNT/TiO2纳米管阵列进行甲醇催化氧化实验。

表1 Pt的负载量不同时,Pt/CNT/TiO2的峰电流Tab.1 Peak value of current obtained on Pt/CNT/TiO2NTs loaded with different pt
3 甲醇催化氧化的机理研究
复合纳米催化剂对甲醇电氧化的高催化活性和稳定性主要是由下面几种因素决定的:(1)Pt纳米颗粒均匀的分散在CNT/TiO2表面,提高了Pt纳米颗粒的电化学活性比表面积,从而提高了Pt的利用率。(2)电沉积在CNT/TiO2表面的Pt纳米颗粒的粒径小,进一步提高了复合纳米催化剂的电催化活性[23]。(3)Pt和TiO2之间的相互作用改变了Pt表面的电子特性从而降低了CO在Pt表面的化学吸附强度,提高了催化剂对甲醇的氧化性能[24]。复合纳米催化剂表面存在多功能活性中心,CNT是由无定形的碳和石墨型的碳组成,无定形的碳能够吸附-OH,石墨型的碳具有良好的导电性,有利于电子传递。反应机理为:

Step 2和Step 1同步进行,在有效抑制Pt催化剂中毒的同时,显著提高了甲醇氧化反应效率。
4 结论
该文选用镍作为聚乙二醇分解碳化的催化剂,采用简单的化学气相沉积法,在TiO2纳米管阵列表面制备了多孔网状结构的CNT。该载体具有大的比表面积和优良的导电性,使Pt颗粒高度分散在载体的表面。该复合催化剂Pt/CNT/TiO2对甲醇具有较高的电化学氧化性能,单位质量Pt的MOR峰电流达到5 229.6 mAcm-2(mg Pt)-1。
[1]Fujiwara N,Fdeddch K A,Stimming V.Ethanol oxidation on PtRu electrodes studied by differential electrochemical mass spectrometry[J].Journal of Electroanalytical Chemistry,1999,472(2):120~125.
[2]Gotz M,Wendt H.Binary and ternary anode catalyst formulations including the elements W,Sn and Mo for PEMFCs operated on methanol or reformate gas[J].Electrochimica Acta,1998,43(24):3 637~3 644.
[3]Neto A O,Giz M J,Petez J,et al.The Electro-oxidation of Ethanol on Pt-Ru and Pt-Mo Particles Supported on High-Surface-Area Carbon[J].Journal of the Electrochemical Society,2002,149(3):A272~A279.
[4]Chi N,ChanK Y,Lee D P.Electrocatalytic oxidation of formic acid by Pt/Co nanoparticles[J].Catalysis Letter,2001,71(1-2):21~26.
[5]Lin Y,Cui X,Yen C H,et al.PtRu/carbonnanotube nanocomposite synthesized in supercritical fluid:A novel electrocatalyst for direct methanol fuel cells[J].Langmuir,2005,21(24):11 474~11 479.
[6]Rivera E C,Volpe D J,Alden L,et al.Electrocatalytic activity of ordered intermetallic phases for fuel cell applications[J].Journal of the American Chemical Society,2004,126(12):4 043~4 049.
[7]Ren X M,Zelenay P,Thomas S,et al.Recent advances in direct methanol fuel cells at Los Alamos National Laboratory[J].Journal of Power Sources,2000,86(1-2):111~116.
[8]Arico A S,Antonucci V,Giordano N,et al.Methanol oxidation on carbon-supported platinum-tin electrodes in sulfuric acid[J].Journal of Power Sources,1994,50(3):295~309.
[9]Lanova B,Wang H,Baltruschat H.Methanol Oxidation on Carbon Supported Pt and Ru Modified Pt Nanoparticles:a Comparison with Single Crystal and Polycrystalline Electrodes[J].Fuel Cells,2006,6(3-4):214~224.
[10]Dupont C,Jugnet Y,Loffreda D.Theoretical Evidence of PtSn Alloy Efficiency for CO Oxidation[J].Journal of the American Chemical Society,2006,128(28):9 129~9 136.[11]Girishkumar G,Vinodgopal K,Kamat P V.Carbon Nanostructures in Portable Fuel Cells:Single-Walled Carbon Nanotube Electrodes for Methanol Oxidation and Oxygen Reduction[J].Journal of Physical Chemistry B,2004,108(52):19 960~19 966.
[12]kabbabi A,Gloaguen F,Andolfatto F,et al.Particle size effect for oxygen reduction and methanol oxidation on Pt/C inside a proton exchange membrane[J].Journal of Electroanalytic Chemistry,1994,373(1-8):251~254.
[13]刘长鹏,杨辉,刑巍,等.碳载Pt-TiO2复合催化剂对甲醇氧化的电催化性能[J].高等学校化学学报,2002,23(7):1 367~1 370.
[14]Li W Z,Liang C H,Qiu J S,et al.Carbon nanotubes as support for cathode catalyst of a direct methanol fuel cell[J].Carbon,2002,40(5):791~794.
[15]Liu Z L,Lin X H,Lee J Y,et al.Preparation and CharacterizationofPlatinum-BasedElectrocatalystson Multiwalled Carbon Nanotubes for Proton Exchange Membrane Fuel Cells[J].Langmuir,2002,18(10):4 054~4 060.
[16]Mikhaylova A A,Khazove O A,Bsgotzky V S.Electrocatalytic and adsorption properties of platinum microparticles electrodeposited onto glassy carbon and into Nafion@films[J].Journal of Electroanalytic Chemistry,2000,480(1-2):225~232.
[17]刘晶华,于春波,王玉江,等.CO在铂修饰的氧化钛电极上电催化氧化行为的研究[J].高等学校化学学报,2003,24(12):2 263~2 267.
[18]Yang L X,Xiao Y,Zeng G M,et al.Fabrication and Characterization of Pt/C-TiO2Nanotube Arrays as Anode Materials for Methanol Electrocatalytic Oxidation[J].Energy&Fuels,2009,23(6):3 134~3 138.
[19]Wang M,Guo D J,Li H L.High activity novel Pd/TiO2nanotube catalysts for methanol electro-oxidation[J].Journal of Solid State Chemistry,2005,178(6):1 996~2 000.
[20]Mor G K,Shankar K,Paulose M,et al.Enhanced Photocleavage of Water Using Titania Nanotube Arrays[J].Nano Letters.2005,5(1):191~195.
[21]Liu S H,Yang L X,Xu S H,et al.Photocatalytic activities of C-N-doped TiO2nanotube array/carbon nanorod composite[J].Electrochemistry Communications,2009,11(9):1 748~1 751.
[22]Mancharan R,Goodenough J B.Methanol oxidation in acid on ordered NiTi[J].Journal of Material Chemistry,1992,2(8):875~887.
[23]Cha S Y,Lee W M.Performance of Proton Exchange Membrane Fuel Cell Electrodes Prepared by Direct Deposition of Ultrathin Platinum on the Membrane Surface[J].Journal of the Electrochemical Society,1999,146(11):4 055~4 060.
[24]Wakabayashi N,Uchida H,Watanabe M.Temperature-Dependence of Methanol Oxidation Rates at PtRu and Pt Electrodes[J].Electrochemical and Solid-State Letters,2002,5(11),E62~E65.
