乳清多肽对D-半乳糖衰老模型大鼠血清和脏器组织抗氧化效果的影响
2010-03-22彭新颜孔保华熊幼翎
彭新颜,孔保华*,熊幼翎
(1.鲁东大学食品工程学院,山东 烟台 264025;2.东北农业大学食品学院,黑龙江 哈尔滨 150030;3.肯塔基大学动物与食品科学系,美国 肯塔基 莱克星顿 40546)
乳清多肽对D-半乳糖衰老模型大鼠血清和脏器组织抗氧化效果的影响
彭新颜1,2,孔保华2,*,熊幼翎3
(1.鲁东大学食品工程学院,山东 烟台 264025;2.东北农业大学食品学院,黑龙江 哈尔滨 150030;3.肯塔基大学动物与食品科学系,美国 肯塔基 莱克星顿 40546)
研究乳清蛋白的碱性蛋白酶水解产物对D-半乳糖(D-gal)衰老模型大鼠抗氧化效果的影响。将大鼠分为7组,包括正常对照组、D-gal模型阴性对照组、D-gal+未水解乳清蛋白组、D-gal+乳清蛋白肽低剂量组、D-gal+乳清蛋白肽中剂量组、D-gal+乳清蛋白肽高剂量组和D-gal+抗坏血酸模型阳性对照组。各处理组灌胃45d后,检测衰老大鼠血清、心脏和肾脏的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和丙二醛(MDA)含量的变化及肝脏中过氧化氢酶(CAT)活性的变化。抗坏血酸阳性对照组和低、中、高剂量乳清多肽组均可使大鼠血清、心脏和肾脏的SOD 、GSH-Px 及CAT活性提高,MDA含量降低,并且与阴性对照组相比差异显著 (P<0.05)。其中,高剂量乳清多肽组(200mg/kg bw)对SOD酶活性作用最显著,使血清SOD活性比阴性对照组提高了29.2%。高剂量乳清多肽组使肾脏GSH-Px活性及肝脏中CAT活性达到了阳性对照抗坏血酸的水平(P>0.05),同时,中剂量乳清多肽组(100mg/kg bw)使心脏中的MDA含量与阴性对照组相比下降了38.6%。结果表明,乳清多肽能够通过提高生物体内抗氧化酶系的活力,减少自由基对组织器官的损害,发挥其抗氧化作用,这说明乳清多肽在延缓机体衰老方面具有一定的效果。
D-半乳糖;大鼠;乳清蛋白水解物;抗氧化能力
现代医学证明,人类许多慢性疾病及衰老现象均和人体内的自由基水平失衡有关,过量的自由基对机体产生氧化性损伤,当这种损伤不能及时修复并且积累到一定程度时往往导致疾病的出现[1]。现代食品加工工艺可导致脂肪氧化酸败及品质变劣,这些问题都需要添加外源抗氧化剂来解决。人工合成的抗氧化剂(BHA、BHT等)有很强的抗氧化能力,但由于这些合成抗氧化剂对人们的身体健康存在一定的潜在危害,其使用量受到严格的控制[2]。因此,从食源性物种筛选天然、高效的抗氧化物质,并用于疾病的预防将具有重要的意义。
乳清是生产干酪的副产物,其必需氨基酸组成符合并超出FAO/WHO的要求。但目前尚有部分乳清不能被充分利用,造成了巨大的资源浪费和较严重的环境污染。近年来,动植物蛋白酶解产物的抗氧化研究已成为一个热门话题,而且很多水解产物具有一定的抗氧化功效[3-4]。目前已有关于乳清蛋白水解物在铜、铁催化脂质氧化体系[5-6]及利用电子自旋共振测定乳清多肽抗氧化活性等研究的报道[7]。
虽有一些乳清抗氧化肽的研究,但还未见利用衰老动物模型来研究其体内抗氧化作用的报道。D-半乳糖亚急性中毒动物是近年来国内外常用的衰老模型[8],而且此模型造模时间短,重复性好。前期研究表明,5%的乳清蛋白由碱性蛋白酶水解后,5h水解物抗氧化效果最佳[9],水解多肽具有相对较高的还原能力,PV(过氧化值)和TBARS(硫代巴比妥酸值)抑制作用,Cu2+螯合能力及DPPH自由基清除能力[10]。本研究采用D-半乳糖(D-gal)衰老大鼠模型,研究碱性蛋白酶所制备乳清蛋白多肽对衰老模型大鼠血清和脏器抗氧化作用的影响,探讨乳清多蛋白肽在体内抗氧化活性的作用模式,旨在为研究乳清蛋白多肽在体内抗氧化活性的作用机制提供参考。
1 材料与方法
1.1 材料、试剂与动物
D-gal粉剂(原装) Sigma公司;超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-PX)试剂盒和丙二醛(MDA)试剂盒 南京建成科技有限公司。
清洁级SD(Sprague-Dawley)大鼠,雄性,购自维通利华实验动物公司(北京),年龄为4~5个月,体质量为290~320g,实验在东北农业大学实验动物房内进行。
1.2 仪器与设备
JD500-2电子天平 沈阳龙腾电子称量仪器有限公司;TP - 2000 动物天平 上海仪器有限公司;DELTA 320 pH计 梅特勒-托利多仪器有限公司;DK-S24型电热恒温水浴锅 上海森信实验仪器有限公司;LG10-24A高速离心机 北京医用离心机厂;TU-1800紫外-可见分光光度计 北京普析通用仪器有限公司;722型分光光度计 上海仪器厂;低温冰箱(-80℃) Revco公司。
1.3 方法
1.3.1 乳清蛋白水解物的制备
将乳清蛋白配成5g/100mL溶液后,经95℃预热5min,加入碱性蛋白酶在pH8.5、加酶量(E/S)2%、温度65℃条件下水解5h后冻干备用。可见,SD大鼠灌胃所用多肽制备方法与前期工作中抗氧化活性多肽相同[9]。
1.3.2 D-gal致衰老大鼠模型的建立
将大鼠同室分笼饲养,自然光照,自由采食和饮水。每两天称量一次体质量。适应性饲养1周后建立模型,每组10只,随机分为7组:正常对照组、D-gal模型阴性对照组、D-gal+未水解乳清蛋白组、D-gal+乳清蛋白肽低剂量组、D-gal+乳清蛋白肽中剂量组、D-gal+乳清蛋白肽高剂量组、D-gal+抗坏血酸模型阳性对照组。除正常对照组外,其他6组的大鼠皮下注射D-gal(120mg/kg bw),连续注射6周建立衰老模型;其中除正常对照组的这6组大鼠于第2周每日分别灌胃,D-gal模型阴性对照组大鼠给予等量双蒸水,D-gal+未水解乳清蛋白组大鼠给予50mg/kg bw未水解乳清蛋白,D-gal+乳清蛋白肽低、中、高剂量3个组分别给予低中高剂量灌胃乳清多肽50、100、200mg/kg bw,D-gal+抗坏血酸模型阳性对照组的大鼠给予抗坏血酸50mg/kg bw;正常对照组大鼠颈背部皮下注射等量生理盐水并于第2周给予等量双蒸水作为非模型正常对照组。
1.3.3 血清和组织匀浆的制备
灌胃45d后,摘眼球取血,断颈处死,解剖取出心和肾等脏器贮存于液氮中。大鼠血样于4℃冰箱放置12h,离心(3000r/min,10min)取上清液,即为血清。测定时液氮中取出大鼠心脏、肝脏和肾脏组织,制成10%组织匀浆液。
1.3.4 血清和组织中抗氧化酶系和MDA的测定
SOD活力测定:SOD酶活测定采用氯化硝基氮蓝四唑光还原法(NBT法),按照试剂盒操作说明在560nm波
长处测定OD值。
过氧化氢酶(catalase,CAT)活力测定:按照Carrillo等[11]的方法,并稍作改动。反应体系含有12μL的体积分数3% H2O2和100μL细胞裂解液,888μL的50mmol/L PBS(pH7.0)。样品于37℃水浴2min,240nm波长处测定5min内OD值的变化,其变化和H2O2的变化成比例。
GSH-Px测定:DTNB显色法[12]。反应溶液由如下部分组成:0.1mol/L PBS(pH7.0),1mmol/L的乙二胺四乙酸(EDTA),10mmol/L谷胱甘肽,1mmol/L的NaN3,1单位谷胱甘肽还原酶,1.5mmol/L的还原型辅酶Ⅱ四钠(NADPH)和0.1mL细胞裂解液。37℃水浴10min,加入H2O2使之浓度为1mmol/L。于340nm波长处测定OD值。NADPH氧化的速度表示GSH-Px活性。
MDA含量的测定:用硫代巴比妥酸(TBARS)方法[13]。
1.4 统计分析
数据统计分析采用Statistix 8.1软件,每个实验重复3次,差异显著性(P<0.05)分析使用Tukey HSD程序。
2 结果与分析
2.1 乳清抗氧化肽对大鼠血清和脏器中SOD活力的影响
表1 不同剂量乳清蛋白多肽对大鼠血清和脏器中SOD活力的影响(±s,n=10)Table 1 Effect of whey protein hydrolysates on the activity of SOD in serum and different organs in rats (x±s,n=10)
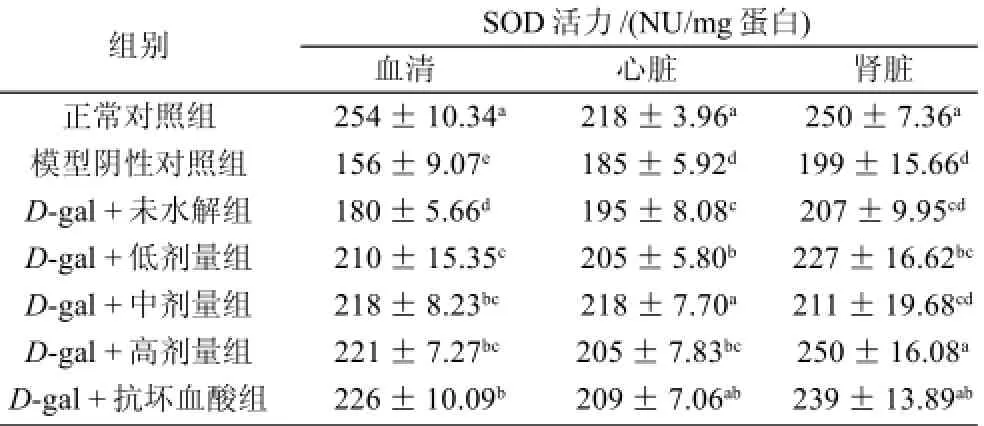
表1 不同剂量乳清蛋白多肽对大鼠血清和脏器中SOD活力的影响(±s,n=10)Table 1 Effect of whey protein hydrolysates on the activity of SOD in serum and different organs in rats (x±s,n=10)
注:同列字母不同表示差异显著(P<0.05)。下同。
组别SOD活力/(NU/mg蛋白)血清心脏肾脏正常对照组254±10.34a218±3.96a250±7.36a模型阴性对照组156±9.07e185±5.92d199±15.66dD-gal +未水解组180±5.66d195±8.08c207±9.95cdD-gal +低剂量组210±15.35c205±5.80b227±16.62bcD-gal +中剂量组218±8.23bc218±7.70a211±19.68cdD-gal +高剂量组221±7.27bc205±7.83bc250±16.08aD-gal +抗坏血酸组226±10.09b209±7.06ab239±13.89ab
从表1结果可知,模型阴性对照组大鼠血清中SOD活力明显低于正常对照组和各处理组,具有显著性差异(P<0.05),剂量处理组中,随剂量的增加SOD活力有所升高,存在着一定的剂量效应,其中,高剂量组处理效果最好,使血清SOD活性比阴性对照组提高了29.2%。
模型阴性对照组大鼠心脏SOD活力明显低于正常对照组,具有显著性差异(P<0.05),各处理组SOD活力明显升高,与模型阴性对照组相比具有显著性差异(P<0.05)。中剂量乳清多肽处理效果最好,说明中剂量多肽在心脏中对SOD活力有较大的影响,但各剂量组间SOD活力差异并不显著(P>0.05)。
肾脏中模型阴性对照组大鼠SOD的活力显著低于正常对照组(P<0.05),高剂量组、抗坏血酸处理与正常对照组无显著差异(P>0.05),与未水解、低剂量、中剂量处理存在显著差异(P<0.05)。高剂量组在肾脏中SOD的活力最高,抗氧化效果最好。
2.2 乳清蛋白多肽对大鼠血清和脏器中GSH-Px活力的影响
表2 不同剂量乳清蛋白多肽对大鼠血清和脏器GSH-Px活力的影响(±s,n=10)Table 2 Effect of whey protein hydrolysates on the activity of GSH-Px in serum and different organs in rats (x±s,n=10)

表2 不同剂量乳清蛋白多肽对大鼠血清和脏器GSH-Px活力的影响(±s,n=10)Table 2 Effect of whey protein hydrolysates on the activity of GSH-Px in serum and different organs in rats (x±s,n=10)
组别GSH-Px活力/(U/mg蛋白)血清心脏肾脏正常对照组2982±87.80a114±8.87a267±13.22a模型阴性对照组2583±86.12d97±6.78b230±9.77cD-gal +未水解组2635±150.72cd97 ± 9.10b239±12.75bcD-gal +低剂量组2703±167.68bcd110±8.70a248±16.45abcD-gal +中剂量组2792±182.19abc105±8.01ab258±13.97abD-gal +高剂量组2685±167.27bcd107±9.03ab266±16.95aD-gal +抗坏血酸组2839±135.71ab108±8.87ab256±15.30ab
从表2可知,在血清、心脏和肾脏中,以D-gal阴性对照组GSH-Px活力为最低。在血清中,GSH-Px活力中剂量、抗坏血酸组处理与未水解相比有显著性差异(P<0.05),中剂量乳清多肽、抗坏血酸组对GSH-Px活力有较大的影响,未达到到正常组水平,但差异不显著(P>0.05)。在心脏中,未水解GSH-Px活力显著低于正常对照组、低剂量组(P<0.05),低剂量处理对GSH-Px活力有较大的影响。在肾脏中,大鼠正常对照、中、高剂量组及VC组与模型阴性对照组GSH-Px活力存在显著差异(P<0.05),其中,高剂量组效果最好。
由上述结果可知,在大鼠血清及各脏器中,乳清蛋白多肽在一定的剂量范围内对提高GSH-Px活力是有效的。
2.3 乳清蛋白多肽对大鼠血清和脏器中MDA含量的影响
从表3可知,在血清和心脏中,模型阴性对照组大鼠MDA的含量显著高于正常对照组(P<0.05),在肾脏中,模型阴性对照组大鼠MDA的含量虽高于正常对照组,但不具有显著性差异(P>0.05)。与模型阴性对照组相比,血清和肾脏各剂量处理组无显著差异(P>0.05)。可见,大鼠经D-半乳糖处理后,血清和肾脏中DMA含量升高,说明适模成功。在心脏中,中剂量乳清多肽组(100mg/kg bw)使心脏中的DMA含量与阴性对照组相比,下降了38.6%,效果较好。
表3 不同剂量乳清蛋白多肽对大鼠血清和脏器中MDA含量的影响(±s,n=10)Table 3 Effect of whey protein hydrolysates on MDA in serum and different organs in rats (x±s,n=10)

表3 不同剂量乳清蛋白多肽对大鼠血清和脏器中MDA含量的影响(±s,n=10)Table 3 Effect of whey protein hydrolysates on MDA in serum and different organs in rats (x±s,n=10)
组别MDA含量/(nmol/mg)血清心脏肾脏正常对照组10.3±1.34b2.2±0.57c1.8±0.79a模型阴性对照组12.9±1.75a4.1±0.51a2.5±0.84aD-gal +未水解组12.6±2.19ab3.5±45ab2.4±0.92aD-gal +低剂量组11.5±1.19ab3.3±0.57b2.0±0.97aD-gal +中剂量组11.6±1.42ab2.5±0.55c1.9±0.62aD-gal +高剂量组11.1±1.76ab3.5±0.42ab2.0±0.69aD-gal +抗坏血酸组10.5±2.96ab2.3±0.32c1.9±0.66a
2.4 乳清蛋白多肽对大鼠肝脏CAT活力的影响
CAT是体内抗氧化系统的主要组分,分布在红细胞及肝的细胞中,因此,本实验测定了肝脏中CAT活性的变化。H2O2是化学性质最活泼的活性氧,破坏性极强,可被CAT分解。机体通过酶系统与非酶系统产生氧自由基,后者攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化物的产生[14]。因此,CAT活性的变化可反映机体抗氧化能力的变化,研究CAT在机体中的变化有重要的生理学意义。
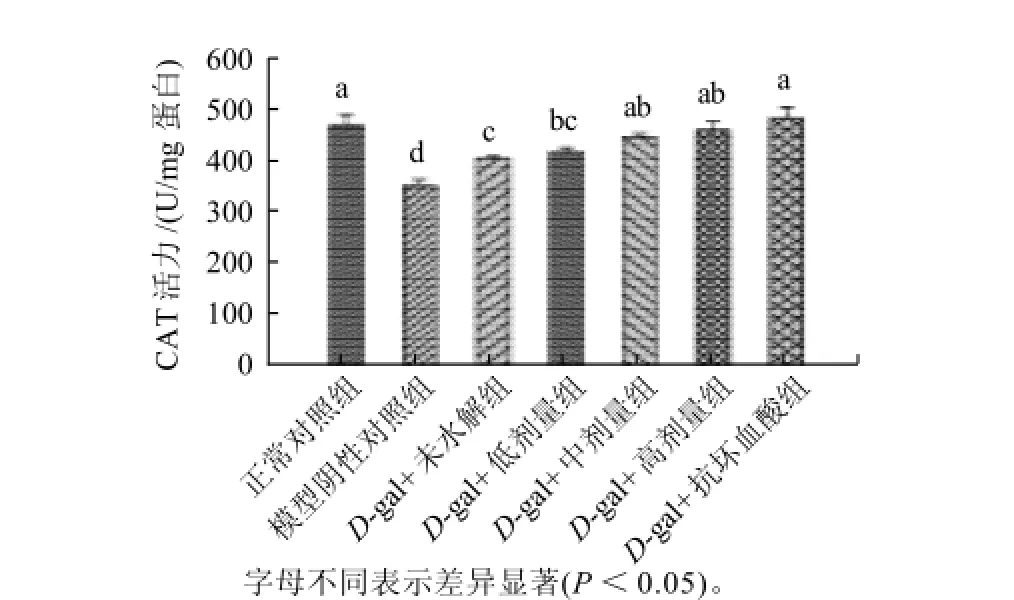
图 1 不同剂量乳清蛋白多肽对大鼠肝脏CAT活力的影响Fig.1 Effect of whey protein hydrolysate dosage on the activity of CAT in liver of rats
由图1可以看出,乳清多肽高剂量组和阳性对照组无显著差异,说明这个剂量的乳清蛋白和抗坏血酸的作用效果几乎相同。其中低、中、高剂量的C A T活性均高于阴性对照组和未水解组,且统计学上具有显著差异(P<0.05)。
3 讨 论
3.1 D-gal模型干预的影响
正常对照及乳清多肽各处理组大鼠饮食正常,活泼好动、皮肤弹性好。模型阴性对照组大鼠在造模后,逐渐表现出四肢无力,少动,毛色发黄,尤其是腹部变得无光泽。同时,D-gal所致的衰老大鼠各抗氧化指标均显著区别于正常对照组,提示D-gal造模成功。可见,该动物模型适合乳清水解多肽的干预。
3.2 未水解乳清蛋白与水解蛋白组对衰老模型大鼠抗氧化效果的影响
目前,已有未水解WPI具有抗氧化作用的报道[7],本实验选用未水解乳清蛋白与不同剂量的水解蛋白组进行对比实验,以确定两者对D-gal衰老模型大鼠抗氧化效果的影响。实验结果表明,乳清蛋白水解物比未水解的乳清蛋白具有更强的抗氧化能力,这可能是由于水解后肽键断裂,增加了氢供体,具有更强的提供质子能力。蛋白一经水解,其致密的结构就被破坏,从而使得具有抗氧化效果的氨基酸残基暴露,抗氧化活性增强。这说明相对于未水解物,水解乳清蛋白用于延缓大鼠衰老,具有一定的可行性。
3.3 乳清多肽对D-gal致衰老大鼠抗氧化酶系活力及MDA含量的影响
SOD和GSH-Px均属抗氧化酶类,在正常生理条件下,超氧阴离子自由基可被体内的SOD及时清除,它对机体的氧化与抗氧化平衡起着重要作用。GSH-Px的存在可保护生物膜不受氧化损害,广泛存在于机体中的CAT对细胞具保护作用,有着重要的生理学功能。脂褐素沉积是衰老的重要特征之一,MDA是脂褐素形成过程中的中间产物,它能间接反映机体内的脂质过氧化水平。大量实验表明,衰老时MDA水平显著升高[15]。
3.3.1 乳清多肽对D-gal致衰老大鼠SOD活力的影响
SOD是体内一种清除氧自由基的酶,它能清除体内各种过氧化物和超氧阴离子自由基,降低对生物膜和其他组织造成的损伤,对机体的氧化与抗氧化平衡起着重要作用。因此本实验测定SOD活力的高低间接反应了机体清除氧自由基的能力,实验结果显示,D-gal衰老大鼠模型较正常组比,SOD的活性明显降低,但经乳清多肽治疗后,SOD的活性升高,表明乳清多肽可提高老年大鼠SOD活性,且在一定范围内存在剂量相关性,这说明SOD的活性增高可能是乳清多肽延缓衰老的内在机制之一。
3.3.2 乳清多肽对D-gal致衰老大鼠GSH- Px含量的影响
H2O2对人体有剧毒,它能氧化巯基,使某些含巯基的酶和活性依赖于巯基的生物活性物质失去活性,又能氧化多烯脂肪酸而使生物膜受损。GSH-Px能催化GSH还原H2O2,H2O2被GSH还原成H2O从而保护生物膜不受氧化损害。GSH-Px含量的下降,可使过氧化脂质增多而致衰老。
本研究发现衰老模型大鼠GSH-Px活性降低,表明模型大鼠抗氧化能力下降,这与其氧化水平增强一致,这一结果不仅支持了D-gal致衰老的“活性氧自由基过
剩”学说,还进一步验证了“衰老的自由基学说”。
3.3.3 乳清多肽对D-gal致衰老大鼠CAT含量的影响
需氧脱氢酶作用所产生的H2O2对机体有剧毒,它在超氧离子作用下能产生诱发自由基反应的羟自由基。自由基诱导的氧化反应在生物的衰老过程及某些疾病的发生占有重要地位。本实验结果表明,乳清多肽中剂量组在增强CAT的活性方面可发挥较好的作用,从而延缓衰老的进程。CAT含量变化与GSH- Px变化的量效关系相似,说明二者在机体防御体系中是两个相互关联的酶,作用具有密切相关性。
3.3.4 乳清多肽对D-gal致衰老大鼠MDA含量的影响
实验结果显示,D-gal衰老大鼠模型较之正常组MDA的含量升高,但经乳清多肽处理后,MDA的含量降低,表明乳清多肽可降低MDA含量,表现为在一定范围内呈量效关系,这提示降低MDA含量可能也是乳清多肽延缓衰老的内在机制之一。
3.4 乳清多肽自由基清除能力对D-gal致衰老大鼠的影响
目前已有许多抗氧化活性与自由基清除作用有关的报道[16-17],当机体自由基产生时,机体有一系列酶系统参与清除自由基的过程,从而达到解毒的作用。本课题的前期工作中,通过电子自旋共振仪测定了乳清水解物的自由基清除能力,结果表明,乳清蛋白酶解产物具有一定的1,1-二苯基苦基苯肼(DPPH)自由基、羟基和超氧阴离子自由基的清除能力[7]。这表明,乳清多肽抗氧化性在动物机体内评价结果与用化学方法评价结果具有一致性,由此可以推论出,乳清多肽延缓衰老及提高生物体抗氧化酶系活力作用的发挥可能与其具有清除自由基能力相关。
4 结 论
各处理组灌胃45d后,不同剂量的乳清抗氧化肽各组,在提高血清、心脏、肾脏的SOD活性、GSH-Px活性和降低MDA 含量均有一定程度的作用,同时,对于提高肝脏CAT活性方面也具有较好的效果,表明乳清多肽在改善机体物质代谢紊乱及延缓衰老等方面具有一定的作用。但乳清抗氧化肽在肠道消化分解,消化后在体内活性的具体情况有待进一步研究。
[1]杨晓泉, 张水华, 高建华, 等. 小茴香甲醇提取物的抗氧化性质研究[J]. 中国粮油学报, 1998, 13(3)∶ 37-40.
[2]CHANG Chiyue, WU Kueiching, CHIANG Shuhua. Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J]. Food Chemistry, 2007, 100∶ 1537-1543.
[3]LIU Qian, KONG Baohua, JIANG Lianzhong, et al. Free radical scavenging activity of porcine plasma protein hydrolysates determined by electron spin resonance spectrometer[J]. LWT-Food Science and Technology, 2009, 42∶ 956-962.
[4]ALI B, MOHAMED H, RAFIK B, et al. Antioxidant and free radical scavenging activities of smooth hound (Mustelus mustelus) muscle protein hydrolysates obtained by gastrointestinal proteases[J]. Food Chemistry, 2009, 114∶ 1198-1205.
[5]PENA-RAMOS E A, XIONG Y L. Antioxidative activity of whey protein hydrolysates in a liposomal system[J]. Journal of Dairy Science, 2001, 84∶ 2577-2583.
[6]COLBERT L B, DECKER E A. Antioxidant activity of an ultrafiltration permeate from acid whey[J]. Journal of Food Science, 1991, 56∶ 1249-1250.
[7]PENG Xinyan, XIONG Youling, KONG Baohua. Antioxidant activity of peptide fractions from whey protein hydrolysates as measured by electron spin resonance[J]. Food Chemistry, 2009, 113∶ 196-201.
[8]龚国清, 徐黻本. 小鼠衰老模型的研究[J]. 中国药科大学学报, 1991, 22∶ 101-103.
[9]彭新颜, 孔保华, 熊幼翎. 由碱性蛋白酶制备的乳清蛋白水解物抗氧化活性的研究[J]. 中国乳品工业, 2008, 36(4)∶ 8-12; 47.
[10]彭新颜, 孔保华, 熊幼翎. 乳清蛋白水解物抗氧化活性的研究[J]. 食品科学, 2009, 30(3)∶ 167-172.
[11]CARRILLO M C, KANAI S, NOKUBO M. Deprenyl induces activities of both superoxide dismutase and catalase but not glutathione peroxidase in the striatum of young male rats[J]. Life Sciences, 1991, 48∶ 517-521. [12]HAFEMEN D G. Effect of dietary selenium on erythrocyte and liver glutathione peroxidase in the rats[J]. Journal of Nutrition, 1974, 104∶580-587.
[13]PLACER Z A, CUSHMAN L, JOHNSON B C. Estimation of product of lipid peroxidation (malonyldi-aldehyde) in biochemical system[J]. Analytical Biochemistry, 1996, 16∶ 359-364.
[14]吴璟, 陈建茂, 杨卫东, 等. 酸枣仁脂肪油提取物对大鼠血脂及SOD、CAT活性的影响[J]. 宁夏医学院学报, 2007, 29(2)∶ 19-20.
[15]SANDHU S K, KAUR G. Alterations in oxidative stress scavenger system in aging rat brain and lumphocytes[J]. Biogerontology, 2002, 3 (3)∶ 161-173.
[16]RAJAPAKSE N, MENDIS E, JUNG W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties[J]. Food Research International, 2005a, 38(2)∶ 175-182.
[17]JE J Y, QIAN Z J, BYUN H G, et al. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis[J]. Process Biochemistry, 2007, 42∶ 840-846.
Antioxidative Effect of Whey Protein Hydrolysates in Serum, Heart and Kidney of D-galactose-induced Aging Rats
PENG Xin-yan1,2,KONG Bao-hua2,*,XIONG You-ling3
(1. College of Food Engineering, Ludong University, Yantai 264025 , China;2. College of Food Science, Northeast Agricultural University, Harbin 150030, China;3. Department of Animal and Food Sciences, University of Kentucky, Lexington 40546, USA)
The antioxidative effect of whey protein isolate (WPI) hydrolysates on aging rats induced by D-galactose (D-gal) was investigated. The rats were divided into seven groups including the control group, D-gal model group, D-gal-induced rats treated with unhydrolyzed WPI, D-gal-induced rats treated with WPI hydrolysates at low, middle and high dosages, and D-gal-induced rats treated with ascorbic acid as the positive group. The experiment period was last for 45 days. The effect of WPI hydrolysates on antioxidative enzyme system including superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and hydrogen peroxidase (CAT) in rats was evaluated, and the content of malondialdehyde (MDA) was determined. Results showed that WPI hydrolysates at three dosage levels significantly increased SOD and GSH-Px activities and simultaneously decreased MDA content in serum, heart and kidney tissues. The CAT activity in liver tissue of treated rats was also improved (P<0.05). Moreover, a higher SOD activity was observed in rats treated with WPI hydrolysates at the dosage of 200 mg/kg· bw. Compared with the negative control, the SOD activity in serum of rats treated with WPI hydrolysates at the high dosage was increased by 29.2%. No significant difference in GSH-Px activity in kidney and CAT activity in liver between WPI hydrolysate treatment at the high dosage and the positive control of ascorbic acid was observed (P >0.05). In contrast, compared with the negative control, the MDA content in rats treated with WPI hydrolysates at the dosage of 100 mg/kg bw was decreased by 38.6% in heart. Therefore,
D-galactose;rats;whey protein hydrolysate;antioxidant capacity
Q516
A
1002-6630(2010)09-0238-05
2009-07-07
国家“863”计划项目(2008AA10Z315)
彭新颜(1976—),女,博士研究生,研究方向为畜产品加工。E-mail:pxy2003224@yahoo.com.cn
*通信作者:孔保华(1963—),女,教授,博士,研究方向为畜产品加工。E-mail:kongbh63@hotmail.com
WPI hydrolysates delayed the aging process of rats due to the increase of the activity in antioxdative enzyme system.
