超高效液相色谱测定蜂蜜及其制品中的苯甲酸、山梨酸
2010-03-22黄京平周金慧吴黎明陈兰珍薛晓锋
黄京平,李 熠,周金慧,吴黎明,陈兰珍,赵 静,薛晓锋,*
(1.中国农业科学院蜜蜂研究所,北京 100093;2. 农业部国家蜂产品加工专业分中心,北京 100093)
超高效液相色谱测定蜂蜜及其制品中的苯甲酸、山梨酸
黄京平1,2,李 熠1,2,周金慧1,2,吴黎明1,2,陈兰珍1,2,赵 静1,2,薛晓锋1,2,*
(1.中国农业科学院蜜蜂研究所,北京 100093;2. 农业部国家蜂产品加工专业分中心,北京 100093)
研究蜂蜜及其制品中的山梨酸与苯甲酸两种防腐剂的提取净化及其超高效液相色谱检测方法。样品用水溶解,超声波辅助提取样品中的山梨酸与苯甲酸。样液经高速离心,滤膜过滤后,采用超高效液相色谱梯度洗脱与二极管阵列检测器测定样品中的山梨酸与苯甲酸的含量。以BEH Shield RP18(2.1mm×100mm,1.7μm)为色谱柱,以0.02mol/L乙酸铵溶液和乙醇为流动相梯度洗脱,两种防腐剂在4min中内实现较好的分离。方法检出限:苯甲酸为2.5mg/kg,山梨酸为2.0mg/kg。以加标样品做添加回收率测定,苯甲酸与山梨酸的回收率分别为94.1%~102.3%和96.2%~99.8%,相对标准偏差均小于5%。方法简单、快速准确、灵敏度高,是一种较好的定性和定量方法。
蜂蜜;蜂蜜制品;苯甲酸;山梨酸;超高效液相色谱
苯甲酸和山梨酸是目前食品加工业最常使用的两种食品防腐剂,被广泛用于各类食品中。食用含有过量苯甲酸和山梨酸的食品会影响人体对维生素和钙的吸收,加重人的肝脏负担,并引起毒性反应或诱发癌症[1]。FAO与WHO详细规定了不同食品中苯甲酸与山梨酸的使用范围与用量,我国也对防腐剂的使用有着严格规定,国家食品添加剂使用卫生标准(GB 2760—2007《食品添加剂使用卫生标准》)规定了各类食品中苯甲酸与山梨酸的使用限量。一些国标检测方法也已颁布,用于监控食品中苯甲酸和山梨酸的不合理使用。比如,GB/T 5009.9—2003《食品中山梨酸、苯甲酸的测定》[2];GB/ T 23495—2009《食品中苯甲酸、山梨酸和糖精钠的测定:高效液相色谱法》[3];GB 21703—2010《乳和乳制品中苯甲酸和山梨酸的测定》[4]。
近些年来,受利益驱使,有些不法企业用一些果葡糖浆,人工色素(日落黄),防腐剂(苯甲酸、山梨酸)等做成假蜂蜜以天然蜂蜜或制品投入市场,牟取暴利,严重危害了消费者的权益。GB 18796—2005《蜂蜜》强制标准中规定蜂蜜:“不得添加或混入任何防腐剂、澄清剂、增稠剂等异物[5]”。尽管一些防腐剂的国家标准检测方法已经颁布,但这些标准主要用于酱油、蔬菜、奶制品中的苯甲酸与山梨酸的测定,还没有相关蜂蜜产品及其制品(蜜膏、蜜乳)中山梨酸与苯甲酸的检测方法。建立一个简单、快速的蜂蜜及其制品中的苯甲酸与山梨酸的检测方法,对于保护人民身体健康,完善现有蜂蜜质量与安全检测方法体系,促进养蜂业快速健康发展有着重要意义。
苯甲酸和山梨酸的分析方法主要有紫外分光光度法[2,6]、气相色谱法[2,7-8]、毛细管电泳法[9-10]、高效液相色谱法[2-4,11-15],其中,高效液相色谱法是最常用的方法。近些年,随着检测技术的发展,在食品分析中,尽量减少使用有毒试剂,保护实验人员的身体健康,保护自然生态环境已成为分析检测技术的重要趋势之一,人们将这种检测技术称之为环境友好的分析方法或绿色分析方法[16]。本实验在样品的提取和分析过程中,使用无毒和低毒试剂,建立一种使用8 0℃水浴提取与超高效液相色谱(UPLC)快速测定蜂蜜及其制品中的苯甲酸和山梨酸的方法,并分析一些实际样品,调查这些样品中两种防腐剂的使用情况。
1 材料与方法
1.1 材料与试剂
天然蜂蜜 云南罗平与浙江平湖种蜂场;蜂蜜制品各地市场抽样。
苯甲酸与山梨酸标准品 Sigma公司;无水乙醇和乙酸铵为色谱纯 Baker公司。
0.02 mol/L乙酸铵溶液:称取0.77g乙酸铵,用纯水溶解,定容至500mL容量瓶中,使用前用0.2μm滤膜过滤。苯甲酸与山梨酸标准溶液(1mg/mL):称取适量苯甲酸与山梨酸标准品,用无水乙醇配制成1mg/mL标准贮备溶液,根据需要用纯水配制成适合质量浓度的标准工作溶液。
1.2 仪器与设备
ACQUITY超高效液相色谱仪(配有PDA检测器)、2K-15高速离心机、微孔滤膜(0.22μm) Waters公司;DK600A恒温水浴 上海精密仪器公司;KQ218超声波江苏昆山舒美公司;Q-POD超纯水器 密理博公司。
1.3 方法
1.3.1 样品处理
称取5g样品到50mL容量瓶中,加入35mL水,混匀1min,在80℃水浴10min后,用超声波超声提取10min,将溶液放置室温,用纯水定容至50mL,取出5mL置于离心管中12000r/min离心5min,取上清液,用0.22μm滤膜过滤,上机分析。
1.3.2 色谱条件
色谱柱:Waters BEH Shield RP18(2.1mm×100mm,1.7μm)。流动相:0.02mol/L乙酸铵溶液(A)和乙醇(B);流速:0.40mL/min,梯度洗脱程序为0~1.2min,95% A;1.2~2.2min,60% A;2.2~4.0min,95% A;柱温:45℃;进针体积:4μL;检测器:全波长扫描,210~400nm,提取波长:230nm;以保留时间和紫外吸收光谱图定性,峰面积定量。
2 结果与分析
2.1 提取溶液及沉淀方法的选择
常用提取苯甲酸与山梨酸的试剂有甲醇溶液、乙醚、盐酸溶液、氨水和氢氧化钠溶液等,其中,盐酸溶液与乙醚的提取主要用于气相色谱分析。甲醇溶液、氨水和氢氧化钠溶液用于反相高效液相色谱分析。在样品提取过程中,乙酸锌和亚铁氰化钾溶液是常用的蛋白沉淀试剂,这两种试剂均可以很好地沉淀样品中的蛋白质,降低在测定苯甲酸与山梨酸过程中的基质干扰。这些提取和净化方法均能很好地用于分析样品中的苯甲酸和山梨酸,但这些方法在提取过程中用到酸、有机溶剂、重金属盐等,容易污染环境,同时对操作人员的健康也产生一定的影响。在本研究中,选择水作为提取试剂,超声波辅助下提取蜂蜜及其制品中的苯甲酸和山梨酸,通过水浴与高速离心沉淀样品中的蛋白,方法可以有效地去除蜂蜜及制品中的蛋白及其他杂质,且能保证两种防腐剂的提取回收率在90%以上。
2.2 超高效液相色谱条件的选择
2.2.1 分离条件的选择
用反相液相色谱分离苯甲酸和山梨酸时,通常使用C18色谱柱,用磷酸盐或乙酸铵盐溶液与甲醇或乙腈作为流动相等度洗脱分离,用紫外或二极管阵列检测器检测分析[2-4,11-15]。在本实验选择乙醇与0.02mol/L乙酸铵溶液作为流动相梯度洗脱分离苯甲酸和山梨酸,相比报道的分离方法,该方法快速、简单,可以有效地将样品中杂质与目标物分离,同时,乙醇、甲醇和乙腈相比,乙醇毒性小,对环境和操作人员的危害小。标样和实际样品分离色谱图见图1。
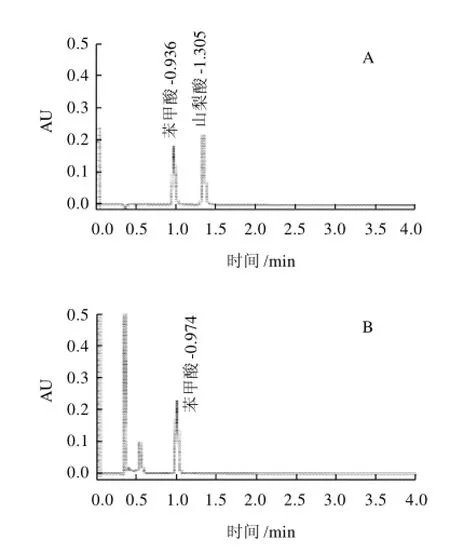
图1 苯甲酸与山梨酸标样(A)与实际样品(B)测定色谱Fig.1 Chromatograms of benzoic acid and sorbic acid standards
2.2.2 波长的选择
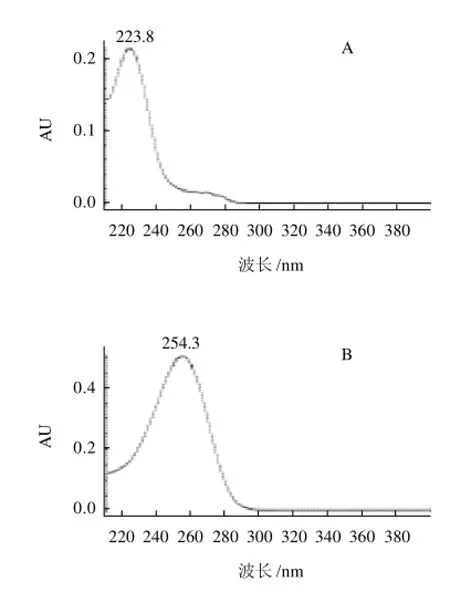
图2 苯甲酸(A)与山梨酸标样(B)紫外光谱图Fig.2 UV-spectra of benzoic acid and sorbic acid standards

图3 待测样品中苯甲酸的紫外光谱图Fig.3 UV-spectra of benzoic acid and sorbic acid in samples
在上述的色谱分析条件下,通过在210~400nm范围进行扫描,苯甲酸的最佳吸收波长在223.8nm,山梨酸在254.3nm;文献报道的检测波长为230nm,在这个波长下,两种防腐剂都有很好的响应,且基线稳定,因此本实验选择230nm为检测波长,用两种防腐剂在210~400nm的紫外光吸收谱图作为定性分析的依据。两种防腐剂的标准与实际样品分析光谱图如图2、3所示。
2.3 线性关系和检出限
用苯甲酸与山梨酸的标准溶液分别配制0.2、0.5、1.0、5.0、10.0、20.0mg/L混合标准溶液,在选定的色谱条件下进行测定,进样量4μL,用峰面积与标准品质量浓度作图,苯甲酸线性方程为Y=38023X+6480.2,线性相关系数r≥0.9997;山梨酸性方程为Y=54497X+4051.8,线性相关系数r≥0.9998。按照3倍信噪比计算,方法检出限:苯甲酸2.5mg/kg,山梨酸2.0mg/kg。2.4回收率和精密度实验
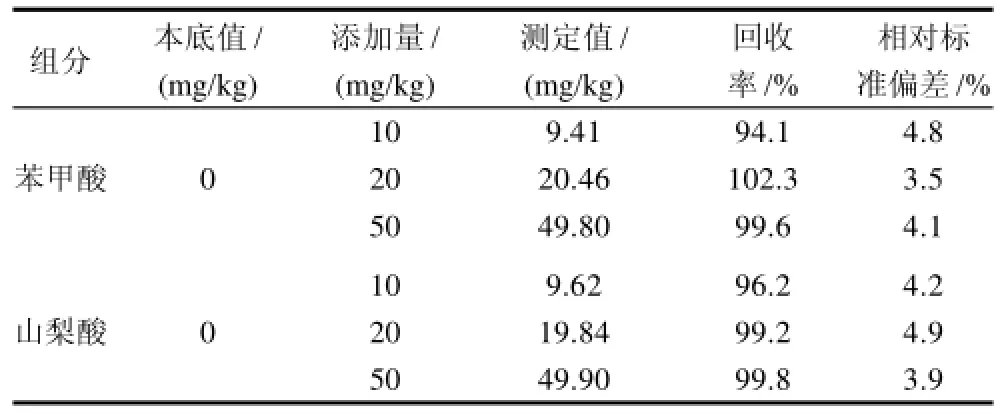
表1 苯甲酸和山梨酸的加标回收率和相对标准偏差(n=5)Table1 Recovery rates and RSD of benzoic acid and sorbic acid in spiked samples (n=5)
在空白样品上作10、20、50mg/kg添加水平下进行加标回收率实验,每个测定重复5次,测定的平均回收率及精密度见表1。在10~50mg/kg添加量范围内回收率,苯甲酸与山梨酸的回收率分别为94.1%~102.3%和96.2%~99.8%,相对标准偏差均小于5%,能够满足日常蜂蜜及其制品中苯甲酸与山梨酸的分析。
2.5 实际样品的测定
应用本方法测定一些来自蜂场与市场的蜂蜜及其制品样品中的苯甲酸和山梨酸的含量,调查蜂蜜及其制品中苯甲酸与山梨酸的添加情况。在分析的56份样品中,天然蜂蜜样品中均未检出苯甲酸与山梨酸,在一份蜂蜜制品(蜜膏)中检出苯甲酸,含量为56.4mg/kg。通过光谱与保留时间确认为苯甲酸。实际样品图见图1B和图3。蜂蜜国家标准虽然规定了蜂蜜的质量标准,可以用这些标准判定蜂蜜产品是否合格,但对于蜂蜜制品,如蜜乳或蜜膏,因为没有相关的标准,则无法对其质量与安全进行有效监管。从蜂蜜制品中检出苯甲酸,说明蜂蜜制品存在一定的安全隐患,蜂蜜制品的质量与安全应该引起国家食品质量与安全管理部门的重视。
3 结 论
本实验建立了一种快速、简单、准确、灵敏度高且环境友好的超高效液相色谱测定蜂蜜及其制品中苯甲酸与山梨酸的方法。方法适用于测定蜂蜜及其制品中的苯甲酸与山梨酸。将该方法用于测定实际样品,调查苯甲酸和山梨酸在实际样品中的添加情况。
[1]张根生. 食品中有害化学物质的危害与检测[M]. 北京: 中国计量出版社, 2006: 16-22.
[2]GB/T 5009.29—2003 食品中山梨酸、苯甲酸的测定[S].
[3]GB/T 23495—2009 食品中苯甲酸、山梨酸和糖精钠的测定: 高效液相色谱法[S].
[4]GB 21703—2010 乳和乳制品中苯甲酸和山梨酸的测定[S].
[5]GB 18796—2005 蜂蜜[S].
[6]刘慧, 胡仰栋. 非线性优化迭代. 紫外分光光度法同时测定苯甲酸钠和山梨酸钾[J]. 分析实验室, 2006, 25(10): 31-35.
[7]殷德荣. 毛细管气相色谱法同时测定食品中山梨酸、苯甲酸、脱氢乙酸、尼泊金丙酯[J]. 中国卫生检验杂志, 2004, 14(4): 469-470.
[8]张红, 陈子雷, 王文博. 肉制品中山梨酸、苯甲酸的气相色谱分析方法的研究[J]. 食品科技, 2007, 33(2): 235-236.
[9]王咏梅, 刘恺, 卢玉妹. 毛细管区带电泳法测定食品中山梨酸、苯甲酸和糖精的含量[J]. 食品科技, 2007, 33(6): 227-229.
[10]FRAZIER R A, DOSSI N, NICOLO D, et a1. Development of a capillary electrophoresis method for the simultaneous analysis of artificeial sweeteners, preservatives and colours in soft drinks[J]. Journal of Chromatogr A, 2000, 875(1/2): 213-220.
[11]刘永刚, 李朝旭, 朱俊平. 乳及乳制品中苯甲酸、山梨酸和糖精钠检测方法的研究[J]. 食品科学, 2007, 28(6): 260-262.
[12]刘洋, 陈枚. 液相色谱法可以同时检测安赛蜜、糖精钠、苯甲酸、山梨酸[J]. 食品质量安全与检测, 2007, 10(2): 30-31.
[13]王莉丽, 宋宇. HPLC法快速测定软饮料中苯甲酸、糖精钠、山梨酸的含量[J]. 渤海大学学报: 自然科学版, 2007, 28(2): 129-131.
[14]康绍英, 张继红. 二极管阵列. 高效液相色谱同时检测食品中的安赛蜜、苯甲酸、山梨酸、糖精钠和脱氢乙酸[J]. 食品与机械, 2007, 23(5): 118-120.
[15]李惠彬. 反相高效液相色谱法同时测定了9种食品中乙酰磺胺酸钾、苯甲酸、山梨酸、糖精钠方法的研究[J]. 中国卫生检验杂志, 2007, 17(7): 1173-1175.
[16]ARMENTA S, GARRIGUES S, de la GUARDIA M, et al. Green analytical chemistry[J]. Trends in Analytical Chemistry, 2008, 27(6): 497-511.
Determination of Benzoic Acid and Sorbic Acid in Honey and Honey Products by Ultra-performance Liquid Chromatography
HUANG Jing-ping1,2,LI Yi1,2,ZHOU Jin-hui1,2,WU Li-ming1,2,CHEN Lan-zhen1,2,ZHAO Jing1,2,XUE Xiao-feng1,2,*
(1. Institute of Apiculture Research, Chinese Academy of Agricultural Sciences, Beijing 100093, China;2. National Research Center of Bee Product Processing, Ministry of Agriculture, Beijing 100093, China)
In this article, extraction, clean-up and ultra-performance liquid chromatographic analysis of benzoic acid and sorbic acid in honey and honey products were investigated. The samples were dissolved in water first. Benzoic acid and sorbic acid were extracted by an ultrasonic method. After clean up processing with high-speed centrifugation and filtration, the extract was determined by an ultra-performance liquid chromatography with PDA detector. A gradient separation was achieved within 4 min using BEH Shield RP18column (2.1 mm ×100 mm, 1.7 μm) with ammonium acetate and ethanol as a mobile phase. The developed method was a simple, fast and sensitive. The limit of detection for benzoic acid and sorbic acid were 2.5 mg/kg and 2.0 mg/kg, respectively. The recovery rates of spiked benzoic acid and sorbic acid were 94.1%-102.3% and 96.2%-99.8%, respectively. The relative standard deviations were less than 5%. This method has been successfully applied to analyze some real samples from beekeeper and market for investigating the distribution of benzoic acid and sorbic acid in honey and honey products.
honey;honey product;benzoic acid;sorbic acid;ultra-performance liquid chromatography
TS207.3
A
1002-6630(2010)20-0417-04
2010-05-12
国家现代农业(峰)产业技术体系项目(NYCYTX-43)
黄京平(1983—),男,实习研究员,本科,主要从事蜂产品质量安全分析研究。E-mail:huang8210759@126.com
*通信作者:薛晓锋(1979—),男,助理研究员,博士研究生,主要从事蜂产品质量安全分析研究。E-mail:xue_xiaofeng@126.com
