碱性橙Ⅱ染料快速检测显色剂筛选及显色条件的优化
2010-03-22纪淑娟张庆欢沈昳潇
纪淑娟,张庆欢,沈昳潇
(沈阳农业大学食品学院,辽宁 沈阳 110161)
碱性橙Ⅱ染料快速检测显色剂筛选及显色条件的优化
纪淑娟,张庆欢,沈昳潇
(沈阳农业大学食品学院,辽宁 沈阳 110161)
利用碱性橙Ⅱ的显色特性,考察碱性橙Ⅱ染料的快速检测的最佳显色条件。通过对不同显色剂显色效果与吸光度变化的观察分析,筛选确定铁氰化钾-三氯化铁显色体系为最佳显色剂。在此基础上对显色反应的条件进行优化。结果表明,铁氰化钾和三氯化铁的适宜体积配比为铁氰化钾(3g/L):三氯化铁(4.5g/L)=1:1,在755nm波长处测定吸光度优化最佳条件,适宜反应条件为反应时间20min;反应温度50℃;显色剂用量0.7mL。
碱性橙Ⅱ;比色法;快速检测
碱性橙Ⅱ(chrysoidine,basic orange Ⅱ)是一种偶氮类碱性染料,俗名“王金黄”,化学名为2,4-二胺基偶氮苯,分子式为C12H12N4·HCl,染料索引号为C.I. Basic Orange2(11270),主要用于纺织品、皮革制品及木制品的染色[1]。根据美国卫生研究所(NIH)化学品健康与安全数据库资料,摄取、吸入以及皮肤接触该物质均会造成急性和慢性的中毒伤害。由于碱性橙比其他水溶性染料如柠檬黄、日落黄等更易于在豆制品以及鲜海鱼上染色且不易褪色,因此一些不法商贩用碱性橙Ⅱ对豆腐皮、黄鱼等进行染色,以次充好,以假冒真,欺骗消费者,严重危害了消费者的身体健康。
《中华人民共和国食品添加剂使用卫生标准》及《中华人民共和国食品安全法》把碱性橙列为禁止添加到食品中的物质。2008年12月15日,卫生部发布了首批非法食品添加剂名单,其中包括17种非食用物质和10种易滥用的食品添加剂,碱性橙被列为非食用物质。目前,国内测定食品中碱性橙Ⅱ的标准方法为GB/T 23496—2009《食品中禁用物质的检测:碱性橙染料:高效液相色谱法》[2]。此方法的准确度和精密度高,但是需要大型仪器设备,昂贵的色谱纯试剂,成本比较高,适合于实验室精确定量测定,无法满足农贸市场现场快速检测。本实验利用碱性橙Ⅱ的显色特性,筛选确定目视比较和比色测定适宜的显色剂,并在此基础上对显色反应的条件进行优化,为建立适于现场快速检测食品中碱性橙Ⅱ染料的方法提供参考依据[3-11]。
1 材料与方法
1.1 试剂
碱性橙Ⅱ标准品 北京百灵威科技有限公司;无水乙醇(分析纯) 天津市富宇精细化工有限公司;甲醇、丙酮、三氯化铁、铁氰化钾、冰醋酸(均为分析纯) 沈阳沈一精细化学品有限公司。
1.2 仪器与设备
TU 1810 紫外-可见分光光度计 北京普析通用仪器有限公司;超声波清洗机 昆山市超声仪器有限公司;101-2A型数显电热鼓风干燥箱 上海沪南科学仪器联营厂。1.3方法
1.3.1 显色剂的筛选
本实验选用盐酸、硫酸、硫代硫酸钠和铁氰化钾-三氯化铁为显色剂,其反应原理:盐酸和硫酸因其改变溶液的pH值而使碱性橙Ⅱ在溶液中的颜色发生变化;硫代硫酸钠因为具有还原性,可以使偶氮类化合物还原成氢化偶氮化合物,继续还原偶氮键生成芳胺;铁氰化钾-三氯化铁体系与碱性橙Ⅱ作用生成普鲁士蓝[12]。
将盐酸、硫酸、硫代硫酸钠和铁氰化钾-三氯化铁作为显色剂,加入到碱性橙Ⅱ标准溶液中(10μg/mL),观察其显色效果,分别对其进行紫外-可见光谱扫描,分析反应前后吸收光谱的变化。综合考虑反应体系颜色变化、显色反应灵敏度、显色反应对条件的要求以及显色后反应体系的稳定性,确定适宜的显色剂种类。
1.3.2 显色剂与碱性橙Ⅱ显色前后测定波长的确定
配制一定质量浓度的碱性橙Ⅱ标准液(10μg/mL储备液),显色前后,分别在200~900nm,紫外吸收光谱宽度为0.5nm,进行光谱扫描,获得吸收光谱并确定测定波长[13]。
1.3.3 显色反应条件的优化[14-20]
1.3.3.1 显色剂最佳配比的确定
通过1.3.1节确定铁氰化钾-三氯化铁为最佳显色剂,分别配制不同质量浓度的铁氰化钾和三氯化铁溶液,混合后观察其稳定性,并确定使用时的适宜质量浓度和配比。
1.3.3.2 显色反应介质的筛选
分别考察不同pH值的甘氨酸-盐酸缓冲液和乙酸-乙酸钠缓冲液作显色反应的介质溶剂,观察显色体系的稳定性。
1.3.3.3 显色剂用量对显色反应效果的影响
取碱性橙Ⅱ(10μg/mL储备液) 1mL置于比色管中,加入显色剂的量分别为0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9mL,配制系列测定溶液,以0号管作参比,观察各试管间颜色差异,并分别测定吸光度,每个处理平行做3组。
1.3.3.4 显色时间对显色反应效果的影响
准确移取一定量碱性橙Ⅱ标准液,在一定的温度条件下进行显色反应,每隔10min 测定一次吸光度。
1.3.3.5 显色温度对显色反应效果的影响
分别在25、30、35、40、45、50、55℃的条件下进行显色反应,反应一定时间后,观察颜色的差异,并分别测定吸光度,进行统计分析。
1.3.3.6 显色反应正交试验
在单因素试验的基础上,进行三因素三水平的正交试验。正交试验因素水平设定如表1所示。
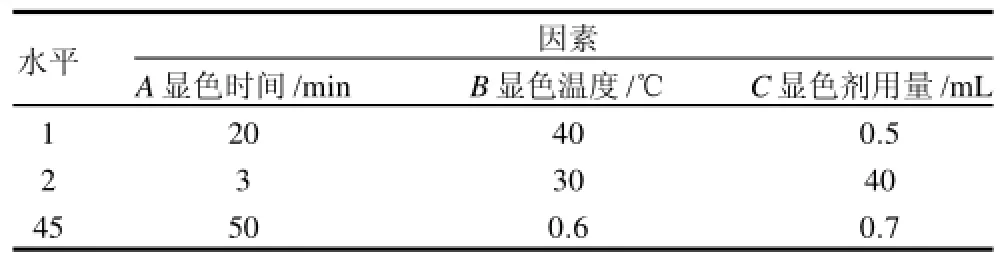
表1 正交试验因素水平Table1 Factors and their levels in the orthogonal array L9(34)
2 结果与分析
2.1 显色剂的确定

表2 不同显色剂显色情况Table2 Color developing effects of different color developers

表3 不同显色剂的灵敏性Table3 Sensitivity of different color developers
盐酸、硫酸、硫代硫酸钠和铁氰化钾-三氯化铁作为显色剂,与同质量浓度(10μg/mL)的碱性橙Ⅱ发生显色反应,结果见表2。
由表2可得出,碱性橙Ⅱ溶液(10μg/mL)本身颜色为黄色,加入不同显色剂后颜色变化不同,其中,以盐酸和硫代硫酸钠为显色剂,反应产物颜色变化不明显,而以硫酸和铁氰化钾-三氯化铁作显色剂,反应产物与碱性橙Ⅱ溶液颜色差异大,尤其是以铁氰化钾-三氯化铁作显色剂,反应产物稀释液与碱性橙Ⅱ溶液的颜色仍有较大差异;从反应所需条件来看,4种显色反应均可在室温下进行,反应产物均较稳定。
表3为不同显色剂与碱性橙Ⅱ反应的灵敏性结果。从颜色变化角度来看,不同种类显色剂与碱性橙Ⅱ发生显色反应的灵敏性差异较大,其中,硫酸作为显色剂时,随着碱性橙Ⅱ质量浓度的降低,溶液颜色由桃红色变为淡粉色;在碱性橙Ⅱ质量浓度为1.0μg/mL以上时,加入硫酸后溶液颜色无明显变化。盐酸作为显色剂时,溶液颜色由橙黄色变为淡黄色;在碱性橙Ⅱ质量浓度为0.5μg/mL以下时,加入盐酸后溶液颜色无明显变化。三氯化铁-铁氰化钾作为显色剂时,溶液颜色由绿色变为浅绿色;在质量浓度为0.1μg/mL时,加入显色剂后溶液呈浅绿色,略带黄色——显色剂颜色。从吸光度角度看,分别稀释5倍后测定其吸光度,结果和颜色变化情况相吻合。说明三氯化铁-铁氰化钾作为显色剂时的最低检测浓度明显比盐酸和硫酸低,即此显色剂的反应灵敏度高。
图1为碱性橙Ⅱ稀释液和碱性橙Ⅱ与不同显色剂反应产物的吸收光谱图。比较碱性橙Ⅱ与不同显色剂反应前后吸收光谱图可以看出,碱性橙Ⅱ与硫酸和盐酸反应产物的最大吸光波长与其自身的最大吸光波长无明显差别,而与铁氰化钾-三氯化铁溶液反应前后吸收光谱图发生了明显的变化。

图1 碱性橙与不同显色剂反应后光谱图Fig .1 Scanning spectra of reaction products of basic orange Ⅱ with different color developers
综合考虑反应体系颜色变化、显色反应灵敏度、反应前后吸收光谱、显色反应对条件的要求以及显色后反应体系的稳定性,最终确定铁氰化钾-三氯化铁混合液为适宜的显色剂。
2.2 显色反应前后的最大吸光波长
如图2所示,碱性橙Ⅱ的最大吸光波长为460nm左右,与铁氰化钾-三氯化铁发生显色反应产物在波长755nm处出现最大吸收峰,故确定以铁氰化钾-三氯化铁作显色剂测定碱性橙Ⅱ残留量的波长为755nm。
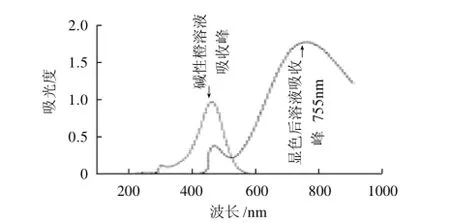
图2 碱性橙Ⅱ显色前后吸收光谱Fig.2 Comparison on scanning spectra of basic orangeⅡand reaction product between it and potassium ferricyanide /Iron (Ⅲ) system
2.3 显色反应条件的优化
2.3.1 显色剂适宜质量浓度与配比的确定
目测观察结果表明,铁氰化钾和三氯化铁以体积比1:1混合后,不论各自质量浓度大小,随着存放时间的延长,混合液都有不同程度的沉淀物质产生;由图3可见,体积比均为1:1的显色剂溶液中,在835nm波长下测定铁氰化钾和三氯化铁混合以后的显色剂溶液吸光度随时间的变化。随着时间的延长,此显色剂在测定波长下吸光度逐渐增加,说明铁氰化钾和三氯化铁混合以后的显色剂不够稳定,需要使用前现混合。在所设定的5种配比范围内,以铁氰化钾(3g/L):三氯化铁(4.5g/L) =1:1时,稳定时间最长。

图3 显色剂混合物质量浓度对稳定性的影响Fig.3 Screening for optimal composition of potassium ferricyanide / Iron (Ⅲ) system
2.3.2 显色反应介质溶剂的确定
为了解决显色产物的沉淀问题,对显色反应介质进行研究。以不同pH值的甘氨酸-盐酸缓冲液和乙酸-乙酸钠缓冲液作显色反应的介质,结果如表4所示。用甘氨酸-盐酸缓冲液作介质时显色稳定性较差;而在pH2.6的乙酸-乙酸钠缓冲液中显色后溶液稳定性较好,显色产物的稳定时间足以满足测定要求,故选用pH2.6的乙酸-乙酸钠缓冲液作为反应的介质溶液。
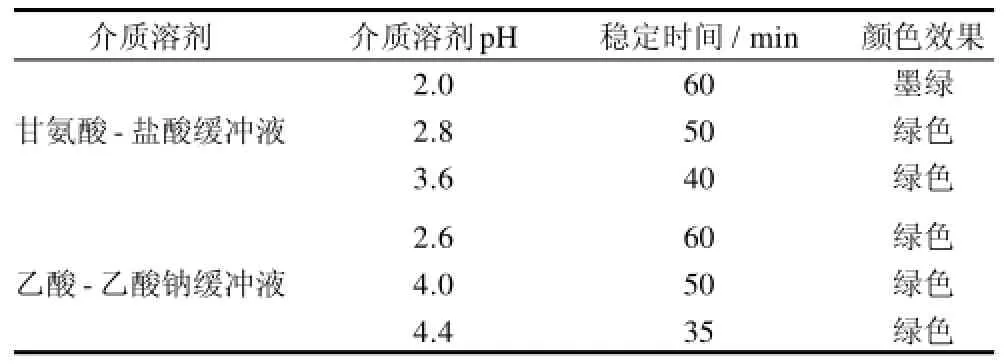
表4 不同介质溶剂对显色反应的影响Table4 Effects of medium solvent type and pH on color development
2.3.3 显色剂用量对显色效果的影响
如表5所示,当显色剂用量达到0.8mL以上时,随着显色剂用量的变化,反应产物颜色变化不明显。不同用量显色剂反应产物吸光度统计分析结果(表6)表明,显色剂用量在0.4~0.7mL时,反应产物吸光度差异不显著。根据显色剂用量选择的原理:1)反应液中所有的碱性橙Ⅱ都应该反应完;2)反应产物的最大吸收波长处的最大吸光度应该小于2.0, 最好是小于1.5。综合考虑反应的显色效果、吸光度差异性和显色剂用量选择原理,确定显色剂用量为0.5~0.7mL比较适宜。
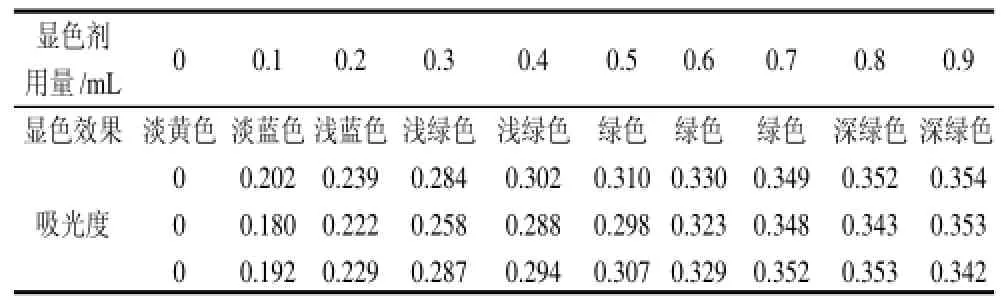
表5 不同显色剂用量的显色效果比较Table5 Effects of color developer amount on color development
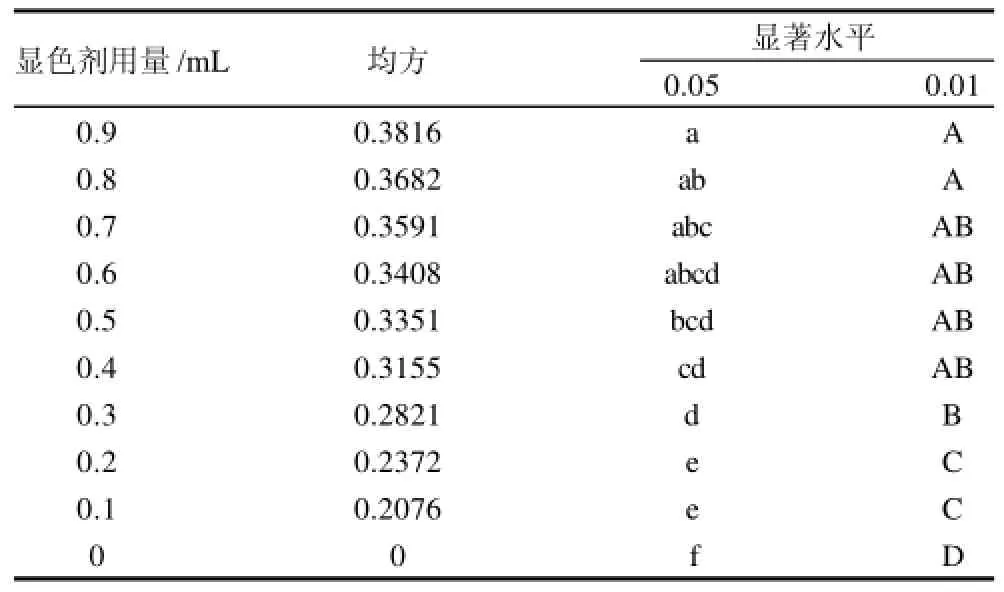
表6 不同显色剂用量对显色效果影响的多重比较Table6 Multiple comparison on effects of color developer amount on color development
2.3.4 反应时间对显色反应效果的影响
从图4可以看出,在一定温度条件下,显色剂加入后,吸光度随反应时间的延长而增加。在反应的前20min内,吸光度增加幅度大,20min后,吸光度趋于平稳,故确定碱性橙Ⅱ检测的适宜显色反应时间为20min。

图4 反应时间对显色反应产物吸光度的影响Fig.4 Effect of reaction time on color development
2.3.5 反应温度对显色效果的影响

表7 显色反应温度对显色效果的影响Table7 Effect of reaction temperature on color development
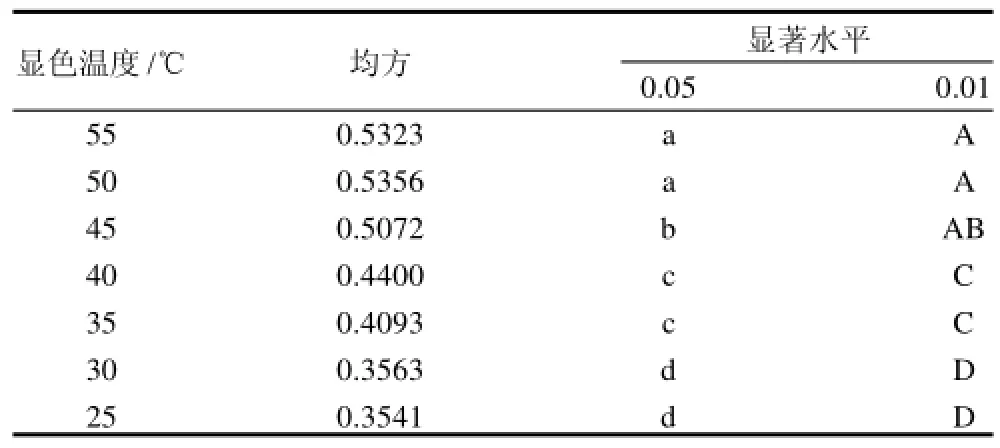
表8 显色温度对显色效果的多重比较Table8 Multiple comparison on effect of reaction temperature on color development
由表7可以看出,反应温度对显色效果有明显的影响,随着反应温度的升高,显色后溶液的吸光度随之增加,但在35~50℃肉眼观察颜色变化不明显。统计分析结果(表8)表明,反应温度为50、55℃两个处理显色反应产物吸光度显著高于其他处理,二者之间差异不显著;显色温度为40、45℃和50℃处理之间差异显著。故初步确定适宜反应温度为50℃。
2.3.6 显色反应正交试验
通过单因素试验,初步确定显色反应的适宜条件,在此基础上,进一步对显色剂用量、显色时间和显色温度进行了三因素三水平正交试验,试验结果如表9所示。根据正交试验结果,对试验结果影响的主次顺序为B(显色温度) >C(显色剂用量)>AB>A(显色时间),铁氰化钾-三氯化铁测定碱性橙Ⅱ的最佳条件为显色时间20min;显色温度50℃;显色剂用量0.7mL。
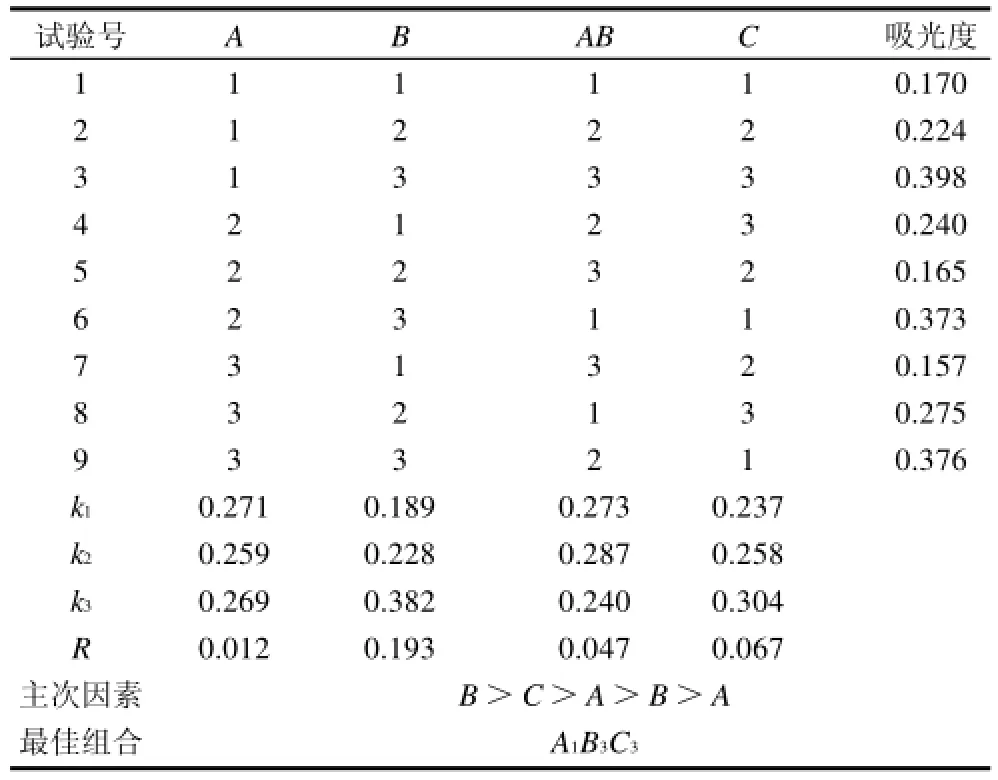
表9 正交试验设计及结果Table9 Orthogonal array design layout and experimental results
3 结 论
利用碱性橙Ⅱ与某些试剂发生显色反应的特点可以快速检测其在食品中残留量。本实验综合分析碱性橙Ⅱ与不同种类显色剂发生反应前后颜色的变化、显色反应灵敏度、反应前后吸收光谱、显色反应对条件的要求以及显色后反应体系的稳定性等,确定铁氰化钾-三氯化铁混合液为适宜的显色剂。该显色剂与碱性橙Ⅱ反应可生成普鲁士蓝[12],且生成物质的量与反应物浓度成线性关系,该物质在酸性溶液中易溶解。介质的pH值对显色反应的稳定性有较大影响,实验确定用pH2.6的乙酸-乙酸钠缓冲液作反应介质溶液,反应20min时显色效果最佳。温度对显色反应有一定影响,随着反应温度的升高,达到反应平衡所需时间有所缩短,实验确定反应最佳温度为50℃。铁氰化钾-三氯化铁显色剂的用量对显色的效果影响较大,实验表明0.7mL 为最佳使用量。混合后显色剂放置时间过长会产生沉淀,可分别配制铁氰化钾和三氯化铁溶液,临用前现混合。
[1]铁晓威, 黄百芬, 任一平. RP-HPLC法测定染色黄鱼中的碱性橙Ⅱ含量[J]. 中国卫生检验杂志, 2004, 14(1): 59-61.
[2]GB/T 23496—2009食品中禁用物质的检测: 碱性橙染料高效液相色谱法[S].
[3]周焕英, 高志贤, 孙思明, 等. 食品安全现场快速检测技术研究进展及应用[J]. 分析测试学报, 2008, 27(7): 788-794.
[4]范宁云, 顾敏, 陆磊, 等. 不同特性环境与食品样品前处理新技术的发展与应用[J]. 甘肃联合大学学报, 2007, 21(2): 55-57.
[5]程术华, 于连良. 食品添加剂安全现状与对策[J]. 医学动物防治, 2007, 23(11): 851-853.
[6]江迎鸿, 陈亚波, 关建山, 等. 超声提取-高效液相色谱法测定食品中碱性橙Ⅱ燃料[J].食品研究与开发, 2009, 30(7): 153-154.
[7]潘涛, 王大章, 王硕. 固相萃取-高效液相色谱法检测保健食品中违禁添加物诺龙[J]. 食品研究与开发, 2009, 30(10): 114-116.
[8]TOLDRA F, REIG M. Methods for rapid detection of chemical and veterinary drug residues in animalfoods[J]. Trends in Food Science & Technology, 2006, 17: 482-489.
[9]LI Yongjie, ZHAO Meiping. Simple methods for rapid determination of sulfite in food products[J]. Food Control, 2006, 17: 975-980.
[10]林钦. 高效液相色谱法同时测定豆制品中的碱性橙Ⅱ和碱性嫩黄染料[J]. 色谱, 2007, 25(5): 776-777.
[11]王翔, 宋国新, 赵建丰, 等. GC/MS法测定鱼类产品中的碱性橙[C]//第五次华北五省电子显微学研讨会及第六届实验室协作服务交流会论文集. 银川: 中国物理学会, 2008.
[12]黄喜茹, 高洁, 韩春龙, 等. 铁氰化钾-三氯化铁显色体系测定野生和栽培丹参及其制剂中水溶性酚酸总量[J]. 化学试剂, 2007, 29(9): 532-534.
[13]阿布力克木·阿布力孜, 迪丽努尔·塔力甫, 艾沙·努拉洪, 等.分光光度法测定和田核桃仁内隔膜中总黄酮含量[J]. 食品科学, 2008, 29(11): 552-554.
[14]毕会锋, 杨卫身, 杨凤林, 等. 酸性橙的化学氧化脱色和矿化[J]. 染料与染色, 2005, 42(6): 45-49.
[15]王翔. N-亚硝胺化合物和非法食品添加剂碱性橙Ⅱ的GC/MS检测方法研究[D]. 上海: 复旦大学, 2009.
[16]刘亚雄. 新型固相萃取填料开发及新型快速制备柱色谱系统的研究[D]. 天津: 天津大学, 2006.
[17]韩津生, 孙文龙, 袁爱红. 水中碱性玫瑰精的分光光度测定法[J]. 环境与健康杂志, 2008, 25(4): 348-349.
[18]CERNA M, BARROSB A S, NUNES A, et al. Use of FT-IR spectroscopy as a tool for the analysis of polysaccharide food additives[J]. Carbohydrate Polymers, 2003, 51: 383-389.
[19]GUI Wenjun, XU Yong, SHOU Linfei. Liquid chromatography-tandem mass spectrometry for the determination of chrysoidine in yellow-fin tuna[J]. Food Chemistry, 2010, 122: 1230-1234.
[20]REIG M, TOLDRA F. Veterinary drug residues in meat: concerns and rapid methods for detection[J]. Meat Science, 2008, 78: 60-67.
Screening for Colour Developer and Optimization of Reaction Conditions for Fast Determination of Basic Orange Ⅱ in Foods
JI Shu-juan,ZHANG Qing-huan,SHEN Yi-xiao
(College of Food Science, Shenyang Agricultural University, Shenyang 110161, China)
Using the ability of basic orange Ⅱ to develop color, a fast method was presented for the determination of this dye. The optimal conditions for color development were investigated. A reagent system composed of potassium ferricyanide and Iron (Ⅲ) was found to the best color developer through comparative analysis of color developing effects of different color developers and observation of absorbance change, and the optimal ratio of potassium ferricyanide solution (3 g/L) to ferric chloride solution (4.5 g/L) was 1:1. The optimal reaction conditions were determined based on absorbance at 755 nm wavelength as follows: color developer amount, 0.7 mL; and reaction temperature, 50 ℃ for a reaction duration of 20 min.
basic orange Ⅱ;colorimetry;ast determination
TS207.3
A
1002-6630(2010)20-0394-05
2010-06-23
辽宁省教育厅重点项目(2009A633)
纪淑娟(1960—),女,教授,博士,研究方向为食品质量控制。E-mail:jsjsyau@sina.com
