玫瑰花营养保健成分分析及花青素稳定性研究
2010-03-21洪旻禛
洪旻禛
玫瑰花营养保健成分分析及花青素稳定性研究
洪旻禛
(西南大学 食品科学学院, 重庆 北碚 400716)
通过对玫瑰花进行系统预试实验,对其中的活性成分作出初步定性判断。同时,对玫瑰花部分营养保健成分进行定量测定,结果发现玫瑰花呈弱酸性,可能含有酚类化合物、鞣质、糖、多糖和苷、甾体、花青素、维生素C等化学成分。对花青素稳定性进行比较研究,分析得光照对花青素稳定性影响最小;酸性条件下,温度越低,酸性花青素越稳定。
玫瑰花;营养成分;功能成分;花青素的稳定性
玫瑰具有较高药用价值和经济价值,它所含的多酚类色素,有抗氧化及抗自由基、保护心血管和中枢神经系统等功能,其中花色素苷还有保护视力的独特功效[1]。经研究证实,花色变异主要是橡黄素和花青素二者产生的变化,因此,防止花青素降解对产品保健功能及颜色稳定具有重要意义。
花青素作为一种具有特殊功效的天然色素,在食品添加剂中的作用日趋显著。玫瑰花色彩鲜艳,花瓣层厚,非常适合提取色素,但目前针对其花青素含量及稳定性的实验研究还不完善。本实验以云南产的玫瑰花为实验材料,除对其所含常规成分及部分功能成分进行定量、定性分析外,着重对玫瑰花多酚及花青素含量进行测定,确定花青素在其所含多酚类物质的比重,结合研究不同光照时间、温度、酸碱度对花青素稳定性的影响。
1 材料与方法
1.1 实验材料与设备
1.1.1 实验材料
玫瑰花(Rosa rugosa、云南产)、花青素(天津尖峰天然产物公司)
1.1.2 实验试剂
盐酸、乙醇、乙醚、甲醇、醋酸、浓硫酸、氢氧化钠、铁氰化钾、乙醚、正丁醇、三氯化铁、氯仿。(以上均为分析纯)、碘、亚甲基兰指示剂、淀粉、硝酸银、二氯靛酚钠试剂
1.1.3 实验仪器与设备
上海菁华科技仪器有限公司的可见分光光度计(722S),岛津制作所的紫外分光光度计(UV2450),上海理达仪器厂的PH检测仪(PHS-3BW)
1.2 实验方法
1.2.1 系统预试实验[2]
制取玫瑰花预试试液(水提取液、乙醇提取液、乙醚提取液、甲醇提取液),通过系统预试法,依据各类化合物特有的显色反应或沉淀反应,利用简单的定性试验进行检查.
1.2.2 茶饮一般品质成分测定
(1)灰分的测定(灼烧重量法)[3]
参考GB/T 5009.4-2003.
(2)水溶性浸出物的测定:冷水浸出物、热水浸出物、醇溶性浸出物、醚溶性浸出物
冷浸法:精密称取4g样品,置于250烧瓶中加入蒸馏水100ml,静置18h后过滤,精密吸取滤液20ml,置于蒸发皿中,水浴蒸干;在105℃干燥3h,移至干燥器中冷却30min,迅速称重。
热浸法:精密称取4g样品,置于250ml烧瓶中加入蒸馏水100ml,静置1h后冷凝回流并保持微沸1h。放冷后用蒸馏水补足减失的种量。精密吸取滤液25ml水浴蒸干,于105℃干燥3h后移至干燥器中冷却30min,称重。
醇溶性浸出物:选用20%和80%浓度的乙醇代替蒸馏水为溶剂,照水溶性浸出物测定法进行。
醚溶性浸出物:取4g样品, 用乙醚作溶剂,置于脂肪抽出器中,水浴加热4h,放冷后以少量乙醚冲洗回流器,洗液接入蒸馏瓶,低温蒸去乙醚,残渣于105℃干燥3h后于干燥器中冷却30min,称重。
(3)碳水化合物的测定[4]:总糖的测定(铁氰化钾法)、还原糖的测定(碘量法)
总糖的测定:吸取5ml冷水浸出液,按铁氰化钾的标定法进行测定。
还原糖的测定:精密称取10g样品于250ml容量瓶中,加水后摇匀静置30min,取滤液50ml准确加入25ml 0.1mol/L碘标准溶液,在不断摇动下加入37.5ml 0.1mol/L的氢氧化钠标准溶液。放置暗处15min后加入8ml 0.5mol/L盐酸,摇匀并用0.1mol/L硫代硫酸钠标准溶液滴定直至溶液由红棕色变浅黄色,加入1ml淀粉指示剂后继续滴定至蓝色消失为止。
(4)水分的测定(减压干燥法)[5]
参考GB/T 5009.3-2003.
1.2.3 玫瑰花部分功能成分的定量分析:
多酚:(分光光度法)[6]
参考GB/T8313-2002.
花青素:(紫外可见分光光度法)[7]
称取2g样品,剪碎置于烧杯,加入10ml 0.1mol/L HCl, 盖紧杯口,置于32℃温箱中,浸置6h后过滤,滤液用V2530紫外可见光分光光度计,在波长530nm下读取吸光度,以0.1mol/L HCl为空白对照。
1.2.4 花青素稳定性分析:测定温度、光照、酸碱度对花青素的影响(采用紫外可见分光光度法)[8]
本次实验所得数据均为三次平行实验所得平均值,使用EXCEL处理数据。
2 结果与分析
2.1 玫瑰花功能成分定性分析
预试验结果如表1所示。

表 1 玫瑰花提取液化学成分预试结果
注:“ + ”表示阳性结果;“ - ”表示阴性结果
由表1可得,玫瑰花提取液PH值为5.3,显弱酸性。对酚类化合物、鞣质、糖、多糖和苷、甾体、花青素、维生素C等化学成分的检测结果均为正反应,可以初步判定其存在。
2.2 玫瑰花部分化学成分的定量分析
2.2.1 灰分、总糖、还原糖、水分的含量测定
测定结果与一般绿茶比较结果如表2所示。样品灰分含量过高,则表明样品中可能混有沙粒、灰尘或其他物质[12];由表2可知,样品测得的灰分含量为2.14%,低于一般绿茶标准,可判断实验所用玫瑰花样品品质较好。
水分含量过高易发生霉变、营养成分及风味物质变化[13]。数据显示,样品的水分含量为7.35%,于一般绿茶的标准范围内,分析可得,本次实验所用的玫瑰花样品性质稳定,有利于贮藏。
可溶性糖是茶品中主要的甜醇味物质,是茶汤滋味的主要成分。实验测得样品的总糖及还原糖含量均低于一般绿茶标准,这一因素使得玫瑰花茶与一般绿茶冲泡后风味的不同。

表2 玫瑰花及一般绿茶灰分、总糖、还原糖及水分含量
2.2.2 玫瑰花浸出物含量的分析
玫瑰花各种浸出物含量与一般绿茶比较结果如表3所示。各种浸出物的含量在一定程度上反映为茶汤的厚薄和浓淡,与茶品质量呈正相关。根据表3的测定结果,样品的醚溶性浸出物含量最高,达14.82%;冷水浸出物含量最低,仅1.132%;浓度为20%的浸出物含量略高于乙醇浓度为80%的。各种浸出物含量均远低于一般绿茶水平,说明绿茶所含化学成分较多,因此其汤色、味浓度均高于玫瑰花茶。此外,利用样品醚溶性浸出物含量最高这一结论,可进一步指导玫瑰花在加工过程中营养成分的完全提取,改进冲泡方法,达到玫瑰花茶的合理科学饮用。

表3 玫瑰花和一般绿茶各种浸出物含量
2.2.3 玫瑰花部分多酚类成分的定量分析
分别采用“分光光度法”、“紫外可见分光光度法”测定样品浸液多酚含量,花青素含量,与一般绿茶比较结果如表4所示。茶多酚有极强的抗氧化作用,同时它还具有利尿、利胆、抗菌、升高或降低血压等生理活性,与茶叶的色香味有直接关系。主要包括:花青素、儿茶素、黄酮、酚酸等四类化合物。
由表4可得,样品玫瑰花所含多酚量为12.51%,低于一般绿茶的标准范围,因此,一般绿茶茶汤具有明显苦涩味,而玫瑰花茶苦涩味较弱,同时可知玫瑰花茶的抗氧化效果不如一般绿茶;样品所测得的多酚类色素——花青素含量高于一般绿茶标准,因此其茶汤色与绿茶存在明显差异。此外,由实验数据对比分析可知,玫瑰红主要的酚类物质为花青素,是玫瑰花茶冲泡后进行感观鉴定的主要指标。
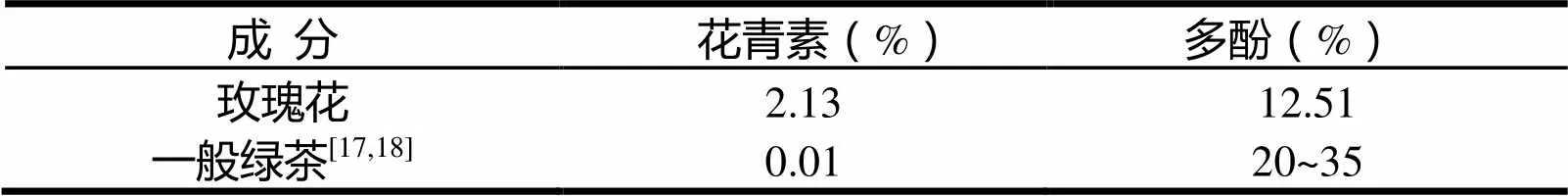
表4 玫瑰花和一般绿茶浸液多酚及花青素含量
2.3 影响玫瑰花花青素稳定性的因素分析
由于花青素的高活性,温度、PH、光照等因素都能对其稳定性产生影响,如何提高花青素的稳定性减少分解率,是推广使用花青素所必需解决的关键问题。
光线会诱使天然色素分解或氧化而脱色[19]。此外,经过长时间的加热,花青素会发生两方面变化,一方面会生成无色的查尔酮式结构,另一方面在酸性条件下加热会发生酸解,苷键水解,生成相应的苷元和糖[20]。由于花青素分子中含有酚羟基及其吡喃环上的氧原子是四价,所以花青素同时具有酸和碱的性质,这一特性使其具有随介质PH值而改变结构,从而改变颜色的可能性。
2.3.1 光照对玫瑰花花青素稳定性的影响
用0.1mol/L HCL配制花青素粗提取物于具塞试管中,置于室内光照处,测得浓度变化如图1所示。由图1可知,样品花青素提取液经光照一天后,浓度由1.476mg/mL迅速降至1.421mg/mL,减少幅度最大;随着光照时间的延长,变化趋于平缓;光照四天后,花青素浓度不再减少略有回升;此后,浓度又缓慢下降。分析可知,玫瑰花花青素在光照初期分解迅速,随着光照时间增加分解速度降低,保存率较高,为95.73%,受光照影响较小。
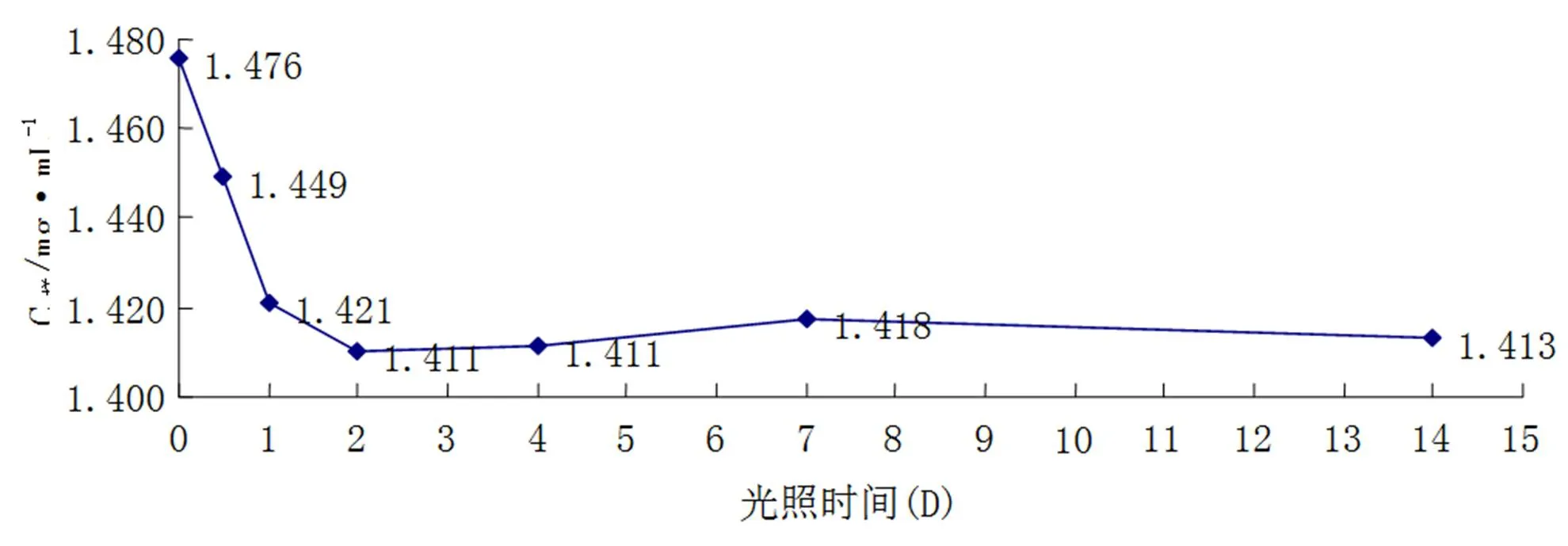
图1 光照对玫瑰花花青素稳定性的影响
2.3.2 温度对玫瑰花花青素稳定性的影响
用0.1mol/L HCL配制花青素粗提取物于具塞试管中,置沸水浴中测得浓度变化如图2所示。由图可知,在100℃高温加热下,玫瑰花花青素的浓度随加热时间的增加而缓慢减少,其间略有回升,保存率为57.08%。加热2小时后,达到浓度最低值0.598mg/mL。继续加热浓度略有回升。分析可得,玫瑰花花青素受高温加热后影响较大,分解率高,分解速度较为平缓。说明其应在低温下保存。
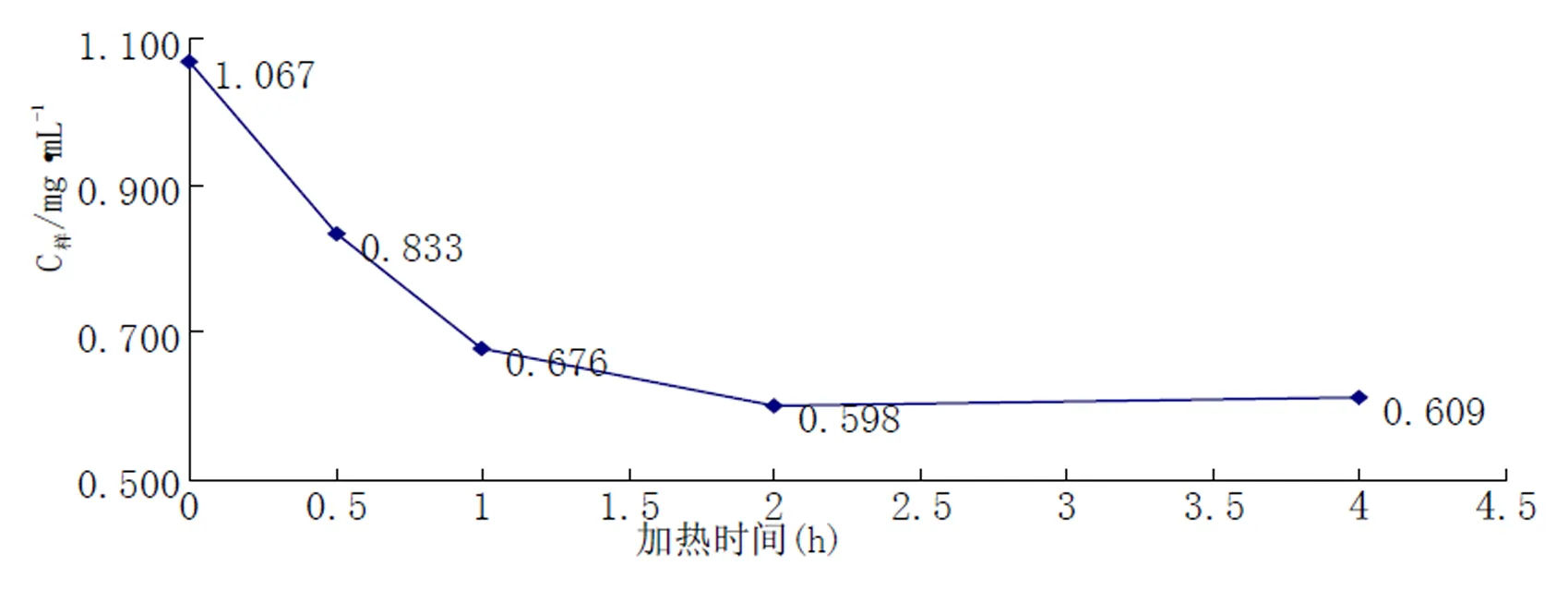
图2 温度对玫瑰花花青素稳定性的影响(100℃)
2.3.3 酸碱度对玫瑰花花青素稳定性的影响
用0.1mol/L HCL配制花青素粗提取物于具塞试管中,分别添加PH为3.0、5.0、7.0、9.0的缓冲溶液,测定浓度变化如图3所示。于100℃下加热2小时,添加不同PH值的花青素提取液颜色变化如表5所示。
由图3可知,添加不同PH值的缓冲液一天后,花青素分解迅速,浓度下降率最大;二天后,浓度均降至最低值,而后略有回升。其中,添加PH=7的缓冲液的样品保存度最高,添加PH=5的缓冲液保存度最低。由表5可得,添加不同PH值的缓冲溶液经100℃加热处理后,花青素粗提粗液颜色变化程度不同。缓冲液PH=3时,处理前后均为红赤,变化不明显;缓冲液PH=9时,分别由浅紫色变为肉桂色,变化较为明显。综合两表可得,PH值较高时,花青素稳定性差,分解较快;PH值较低时,玫瑰花花青素较稳定。
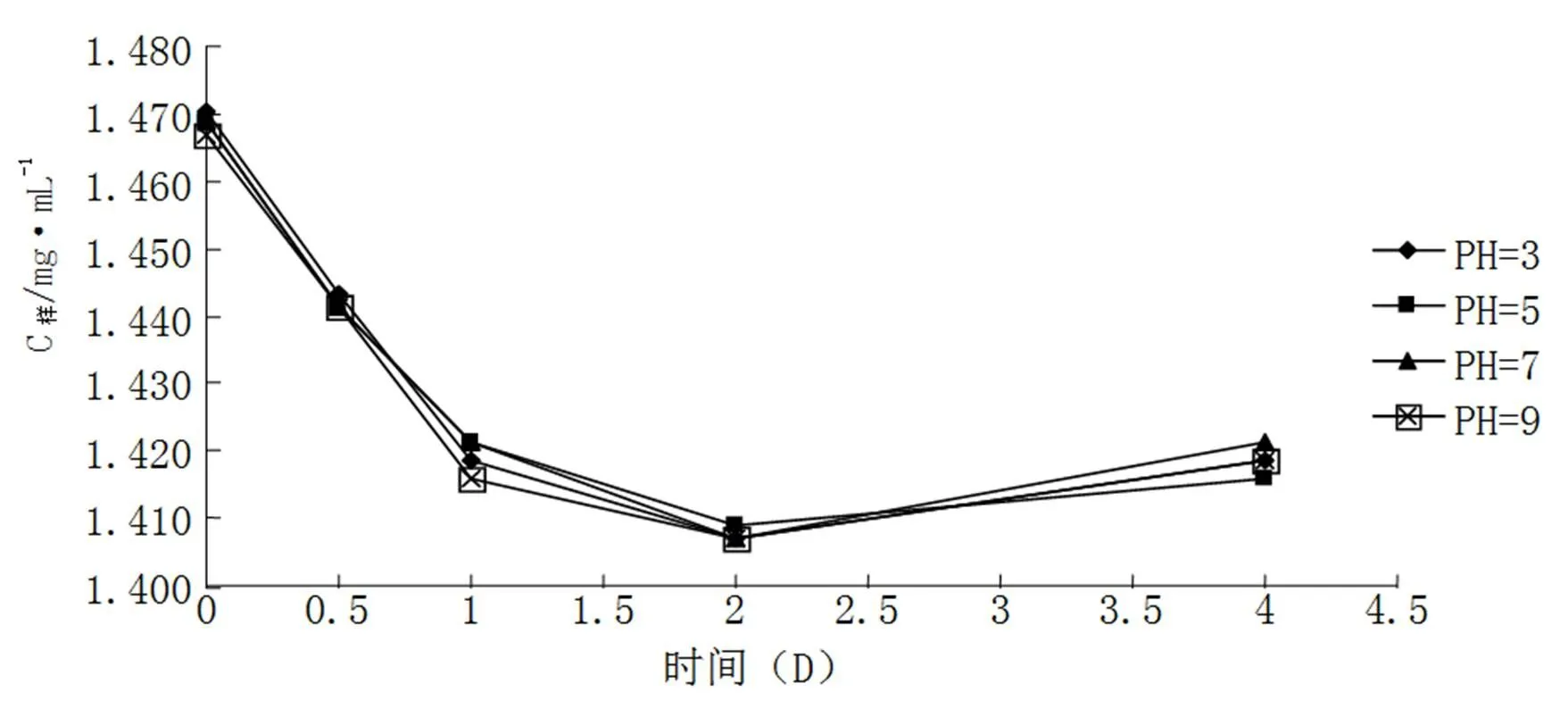
图3 酸碱度对玫瑰花花青素稳定性的影响

表5 不同PH值玫瑰花花青素提取液加热前后颜色变化
3 结论
本次实验对玫瑰花中的一些常规成分和功能成分作出了测定,分析了化学成分与玫瑰花茶品质的关系并通过对在温度、光照时间及添加不同PH值缓冲溶液后玫瑰花花青素浓度的测定,比较得出花青素受光照影响最小,耐光性好,可用作食品着色剂;高温下花青素分解度高,但酸性条件下较稳定,日常冲泡及工业加工时应注意温度及PH值的掌控,以保持玫瑰花茶汤的颜色鲜丽。实验结论为日常生活中玫瑰花茶的合理贮藏、科学饮用及食品工业中其功能性产品的进一步开发提供依据。
[1] 陈伟,宣景宏,孟宪军.玫瑰花色素提取与性能的研究进展[J].北方园艺,2006,(2):54-55.
[2] 董小萍.中药品种品质与化学成分实验[M].上海:上海科学技术出版社,2003.3:169-173.
[3] 中华人民共和国国家标准GB/T 5009.4-2003[S].
[4] 胡明方.食品分析[M].重庆:西南师范大学出版社,1992:58-61.
[5] 中华人民共和国国家标准GB/T 5009.3-2003[S].
[6] 中华人民共和国国家标准GB/T8313-2002[S].
[7] 姚开,何强,等.葡萄糖提取物中花青素含量不同测定方法比较[J].化学研究与应用,2002,14(2):230.
[8] 刘超.紫甘薯花青素的提取及其稳定性和抗氧化性的研究[D].湖南:湖南农业大学,2008:38-39.
[9] 敬廷桃.应用HB43-S卤素水分测定仪测定茶叶水分含量初探[J].福建茶叶,2009,(2):18-19.
[10] 陈宗道,周才琼等.茶叶化学工程学[M].重庆:西南师范大学出版社,1999.
[11] 叶阳,陈小强等.3类茶中水溶性多糖及蛋白质的含量分析[J].安徽农业科学,2008,36(29):12761-12762.
[12] 陈宗懋.中国茶经[M].上海:上海出版社,1982:5.
[13] 杨吕举.食品科学概论[M]北京:中国人民大学出版社,1999:354-361.
[14] 肖文军,龚志华.绿茶浸提物动态研究[J].湖南农业大学学报:自然科学版,1999,25(4):293-295.
[15] 徐准盾,龚淑英.茶汤浓度对绿茶水浸物含量及其感官审评的影响[J].茶叶,2005,31(3):166-169.
[16] 萧力争,胡祥文,等.绿茶乙醇浸提技术研究[J].天然产物研究与开发,2006,18 (4):634-636.
[17] 宛晓春.茶叶生物化学[M].北京:中国农业出版社,2003.
[18] 傅文军,秦樊鑫,张丹.分光光度法测定黔产绿茶中总黄酮的含量[J].贵州师范大学学报,2005,23(4):105-107.
[19] 植中强,李红缨,杨海贵.天然食用色素提取工艺与稳定性研究的状况[J].广州化工,1999,27(4):18-20.
[20] 马自超,庞业珍.天然食用色素化学及生产工艺学[M].北京:中国林业出版社,1994.
Rose Nutrition And Functional Components Analysis And Stability of Anthocyanins Research
Hong Min-zhen
(College of Food Science, Southwest University, Beibei Chongqing,400715,China)
This paper systematic pre-test on the roses through traditional Chinese medicine research methods, making a preliminary qualitative judgments on the active ingredient. Meanwhile. According to national standard methods on some roses nutrition were determined by preliminary test results found by the system rose weakly acidic, it should contain phenolic compounds, tannins, sugars, polysaccharides and glycosides, sterols, anthocyanins, vitamin C, alkaloids and other chemical components, excluding cardiac glycosides, anthraquinones. Analyzing the anthocyanins as the major component of red roses, and a comparative study of the stability of anthocyanin, showed the least effect of light on anthocyanin stability; under the acid ogle, the lower the temperature, the more stable acid anthocyanin.
Rose;Nutrients;Determination;Anthocyanins;Stability
2010-10-12
洪旻禛(1987-),女,福建龙海人,在读硕士生,研究方向:食品工程。
S685.12
A
1673-1417(2010)04-0015-06
