HWTX-I对运动性骨关节损伤大鼠关节软骨中iNOS表达及血清NO含量的影响
2010-03-19钟文涛陶谷阳罗赤苗陈嘉勤
容 瑛,黄 鹏,钟文涛,陶谷阳,杨 华,罗赤苗,陈嘉勤★
(1.湖南师范大学体育学院,湖南 长沙 410012;2.邵阳市中心医院,湖南 邵阳 422000)
运动性骨关节损伤是一种严重危害运动员运动能力和运动寿命的机械磨损性和无菌慢性进行性骨关节病。长期从事剧烈运动的运动员,如长跑、举重、柔道等项目的运动员,骨关节经常承受过大的压力,更会加速骨关节的磨损,从而导致关节损伤,诱发运动性骨关节炎[1]。运动性骨关节损伤中,运动员常见的为多发性软骨机械磨损,进而导致退行性变以及无菌慢性进行性疾病。它的发生发展是一个复杂的病理过程,其临床表现与病理改变与骨关节炎非常相似,属于骨关节炎的一种[2]。骨关节炎(Osteoarthritis,OA)是一种以关节软骨退行性改变为核心,累及骨质,并包括滑膜、关节及关节其它结构的全方位、多层次、不同程度的慢性炎症。关节的修复能力较差,一旦损伤即可产生永久性病变,导致关节功能性障碍,其治疗时间长,恢复慢,对运动员训练影响较大,甚至导致运动员中止训练。慢性运动性骨关节损伤是运动医学上常见的问题,传统的治疗方法难以取得满意的效果,是运动医学界的一大难题。因此有关慢性运动性骨关节损伤发生发展机制及其干预的研究在运动医学领域中具有重要的应用价值和意义。
虎纹蜘蛛毒素-I(HWTX-I)是从我国珍稀蜘蛛虎纹捕鸟蛛(Selenocosmia huwena)粗毒中分离纯化的一种天然多肽类神经毒素,是一种作用于突触前膜的N型钙离子通道阻断剂[3]。
在前期工作中,我们通过大鼠踝关节腔内注射弗氏佐剂制作大鼠佐剂性关节炎模型,模拟急性炎性骨关节损伤的病理改变。前期研究结果表明:HWTX-I对我们复制的急性骨关节损伤模型有明确的抗伤害性效应[4]。
本文采用改良的Hulth模型[5],切断大鼠前后交叉韧带后结合间歇性中低强度运动,建立大鼠运动磨损性慢性骨关节病理模型。以布洛芬作为阳性对照,通过各组大鼠膝关节软骨显微结构形态改变,及骨关节损伤侧大鼠膝关节软骨诱导型一氧化氮合成酶(iNOS)的表达及血清中NO含量的变化,探讨HWTX-I对慢性运动性骨关节损伤的保护作用机制,为其临床应用提供理论和实验依据。
1 材料与方法
1.1 材料
实验动物:健康雄性SD大鼠30只,体重180~250 g,由湖南农业大学实验动物中心提供。试剂:虎纹蜘蛛毒素-I(HWTX-I)湖南师范大学生命科学学院蛋白质化学与分子生物学实验室分离纯化,深圳科兴生物制品公司加工制备;布洛芬缓释片为惠州大亚制药有限公司生产;诱导型一氧化氮合成酶免疫组化全套试剂盒为武汉博士德生物工程有限公司产品;一氧化氮试剂盒为南京建成生物工程研究所产品。
1.2 分组
健康雄性SD大鼠30只,随机分成3组:非用药组、HWTX-I用药组和布洛芬用药组。每组10只,各组分笼饲养,自由饮食,室温(22±3)℃,相对湿度55%~75%。
1.3 建模
1.3.1 构建大鼠运动性关节损伤模型
建立大鼠运动性关节损伤模型:SD大鼠用10 %水合氯醛腹腔注射麻醉(0.4 mL/100 g体重)。待大鼠麻醉后,取髌内侧切口,切断内侧副韧带,打开膝关节腔,用眼科剪剪断前后交叉韧带,术中不损伤关节软骨面,彻底止血,逐层缝合,术后均肌注青霉素钠2 0万单位以防感染。术后7天,待大鼠伤口愈合后,每组采用动物实验跑台模拟运动员受伤后运动训练。第一周为熟悉跑台和适应运动负荷阶段,运动强度逐渐增加(跑台速度由10m/min逐渐增加到16 m/min);从第二周开始进行正式训练,每次训练保持16 m/min不变,运动时间为30min。每周训练6天,休息1天,连续训练2周。各组大鼠再放养2周,于术后第42天取材。运动时采用毛刷刺激大鼠尾部,必要时采用声音刺激或电刺激,以保证运动强度与运动量。
1.3.2 大鼠硬脊外腔置管
采用Yaksh TL,Rudy TA等的蛛网膜下腔置管术[6],经适当改进应用于本研究。SD大鼠用10%水合氯醛腹腔注射麻醉(0.4 mL/100 g体重)。待大鼠麻醉后,用手指寻找胸椎最突出的棘突T8,以此为中心,逐层切开皮肤、肌肉,向下找到T9与T10之间的椎间隙。向硬膜外腔插入PE管,进管深度约2 cm,外端约留5 cm长,埋管,缝合切口。术后注射20万u青霉素钠消炎。实验后大鼠放回饲养笼中,让其自然苏醒,同时用红外取暖器给大鼠取暖。自由进食、饮水,室温26℃过夜,手术后稳定饲养7天,只有那些没有运动功能障碍的动物才能进行以下实验。
1.4 给药
HWTX-I用药组,硬脊膜外腔按60μg/kg注射HWTX-I;非用药组按 60μg/kg计算等体积的0.9%生理盐水注入大鼠硬脊膜外腔;布洛芬用药组以10%的乙醇溶解布洛芬缓释片后,按照12mg/kg的剂量给大鼠灌胃。通过上述方式从第三周开始给药,连续给药一周,第二周间隔给药。
1.5 切片标本制备及组织形态学观察
术后第42天,各组断颈处死,取下右膝关节,标本立即在新鲜配制4%多聚甲醛中固定过夜。用0.2mol/L的磷酸缓冲液冲洗后,放入10%EDTA脱钙10天 ;常规脱水,透明,石蜡包埋。组织连续切片,厚度为5μm,HE染色,光镜下观察。
1.6 免疫组织化学法测定iNOS
石蜡切片脱蜡至水;3%H2O2室温孵育10min以灭活内源性酶,蒸馏水洗3次;热修复抗原,冷却后0.1 M PBS洗2次;滴加5%BSA封闭液,室温20分钟,甩去多余液体,不洗;滴加1:100稀释的一抗iNOS,室温60min,0.1M PBS洗2min×3次;滴加生物素化山羊抗兔1gG,室温20min,0.1 M PBS洗2min×3次;滴加试剂SABC,室温20min,0.1 M PBS洗5min×4次;DAB显色,室温显色10min,蒸馏水冲洗;苏木素轻度复染;脱水,透明,封片。
1.7 结果检测与统计学处理
用Simple PCI图像分析系统对膝关节软骨组织中出现的棕褐色阳性产物的灰度和面积进行分析,具体步骤为:每张切片在×200倍镜下选取不相重叠的3个代表性视野,测量阳性反应产物的面积和灰度值以及所选区域的平均灰度值。阳性产物的表达用阳性单位表示,公式为:

1.8 血清中NO含量的测定
大鼠用10%的水合氯醛麻醉 (0.4 mL/100g体重),使用已灭菌的镊子以摘眼球的方式取血,收集血液于10mL离心管中,4℃,6 000 r/min离心10 min,小心吸取上层血清,500μL每离心管分装并冷冻保存。血清中NO检测采用分光光度法,操作过程严格按照试剂盒说明书进行。
1.9 统计学处理
所有实验数据均采用SPSS17.0统计软件进行单因素方差分析检验。实验数据以平均值±标准差表示,P<0.05为差异具有显著统计学意义,P<0.01为差异具有非常显著统计学意义。
2 结果
2.1 各组大鼠膝关节软骨HE染色结果形态学观察
非用药组膝关节软骨表面出现关节裂隙,组织结构破坏,潮线消失,软骨细胞排列紊乱,胶原纤维断裂,关节腔内纤维素样渗出;布洛芬用药组膝关节软骨表面粗糙,组织结构接近正常,软骨细胞排列不齐,可见软骨细胞固缩;HWTX-I用药组膝关节软骨表面较光滑,潮线整齐,软骨细胞排列一致,可见少许软骨细胞固缩。具体见图1。
2.2 各组大鼠iNOS膝关节软骨免疫组织化学染色结果
2.2.1 iNOS蛋白表达结果
非用药组膝关节软骨可见阳性细胞表达率高且染色深;布洛芬用药组次之;HWTX-I用药组膝关节软骨可见阳性细胞表达,但其分布明显较非用药组、布洛芬用药组分布稀疏,且染色较浅;正常SD大鼠膝关节软骨几乎未见阳性细胞表达。具体见图2。
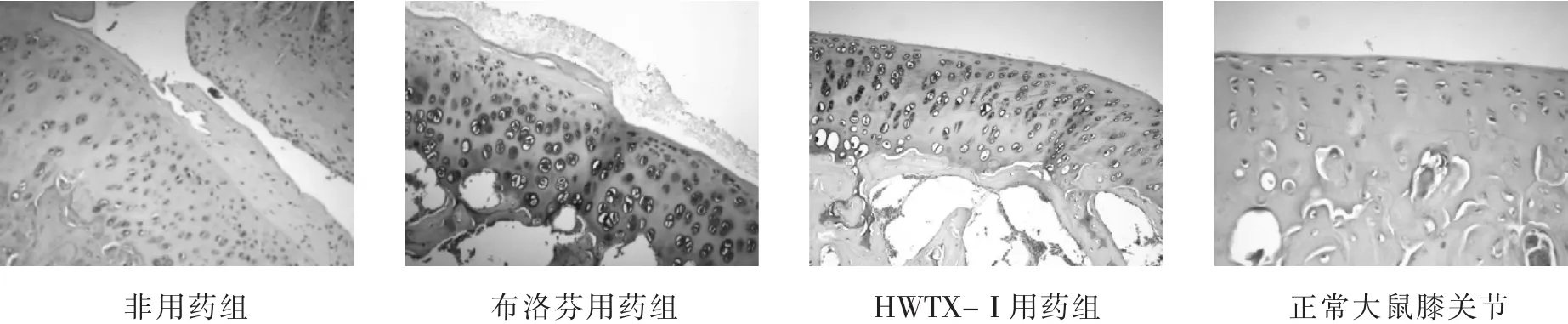
图1 各组大鼠关节软骨HE染色结果(×200)
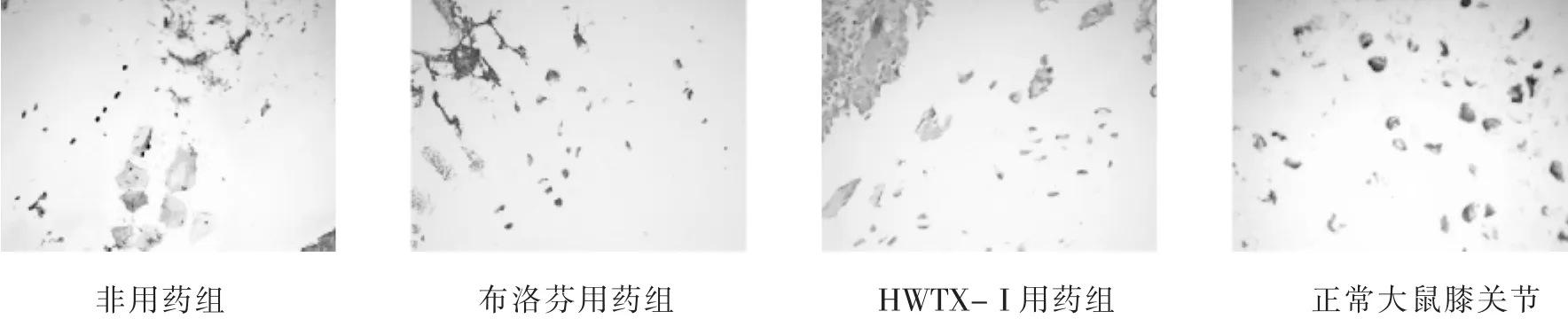
图2 各组大鼠关节软骨iNOS免疫组织化学染色结果(×200)
2.2.2 计算机显微图像分析结果
iNOS阳性单位的表达值以非用药组最高,布洛芬用药组次之,HWTX-I用药组最低。其中布洛芬用药组与非用药组比较差异具有显著统计学意义(P<0.05)、HWTX-I用药组与非用药组比较差异均具有非常显著统计学意义(P<0.01),HWTX-I用药组与布洛芬用药组比较具有非常显著统计学意义(P<0.01)。具体见表1。

表1 各组大鼠iNOS软骨免疫组织化学蛋白表达分析结果(阳性单位)(mean±S)
2.3 各组大鼠血清中NO含量比较
血清中NO的含量以非用药组最高,布洛芬用药组次之,HWTX-I用药组最低。其中HWTX-I用药组、布洛芬用药组与非用药组比较差异均具有非常显著统计学意义(P<0.01),HWTX-I用药组与布洛芬用药组比较具有非常显著统计学意义 (P<0.01)。具体见表2。
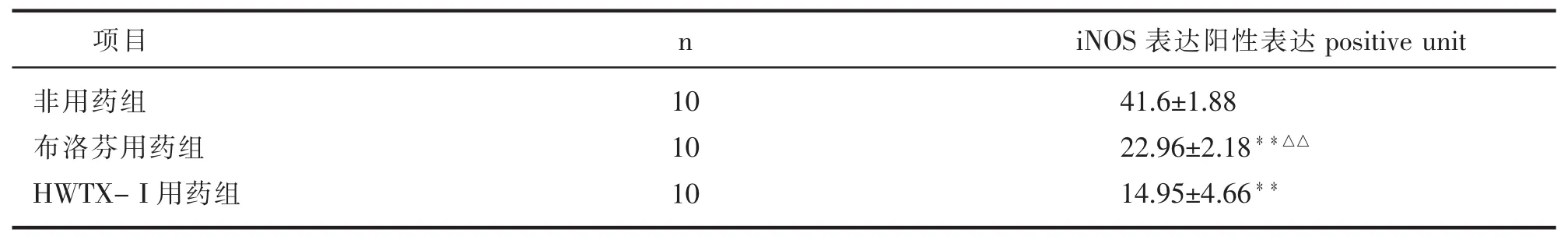
表2 各组大鼠血清NO含量(mean±S)
3 讨论
运动常导致关节损伤,运动员因长期专业体育训练,常负重的关节发生不同程度的损伤及韧带撕裂伤[8]。另外运动员在专项运动中由于技术动作完成部位相对固定,关节软骨受到长期机械磨损及其表面受到反复的轻微撞击,由于韧带的断裂使关节不稳,负荷传导紊乱可致软骨损伤退变[9]。目前全面系统探讨运动性骨关节损伤发生发展的可能分子机制鲜有报道,确定HWTX-I对急、慢性运动性骨关节损伤的抗伤害作用的有效性和可能分子机制,为运动性骨关节损伤新的临床诊断和治疗手段提供理论和实验依据尤为重要。
一个理想的运动性骨关节损伤动物模型是实验研究能否取得顺利进展的决定性因素之一,而硬脊膜外腔用药是目前临床镇痛及神经保护类药物的常用施药途径。我们采用通过切断大鼠右膝关节前后交叉韧带结合运动训练制作大鼠慢性骨关节损伤结合硬脊外腔置管术,构建了重复性好的大鼠运动性骨关节损伤模型。并应用此模型观察虎纹蜘蛛毒素(HWTX-I)的抗伤害保护作用研究。经近百例大鼠动物实验证明,这是一种能产生较为典型的运动性骨关节炎性病变,置管定位准确的大鼠运动性骨关节损伤模型。
近年来,一氧化氮作为一种关节软骨损伤和基质合成抑制介质,在骨关节损伤的发生发展过程中的作用机制越来越受到大家的重视。NO是一种生理和病理生理介质,由精氨酸中的胍基氮与分子氧经一氧化氮合酶(NOS)催化生成。NOS包括神经元型一氧化氮合酶 (nNOS)、内皮型一氧化氮合酶(eNOS)和诱导型一氧化氮合酶(iNOS)。其中eNOS和nNOS称为结构型NOS(cNOS),活性为Ca2+/钙调蛋白 (CaM)依赖性,受细胞内Ca2+浓度的调节;与cNOS相反,iNOS为Ca2+非依赖性,其激活不需要胞内Ca2+浓度升高。在骨关节炎患者的滑膜和软骨组织中发现显著表达的iNOS导致血清及关节液中NO含量增高[10]。而在动物实验中用iNOS抑制剂S-甲基异硫脲(SMT)能抑制过量NO的释放,改善软骨代谢环境,对软骨有一定的保护作用。
我们从实验中观察到,正常的SD大鼠关节软骨中没有iNOS的存在,与Amin的发现一致[11];HWTX-I用药组、布洛芬用药组与非用药组相比可明显抑制iNOS的表达,降低血清中NO含量;但HWTX-I用药组比布洛芬用药组对iNOS的表达抑制作用更为明显,血清中NO含量更低,说明HWTX-I能更好的保护骨关节软骨。布洛芬是临床上常用的一种钙离子通道拮抗剂,为非甾体类解热镇痛消炎药,布洛芬作为临床常用的消炎镇痛药,其药效强劲,但同时会引起过敏、下肢水肿、口腔疱疹、肝炎、溶血性贫血等副作用,长期服用甚至会造成肾功能衰竭[12]。HWTX-I是一种作用于突触前膜的N型钙离子通道阻断剂,经动物的多种疼痛模型证明其有明显的镇痛作用[13]。CCI大鼠脊髓和受损坐骨神经iNOS表达增加,鞘内注射N型Ca2+通道阻滞剂芋螺毒素SO3可降低CCI大鼠上述部位iNOS表达。说明N型Ca2+通道阻滞剂对降低iNOS的表达有一定作用,与本实验结果相一致。N型钙通道阻滞剂为何能抑制非Ca2+/钙调蛋白依赖性iNOS的表达呢?
研究表明,糖皮质激素、转化生长因子-β、白介素-4(IL-4)、白介素-10(IL-10)等抑制iNOS的表达。一般iNOS正常情况下是不表达的,当关节出现缺损或炎症时,各种细胞因子如白介素1β、γ-干扰素、肿瘤坏死因子-α(TNF-α)和细菌脂多糖均能增加iNOS的表达,使NO水平升高,进而升高基质胶原酶、金属蛋白酶活性,增加软骨损害。可以推测发病早期,受损裸露的软骨细胞在周围细胞因子的作用下诱发iNOS蛋白表达,从而导致NO大量释放,NO又进一步促进炎性细胞因子释放。而前期实验我们发现HWTX-I硬脊膜下腔用药可下调炎性关节炎血清中TNF-α浓度,并上调IL-4、IL-10的浓度,能对炎性关节炎病程进展起到缓解和抑制作用[4]。下调的TNF-α浓度和上调的IL-4、IL-10的浓度均可抑制iNOS的表达。提示HWTX-I不是直接调节Ca2+浓度,而是由钙通道阻滞剂其可能具有的抗炎机制起作用。其通过抑制前炎性细胞介质的释放,并避免质膜和细胞内相关酶的激活;通过抑制Ca2+内流保持细胞膜的完整性,保护组织避免损伤、发炎来降低iNOS的表达,减少关节内NO的释放量,保护骨关节软骨延缓关节进行性退变。
综上所述,HWTX-I硬脊膜下腔用药可抑制膝关节软骨iNOS的表达,降低血清中NO的含量,其效果相对于临床上常用的钙通道拮抗剂布洛芬更明显,能对关节软骨起到保护作用。本研究探讨了HWTX-I在运动性骨关节损伤中的保护作用机制,也显示出HWTX-I在运动性骨关节损伤的临床应用的潜在前景。但其对运动性骨关节损伤的抗伤害保护作用机制,尚需进一步深入研究。
[1]梁永生,李方祥.备战第28届奥运会中国优秀运动员运动损伤调查分析 [J].中国运动医学杂志,2007,11,26(6): 744-745.
[2]Minns RJ Muckle DS.The role of themeniscus in an instability model for osteoarthritis in therabbit knee[J].Br J Exp Path,1982,63:18.
[3]Peng K,Chen X.D,Liang SP,et al.The effect of Huwentoxin-I on Ca2+channels in differentiated NG108-15 cells,a patch-clamp study[J].Toxicon,2001,39(4):491-498.
[4]陈嘉勤,钟文涛,陶谷扬,等.钙通道拮抗剂对炎性关节炎大鼠行为学、血清中相关炎性因子的干预研究[J].体育科学,2008,9,(28):61-65.
[5]Hulth A,Lindberg L,Telhag H.Experimental osteoarthritis in rabbits prelin inary report[J].Acta OrthopScand,1970,41 (5):522-530.
[6]YakshTL,RudyTA.Chroniccatheterizationofthespinalsubarachnoidspace[J].PhysiolBehav,1976,17(5):1031-1036.
[7]申洪.免疫组织化学染色定量方法研究[J].中国组织化学与细胞化学杂志,1995,4(1):89-92.
[8]任玉衡.优秀运动员的运动创伤流行病学调查[J].中国运动医学杂志,2000,19(4):377-386.
[9]Myers ER,Hardingham TE,Billingham MEJ,et al.Changes in the tensile strength and compressive properties of articular cartilage in a canine model of osteoarthritis[J].Trans Orthop ResSoc,1986,11:231.
[10]Farrell AJ,Blade DR,Ralmer RM,et al.Increased concentration of nitrite synovial fluid and serum samples suggest increased nitric oxide synthesis in rheumatic disease [J].Ann Rheum Dis,1992,51:1219-1221
[11]Amin AR,DiCesar PE,Vyas P,et al.The expression and regulation of nitric oxide synthase in human osteoarthritis affected chondrocytes:evidence for up regulated neuronal nitric oxide synthase [J].J Exp Med,1995,182 (6): 2097-2102.
[12]孙福红,李成建.布洛芬不良反应[J].中国误诊学杂志, 2005,5(9):1774-1775.
[13]Chen JQ,Zhang YQ,Dai J,et al.Antinociceptive effects of intrathecally administered huwentoxin-I,a selective N-type calcium channel blocker,in the formalin test in conscious rats[J].Toxicon,2005,45(1):15-20.
