高血糖对脑出血大鼠细胞凋亡及Bax表达的影响
2010-03-15范顺太王金兰娄季宇白宏英陈江波
范顺太 李 平 王金兰 娄季宇 白宏英 陈江波
郑州大学第二附属医院 郑州 450014
脑出血(intracerebral hemorrhage,ICH)是指原发性非 外伤性脑实质内出血,占急性脑血管病的20%~30%,发病率为(60~80)人/(10万◦年),急性期病死率30%~40%。已有多项研究证实细胞凋亡是脑出血的继发性损伤机制之一。糖尿病是最严重的全球性问题之一,糖尿病能增加脑出血患者早期的死亡风险[1],同时也是其预后不良的因素[2]。本实验通过建立高血糖脑出血模型,采用免疫组化和TUNEL法研究高血糖对大鼠脑血肿周围组织神经细胞凋亡和Bax的表达的影响,为高血糖脑出血的治疗提供理论依据。
1 材料与方法
1.1 实验动物和分组 成年雄性SD大鼠96只,体质量200~250 g,由郑州大学实验动物中心提供。按照随机化原则将实验动物分为4组:假手术组、正常血糖组、高血糖组以及胰岛素干预组。每组设4个时间点:6 h、24 h、72 h、7 d,每个时间点设6只大鼠。
1.2 主要仪器及试剂 江湾Ⅱ型立体定位仪、微量进样器、显微外科手术器械、牙科钻、罗氏血糖仪(德国罗氏诊断有限公司)、兔抗大鼠Bax多克隆抗体、SP系列二抗、DBA显色液(均购北京中杉生物技术有限公司)、TUNEL试剂盒(Sigema公司);Streptozotocin(STZ)(Sigema公司);普通胰岛素,每瓶400U(10m l)(江苏万邦生化医药股份有限公司)。
1.3 高血糖模型大鼠的建立 参照STZ诱导法制备高血糖大鼠模型[1],以STZ 60mg/kg,对高血糖及胰岛素干预组大鼠单次腹腔注射,注射后1周检测血糖≥11.1 mmol/L为成功模型。
1.4 大鼠尾状核脑出血模型、高血糖模型的建立 高血糖模型[3]成功后,胰岛素干预组腹壁皮下注射普通胰岛素,3次/d,4 U/次,将血糖控制在8.3 mmol/L以下,直至实验结束。注射参照Xue等[4]的方法,大鼠用 10%的水合氯醛(300mg/kg)腹腔注射麻醉后,俯卧位固定于立体定向仪,行顶部正中切口,调整立体定向仪使大鼠前囟和后囟在同一水平面,于前囟前0.2 mm,中线向右旁开3.0 mm处进针,深度5mm,即尾状核位置。假手术组缓慢注入50μl灭菌生理盐水,其余各组缓慢注入50μl自体动脉血,动脉血采自股动脉,15 m in注射完毕,留针10 m in后缓慢缓慢退出,缝合皮肤。
1.5 标本及病理切片的制作 将各组大鼠在相应的时间点用过量的水合氯醛麻醉,迅速打开胸腔,经左心室插管,同时剪开右心耳,快速灌注灭菌生理盐水,直至由右心耳流出的液体变为清亮为止,继而灌注4%的多聚甲醛液200m l,然后断头取脑,脑组织标本浸入4%的多聚甲醛液后固定48 h,以注射点为中心取厚约1 cm的冠状切片,石蜡包埋。冠状位上连续切片,片厚4μm,分别行免疫组化和TUNEL染色。1.6 图像采集分析 光学显微镜下,DBA染色阳性细胞染色呈棕黄色,利用德国Leica显微成像系统和上海山富科学有限公司Biosens Digital Imaging System图像分析软件,计算每组大鼠血肿周围 Bax阳性细胞的平均积分光密度。TUNEL结果计算:凋亡阳性细胞的细胞核呈棕黄色,细胞出现黄至棕黄褐色颗粒。在装有目镜网格测微尺的400倍视野下随机计数血肿周围4个视野内的阳性细胞数及神经细胞,计算凋亡指数(凋亡细胞数/神经细胞×100%)。
2 结果
2.1 脑血肿周围组织Bax表达情况 假手术组、正常血糖组、高血糖组及胰岛素干预组的脑血肿周围组织均有Bax的表达,6 h开始逐渐增多,24 h达高峰,7 d仍有表达;高血糖组各时间点的表达水平均高于其他各组(P<0.01);胰岛素干预组与正常血糖组的Bax的表达差异无统计学意义(P>0.05),假手术组相应部位也有少量Bax的表达。均数间的两两比较,胰岛素干预组与正常血糖组差异无统计学意义(P>0.05),余差异均有统计学意义(P<0.01)。见表1。
表1 4组各时间点血肿周围Bax阳性细胞的平均积分光密度的变化 (±s)

表1 4组各时间点血肿周围Bax阳性细胞的平均积分光密度的变化 (±s)
注:与假手术组相比,○P<0.01;与正常血糖组相比,▲P<0.01;与高血糖组相比,●P<0.01
?
2.2 原位末端标记(TUNEL)法染色结果 在光镜下观察,细胞核中有棕黄色颗粒者为TUNEL阳性细胞,假手术组、正常血糖组、高血糖组及胰岛素干预组凋亡细胞主要分布血肿周边区,6 h开始逐渐增高,24 h达高峰,7 d仍有凋亡细胞;高血糖组各时间点的凋亡细胞数均高于其他各组(P<0.01),胰岛素干预组与正常血糖组差异无统计学意义(P>0.05),假手术组的凋亡细胞数最低;凋亡细胞数间的两两比较,胰岛素干预组与正常血糖组差异无统计学意义(P> 0.01),余差异均有统计学意义(P<0.01)。见表2。
表2 4组各时间点血肿周围神经细胞凋亡指数的变化 (±s,%)
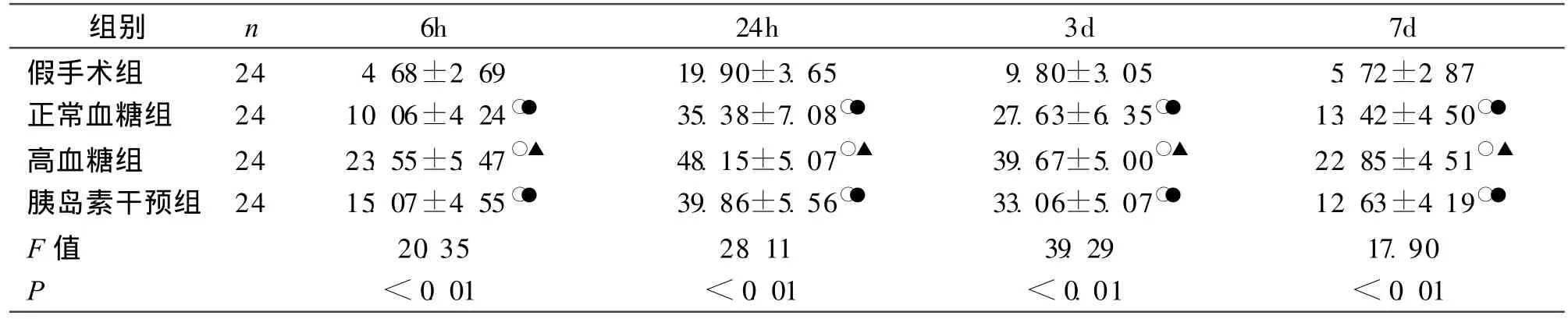
表2 4组各时间点血肿周围神经细胞凋亡指数的变化 (±s,%)
注:与假手术组相比,○P<0.01;与正常血糖组相比,▲P<0.01;与高血糖组相比,●P<0.01
?
2.3 血肿周围细胞凋亡与Bax表达的相关性 凋亡指数与同一时间点的Bax表达呈正相关(r=0.80,P<0.01)。见表3。
表3 高血糖组各时间点Bax的表达与凋亡指数 (±s)

表3 高血糖组各时间点Bax的表达与凋亡指数 (±s)
注:凋亡指数与同一时间点的Bax表达呈正相关,r=0.80,P<0.01
?
3 讨论
凋亡是由体内外因素触发细胞内预存的死亡程序而导致的细胞死亡过程,也称为程序性细胞死亡(p rogrammed cell death)的表现形式,在组织的正常发育、细胞的正常更新、细胞介导的免疫反应、病理紊乱以及肿瘤退化中起重要作用[5]。W ang等[6]发现糖尿病会促使大脑局部缺血现象的恶化,引发神经细胞的大量凋亡。业已证实凋亡可能参与了大鼠血肿周围脑组织损伤的病理生理过程[7-8]。高血糖存在导致大鼠血肿周围脑组织神经细胞凋亡增加的可能。
Bax是Bcl-2家族中最具促凋亡特征的基因,基因产物蛋白由192个氨基酸组成,分子量为21 U,基因长4.5 kb[9]。Bax分布于线粒体外膜上,与线粒体内外膜之间的通透性转换孔(PTP,本质是一种蛋白复合物)结合,导致膜去极化引起跨膜电位的改变。正常情况下,绝大多数PTP处于关闭状态。当线粒体跨膜电位降低时,PTP开放,导致线粒体膜通透性增大,使细胞凋亡的启动因子,如细胞色素C、凋亡蛋白酶激活因子(Apaf)和凋亡诱导因子(AIF)等从线粒体内释放出来。细胞色素C与Apaf相互作用可激活caspase-9,而AIF可快速激活核酸内切酶,并增强caspase-3的水解活性[10]。
本研究结果表明,在高血糖组大鼠血肿周围脑组织中6 h已有Bax表达,随之逐渐升高,24 h达高峰,继而开始下降,7 d时仍有表达,各时间点与其他各组比较均有显著差异。胰岛素干预组与正常血糖组的Bax的表达无明显差别。用TUNEL法染色研究发现,高血糖组大鼠血肿周围脑组织6 h已存在凋亡细胞,随之逐渐增多,24 h达高峰。胰岛素干预组与正常血糖组的细胞凋亡无明显差别。高血糖组与同一时间点Bax的表达具有相关性。以上结果表明了高血糖能增加大鼠脑血肿周围组织神经细胞凋亡和Bax的表达。其机制可能是高血糖使乳酸生成增多而直接导致脑损伤,同时使ATP生成减少,引起细胞能量耗竭;高血糖时可以产生大量的兴奋性氨基酸、羟自由基、糖化血红蛋白而导致脑损伤;高血糖时可以破坏血脑屏障而加重脑水肿;高血糖可以增强NO的毒性作用,促进亚硝酸盐的形成,加重神经元损伤;高血糖可以造成低钙血症和低镁血症,进而干扰线粒体磷酸化过程,加重脑水肿。胰岛素干预组各时间点的凋亡细胞指数和Bax表达均与正常血糖组无明显差别,提示合理控制血糖水平能减少Bax的表达和抑制脑细胞凋亡的发生。
综上所述,高血糖能增加大鼠脑血肿周围组织神经细胞凋亡和Bax的表达,通过合理控制血糖水平能减少Bax的表达和抑制脑细胞凋亡的发生,减轻脑出血的继发性病理损害,从而为高血糖脑出血患者的治疗探索道路。
[1] Kimura K,IguchiY,Inoue T,et al.Hyperglycem ia independently increases the risk of early death in acute spontaneous intracereb ral hemo rrhage[J].J Neurol Sci,2007,263(1/2): 228-229.
[2] Passero S,Ciacci G,U livelli M.The influence of diabetes and hypergly cem ia on clinical courseafter intracerebralhemorrhage [J].Neurology,2003,61(10):1 351-1 356.
[3] 李聪然,游雪甫,蒋建东.糖尿病动物模型及研究进展[J].中国比较医学杂志,2005,15:59-63.
[4] Xue Mengzhou,Mare R,Del Bigio.Intracerebral injection of autologousw holeb lood in rats:time courseof inflammation and death[J].Neu roscience Letters,2000,283(3):230-232.
[5] K roemer G,Galluzzi L,B renner C.M itochondrialmembrane permeabilization in cell death[J].Physiol Rev,2007,87(1): 99.
[6] Bederson JB,Pitts LH,TsujiM,et al.Ratm iddle cereb ral artery occusion:evaluation of the model and developmen t of a neu rologic exam ination[J].Stroke,1986,17(3):472-476.
[7] 李建设,白宏英,王金兰.大鼠脑出血后Bax表达与神经细胞凋亡的关系及氟桂利嗪的干预作用[J].中国实用神经疾病杂志,2009,12(3):35-38.
[8] Delgado P,Cuad rado E,RosellA,et al.Fas system activation in perihematom al areas after spontaneous in tracereb ral hem orrhage[J].Stroke,2008,39(6):1730-1734.
[9] O ltvai ZN,M Illiaman CL,Korsm cyer SJ.Bcl-2 heterodimerizes in vivo w ith a conserved homolog,Bax,thataccelerates cell death[J].Cell,1993,74(4):609-619.
[10] 金惠铭主编.病理生理学[M].北京:人民卫生出版社,2004: 137.
