多发性脑梗死性痴呆模型的建立及评价
2010-03-10应凤博薛景凤高燕军米艳娟杨广成赵晓丽陈志宏
应凤博 薛景凤 高燕军 米艳娟 杨广成 赵晓丽 陈志宏
多发性脑梗死性痴呆模型的建立及评价
应凤博 薛景凤 高燕军 米艳娟 杨广成 赵晓丽 陈志宏
目的 建立一种有机微血栓所导致的多发性脑梗死性痴呆动物模型,模拟临床上多发性脑梗死性痴呆病的发生。方法 于左侧颈外动脉逆行插管至左侧颈总动脉的分叉处后,注入有机微血栓,造成多发性脑梗死动物模型。采用 Morris水迷宫的方法观察多发性脑梗死性痴呆大鼠行为学变化,应用光镜观察多发性脑梗死性痴呆大鼠海马的形态学改变。结果 (1)行为学测试:模型组的学习成绩较正常对照组和假手术组明显下降。(2)形态学观察结果:HE染色:模型组左侧脑组织多部位可见局部缺血性气沉沉改变,神经细胞胞体不同程度缩小,胞浆尼氏体减少或消失,核固缩,核碎裂,核溶解。Nissl染色:模型组实验侧海马 CA 1、CA 2、CA 3、垂直部、齿状回等梗死区可见细胞排列稀疏,有明显的细胞脱失,大量的胶质细胞增生,核固缩,胞浆内尼氏体溶解,甚至消失。正常对照组和假手术组及模型组正常对照侧无上述病理改变。结论 本模型是进行多发性脑梗死性痴呆基础研究和临床研究的理想动物模型。
多发性脑梗死性痴呆;动物模型;大鼠;海马;行为学测试
自 20世纪 70年代以来,陆续出现的大鼠脑缺血模型有几十种,这些方法均有不足之处,在病理表现上均与多发性脑梗死性痴呆有一定差异。本实验参照Kaneko等[1-3]猪脑栓塞动物模型的建立及评价并加以改进,利用正常人血浆纤维蛋白,创造一种有机微血栓,进而建立一种有机微血栓所导致的多发性脑梗死性痴呆动物模型。
1 材料与方法
1.1 动物与分组 Wistar成年大鼠 60只,10月龄,体重 250~350g,雌雄不限。将 60只大鼠随机分为正常对照组、假手术组和模型组,每组 20只,模型组实验过程中死亡 5例。
1.2 药物与试剂 凝血酶,规格 500 U;0.9%氯化钠溶液;水合氯醛;多聚甲醛;磷酸氢二钠;磷酸二氢钠;焦油紫;苏木精;伊红等。
1.3 实验仪器 Morris水迷宫,由中国医学科学院药物研究所制;超声波细胞粉碎机;高频电刀;振荡切片机;Olympus光学显微镜等。
1.4 实验方法
1.4.1 有机微血栓的制备:取正常人血浆(含血小板)1ml迅速加入凝血酶500U,凝固后置于 0.9%氯化钠溶液中反复漂洗,用超声波细胞粉碎机将其打碎,使栓子直径多在 20~40μm,再用0.9%氯化钠溶液将其配成 10mg/ml的栓子混悬液。
1.4.2 模型组:大鼠术前禁食 12 h,禁水 4 h。选择大鼠左侧为实验侧。用 10%水合氯醛(35mg/100 g)腹腔内注射麻醉,仰卧固定,颈前部去毛,常规碘酒酒精消毒后,颈正中切开皮肤,剥离胸骨舌骨肌、肩胛舌骨肌与胸锁乳突肌,充分暴露并分离左侧颈总动脉(CCA)、颈外动脉(ECA)及其枕动脉、甲状腺上动脉、颈内动脉(ICA)及其翼腭动脉(PPA),将枕动脉、甲状腺上动脉用高频电刀电凝并剪断。在分离过程中避免损伤迷走神经及减压神经,暂时夹闭颈CCA、PPA,于颈外动脉逆行插管(在插管过程中,注意不要损伤血管内膜,避免局部血栓形成)至颈 CCA的分叉处后,注入含有有机微血栓的混悬液0.5m l,推注同时开放夹闭的颈 CCA,并在不少于 30 s的时间内缓慢注入,使栓子通过 ICA进入颅内至大脑各动脉,造成多发性脑梗死,然后开放夹闭的 PPA,在颈外动脉刺破的伤口处结扎,逐层缝合颈部切口,腹腔内注射 0.2万 U青霉素以预防感染。手术整个过程中必须保证无菌。术中大鼠肛温保持在36.5~37.5℃,以防止低温对脑缺血损伤的保护作用。手术后将大鼠送至有通风和空调设备的动物房正常喂养。正常对照组:不给予任何处理。假手术组:手术方法同模型组,注入颈内动脉的是 0.9%氯化钠溶液 0.5m l。
1.4.3 行为学测试:假手术组和模型组术后第 8天与正常对照组开始采用 Morris水迷宫实验测试大鼠的空间学习记忆能力。Morris水迷宫中加入奶粉 1 000 g,用水加至高过安全平台1 cm。在池壁上标上东南西北 4个入水点,将圆形水池平均分为西南(SW)、西北(NW)、东南(SE)及东北(NE)象限,将安全平台放置在 NE象限离箱壁 20 cm处。①定位航行实验:实验历时 7 d,每天上、下午 2个时段,每个时段训练 2次。每只大鼠在训练前放于安全平台2m in以熟悉迷宫环境。每次训练随机选择一个入水点将大鼠面向池壁放入水池,同一次训练所有大鼠入水点相同。记录大鼠找到安全平台的时间,即逃逸潜伏期。至 90s找不到安全平台,即将其引上安全平台,逃逸潜伏期记为 90s。每天 4次逃逸潜伏期的算术平均值作为这一天的学习成绩。②空间探索实验:训练完毕当天下午进行空间探索实验,撤除安全平台,记录大鼠 90 s内穿过原安全平台位置的次数和在原安全平台所在象限(NE象限)探索时间占总时间(90s)的百分比。③多发性脑梗死性痴呆大鼠的判定:取正常对照组和模型组训练第 7天的学习成绩,以正常对照组游到安全平台平均时间的 95%上限值为标准,将超出上限值的缺血大鼠确定为多发性脑梗死性痴呆大鼠。经分析,如大鼠逃逸潜伏期超过 4.60 s即为痴呆。
1.4.4 形态学观察:组织切片的制备:在 10%的水合氯醛(350mg/kg)麻醉下,打开胸腔,升主动脉插管,温 0.9%氯化钠溶液 100ml快速冲洗血管,继之用 4%多聚甲醛 -0.1mol/L磷酸缓冲液灌流固定,开颅取脑,将脑组织浸入 4%多聚甲醛-0.1mol/L磷酸缓冲液内固定。取视交叉至脚间窝之间的一段脑组织(海马所在部位),应用 LEICA VT 1000S型振荡切片机作连续冠状切片,裱片并烘干,然后进行尼氏(Nissl)染色和HE染色,分色,梯度乙醇脱水,二甲苯透明,中性树胶封片。光镜下观察海马细胞构筑的形态学变化。
2 结果
2.1 行为学检查结果 模型组的学习成绩较正常对照组和假手术组明显下降。在空间探索实验中,正常对照组和假手术组大鼠在 90 s内穿过原平台位置的次数和在原安全平台象限即NE象限探索时间占总时间(90 s)的百分比差异无统计学意义(P>0.05),而模型组与正常对照组和假手术组差异均有统计学意义(P<0.01)。见表 1。定位航行实验中所有大鼠逃逸潜伏期均随训练天数增加而下降,3组大鼠均随训练天数的增加而学习记忆成绩增加,但模型组每天的学习记忆成绩明显慢于正常对照组和假手术组(图1)。空间探索轨迹中可以更直观的看到正常对照组在原安全平台所在象限即NE象限探索时间长,路程长,穿过原平台位置的次数多,而模型组痴呆大鼠在原安全平台所在象限即NE象限探索时间短,路程短,穿过原平台位置的次数少(图2、3)。模型组 15只大鼠中有 13只痴呆,痴呆率为 86.67%。
表1 3组大鼠 90 s内穿过原安全平台位置的次数和在原安全平台所在象限(NE象限)探索时间占总时间(90 s)的百分比比较±s

表1 3组大鼠 90 s内穿过原安全平台位置的次数和在原安全平台所在象限(NE象限)探索时间占总时间(90 s)的百分比比较±s
注:与模型组比较,*P<0.05
组别 次数 百分比(%)正常对照组(n=20) 7.6±1.5* 50±5*假手术组(n=20) 7.4±2.3* 50±8*模型组(n=15) 3.2±1.7 29±6
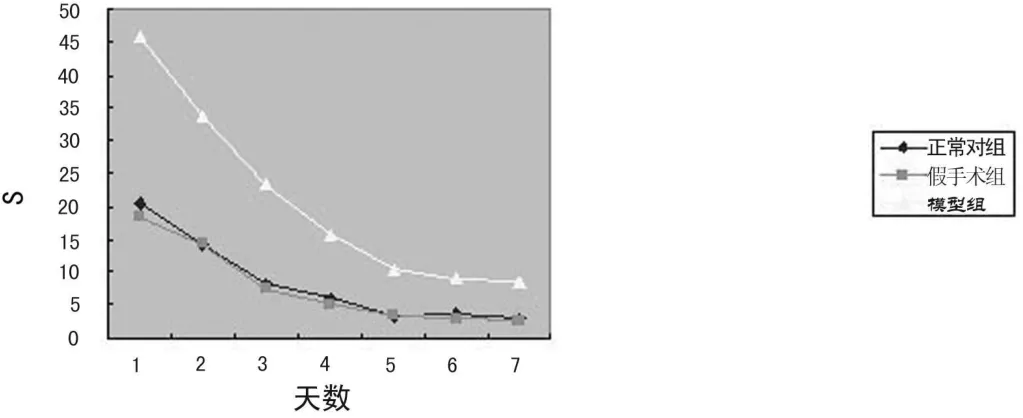
图1 7d内逃逸潜伏期变化
2.2 形态学观察结果
2.2.1 HE染色:模型组梗死率达 100%,模型组实验侧脑组织多部位均可见点片状局部缺血性改变,神经细胞胞体不同程度缩小,核固缩,核碎裂,核溶解,可见失去正常结构的红色神经元和格子细胞(图2)。正常对照组和假手术组及模型组正常对照侧无上述病理改变。
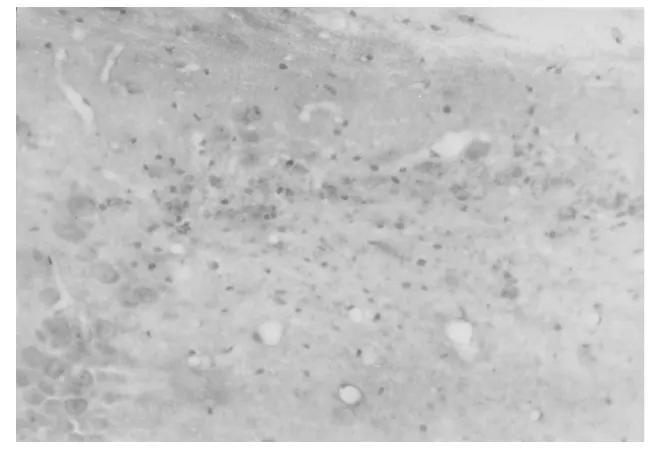
图2 模型组大鼠试验侧海马CA 2形态改变(HE×200)

图3 正常对照组大鼠海马形态(Nissl×40)
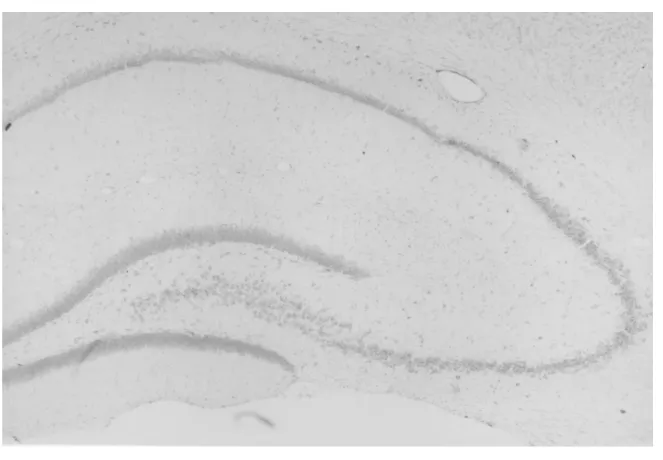
图4 假手术组大鼠海马形态(Nissl×40)

图5 模型组大鼠正常对照侧海马形态(Nissl×40)

图6 模型组大鼠试验侧海马 CA 2和CA 3形态改变(Nissl×40)

图7 模型组大鼠试验侧海马 CA 2形态改变(Nissl×100)
2.2.2 Nissl染色:低倍镜下,正常对照组和假手术组及模型组正常对照侧海马各层细胞排列紧密,层次分明,细胞核及尼氏体均无任何改变(图3~5)。模型组实验侧海马 CA 1、CA 2、CA3、垂直部、齿状回梗死区可见细胞排列稀疏,有明显的细胞脱失,大量的胶质细胞增生(图6)。在观察海马的形态学变化时还发现有的痴呆大鼠在海马的不同区同时出现细胞排列稀疏,有明显细胞脱失,大量的胶质细胞增生。高倍镜下,正常对照组和假手术组及模型组正常对照侧各层细胞核膜完整,尼氏体清晰可见,细胞排列紧密,模型组海马 CA 1、CA 2、CA3、垂直部、齿状回梗死区形态正常的细胞数明显减少,许多细胞结构变的不完整,大量的胶质细胞增生。在梗死灶附近可见周围细胞有明显改变,胞浆内尼氏体减少,甚至消失,核溶解(图7)。从实验结果看出,所切片观察的 10只痴呆大鼠在海马上有 8只出现上述病理改变,出现率为 80%。正常对照组和假手术组及模型组正常对照侧无上述病理改变。
文献报道的血栓多为人或动物全血凝固后形成的“红色血栓”,实为凝血块,其主要成分为红细胞、血小板,纤维蛋白含量较少,松软易碎,在体内易自溶,栓塞血管可自然再通[4]。本模型所用血栓克服了上述缺点,它是由含血小板的健康人血浆凝固而成的“白色血栓”,更接近于人类血栓栓子的成分,其主要成分为纤维蛋白,含少量血小板,柔软而且有韧性,不易早期自溶。而且所用栓子直径多控制在 20~40μm,大小不一,用0.9%氯化钠溶液将其配成的栓子混悬液浓度为 10mg/m l。实验结果发现,大鼠无肢体运动障碍,可能是由于所用栓子微小,梗死多为微小动脉,栓子混悬液浓度适合的原因,达到了本实验的预期结果。
3 讨论
我们认为:实验动物的血管粗细与体重密切相关,其体重越大,血管越粗,手术越容易成功,其体重越小,血管越细,操作难度越大。但是体重的差别并不影响我们的实验结果,原因主要是我们所用的是有机微血栓,而且所有大鼠的微小血管的直径基本上是一样的,并无太大的差别。
Morris水迷宫发现,造模组大鼠出现了明显的学习记忆功能障碍。形态学观察大多痴呆模型大鼠可见在海马不同区域有不同程度的细胞脱失,红色神经元和格子细胞,大量的胶质细胞增生等,这些形态学变化印证了行为学的结果。少数痴呆模型大鼠在海马未发现异常,但在额叶皮质、顶叶皮质深层、背侧丘脑、尾状核、壳核、内囊、胼胝体、齿状回等部位发现栓子,且栓塞的血管不固定,在梗死灶附近可见周围细胞明显改变,这些变化说明痴呆与海马之外的其他脑组织结构有关,也与梗死灶的多少有关。有研究结果表明,海马是大鼠参与空间认知功能的主要结构,但并非唯一的空间认知结构,同时其他一些脑结构亦对空间认知功能产生影响。
从实验结果看出,80%痴呆大鼠在海马上出现上述病理改变。这就进一步说明了海马是学习记忆的主要结构,也说明了海马动脉及其细小分支非常容易栓塞。
实验结果尚显示:从组间任一时点的横向比较上看,模型组学习记忆成绩比正常对照组和假手术组差;从自身不同时点的纵向比较上看,模型组随着学习记忆的次数增多而成绩有所好转,从而提示反复的练习可在一定程度上提高痴呆大鼠学习记忆的能力。有人认为脑缺血大鼠引起的空间认知功能障碍较为短暂,可能是大鼠单侧脑梗死,正常侧可部分代偿[5]。模型组记忆能力比正常对照组和假手术组差,而肌力(游泳能力)测试与正常对照组和假手术组无差异,表明其逃逸潜伏期延长并非由于肌力不足所致。行为学测试和形态学观察的实验结果表明,本模型与多发性脑梗塞性痴呆的临床症状及病理改变有极强的相似性,是进行多发性脑梗死性痴呆基础研究和临床研究的理想模型。
1 KanekoD,NakamuraN,Ogawa T.Cerebral infarction in ratsusing homologous blood emboli:Development of a new experimental model.Stroke,1985,16:76-84.
2 陈俊抛,田时雨,于微微,等.多发性脑梗塞痴呆动物模型的研究.中华神经精神科杂志,1994,27:311-312.
3 陈衔城,秦智勇,张福林.猪脑栓塞动物模型的建立及评价.中国临床神经科学,1998,6:6-8.
4 Overgaard K.A ratmodel of reproducible cerebral infarction using thrombotic blood c lot emboli.JCereb Blood Flow Metab,1992,12:484.
5 Lyden PD,Zivin JA,Chabolla DR,etal.Quantitative effectsofcerebral infarction on spatial learning in the rats.Exp Neurol,1992,116:122-132.
R 471
A
1002-7386(2010)06-0675-04
067000 河北省承德市,承德医学院附属医院神经内科(应凤博、高燕军、米艳娟、赵晓丽),小儿外科(杨广成);承德医学院解剖教研室(薛景凤、陈志宏);
2010-02-01)
