SUR1基因多态性与格列齐特降糖疗效的相关性分析
2010-03-08徐嘉宜杨志宏于德民孙丽荣
徐嘉宜,杨志宏,于德民,孙丽荣
(1.天津医科大学代谢病医院痛风科,卫生部及天津市激素与发育重点实验室,天津 300070;
2.秦皇岛市第一医院)
磺脲类(SUs)药物是口服降糖药中较为重要的一类,其主要作用是通过与磺脲类受体1(SUR1)结合产生一系列反应而达到降糖效果。研究表明,SUR1基因多态性与2型糖尿病(T2DM)相关[1-2],但关于SUR1基因多态性与SUs药物疗效的研究报道较少。本文旨在研究SUR1基因外显子16-3c/t和33T/G(S1369A)的多态性对T2DM患者应用SUs降糖药格列齐特疗效的影响。
1 资料与方法
1.1 资料 2004年3月~2005年3月就诊于天津医科大学代谢病医院门诊的无亲缘关系的天津籍汉族T2DM患者160例,年龄30~65岁。所有患者均符合1999年WHO的DM诊断标准,同时满足以下条件:(1)确诊DM<5年,近2个月任何降糖药物治疗时间累计<1周且最近1周无任何降糖药治疗史;(2)空腹血浆血糖(FPG)7.8~15.0mmol/L;(3)体重指数(BMI)<28kg/m2;(4)无DM急慢性并发症;(5)肝脏疾病患者(肝功异常或肝硬化)转氨酶<正常高限1.5倍,在高限和高限1.5倍之间的患者,需除外病毒性肝炎和酒精性肝炎,考虑是脂肪肝的可以入选;(6)无明显的心、脑、肺、肾等脏器疾病史。
1.2 方法
1.2.1 临床治疗流程 患者自愿参加本研究,填写知情同意书后,进行8周的临床试验。试验第1天,所有患者隔夜空腹取静脉血测FPG、糖化血红蛋白(HbA1c)和胰岛素等项目并提取DNA基因,测服75g葡萄糖后血糖和胰岛素。同时记录流行病学、人口学资料,给与格列齐特片40mg,每日2次。试验第15、29及43天测FPG,如≥7.0mmol/L者,每次增加药量40mg,最大剂量为120mg,每日2次,并进行随访问卷调查及发放下2周的药物。试验第57天,空腹取静脉血测定FPG、HbA1c、胰岛素及服糖后血糖和胰岛素等生化值,随访问卷调查。
1.2.2 药品与仪器 格列齐特片Ⅱ(商品名:达美康),剂型:80mg/片,法国施维雅药厂与天津华津制药厂合作生产,由北京华安佛药物研究所免费提供。
9700PCR System(美国Perkin-Elmer公司);低温离心设备(美国Beckman公司);分光光度计(美国Mocular Devices公司);全自动生化分析仪(日本HITACHI公司7070型);糖化血红蛋白分析仪(美国BIO-RAD公司VARIANTⅡ型);手提式压力蒸汽消毒器(宁波医疗器械厂YXQ-SG-41-280型)。
1.2.3 基因型检测 用盐沉淀法提取外周血DNA。将目的基因体外扩增后,用7900荧光定量PCR仪检测PCR产物的荧光强度变化,选用“Allelic Discrimination”程序,进行扫描与结果的判断。
1.2.4 疗效评价指标 早期胰岛素分泌功能指数(△I30/△G30)=(I30-I0)/(G30-G0);胰岛素抵抗指数(HOMA-IR)=I0×G0/22.5;胰岛β细胞功能指数(HOMA-β)=20×I0/(G0-3.5);FPG下降率=治疗前后FPG下降度/治疗前FPG;服糖2h后静脉血糖(P2PG)下降率=治疗前后P2PG下降度/治疗前P2PG;HbA1c下降率=治疗前后HbA1c下降度/治疗前HbA1c;△I30/△G30上升率=治疗前后△I30/△G30增加度/治疗前△I30/△G30;HOMA-IR下降率=治疗前后HOMA-IR下降度/治疗前HOMA-IR;HOMA-β上升率=治疗前后HOMA-β增加度/治疗前HOMA-β。
1.3 统计学方法 用SPSS10.0软件分析数据,其中涉及以平衡法检验各组基因频率的群体代表性、t检验、χ2检验、单因素方差分析等,P<0.05为有显著性差异。△I30/△G30、HOMA-IR、HOMA-β取自然对数后用±s表示,余资料用±s表示。
2 结果
2.1 格列齐特治疗前后疗效评价指标比较 所有基因型患者在治疗前后HbA1C、FPG、P2PG、△I30/△G30、HOMA-β、HOMA-IR均存在统计学差异(P<0.001),见表1。
表1 治疗前后各项指标比较(±s)
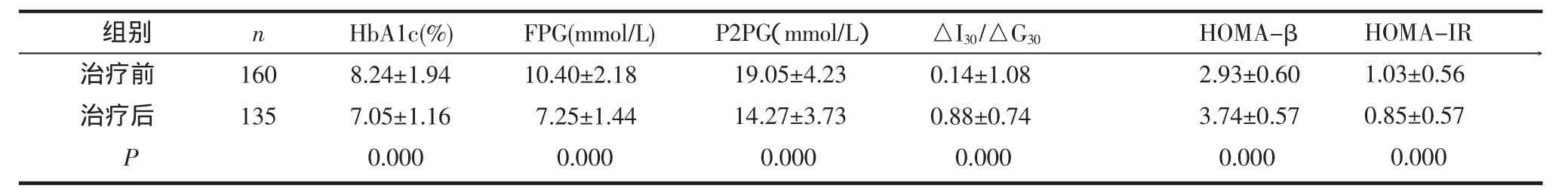
表1 治疗前后各项指标比较(±s)
HOMA-IR、HOMA-β、△I30/△G30取自然对数后的±s
组别治疗前治疗后P n 160135HbA1c(%) 8.24±1.947.05±1.160.000FPG(mmol/L) 10.40±2.187.25±1.440.000P2PG(mmol/L)19.05±4.2314.27±3.730.000△I30/△G30 0.14±1.080.88±0.740.000HOMA-β 2.93±0.603.74±0.570.000HOMA-IR 1.03±0.560.85±0.570.000
2.2 基因多态性对格列齐特疗效的影响 表2示外显子16-3c/t“cc”基因型患者42例(占31.11%),“tc”型68例(占50.37%),“tt”型25例(占18.52%),格列奇特治疗后3种基因型间FPG、P2PG、HbA1c、HOMA-IR下降率及△I30/△G30、HOMA-β上升率均无统计学差异(P>0.05)。表3示外显子 33T/G(S1369A)“TT”基因型患者45例(占33.33%),“TG”型65例(占48.15%),“GG”型25例(占18.52%),“GG”基因型者FPG、P2PG、HbA1c的下降率最高,“TG”次之,“TT”最低,但未达统计学意义(P>0.05);△I30/△G30、HOMA-β上升率及HOMA-IR下降率在3种基因型间亦未见统计学差异(P>0.05)。
表2 外显子16-3c/t各基因型治疗后生化指标变化率比较(±s)
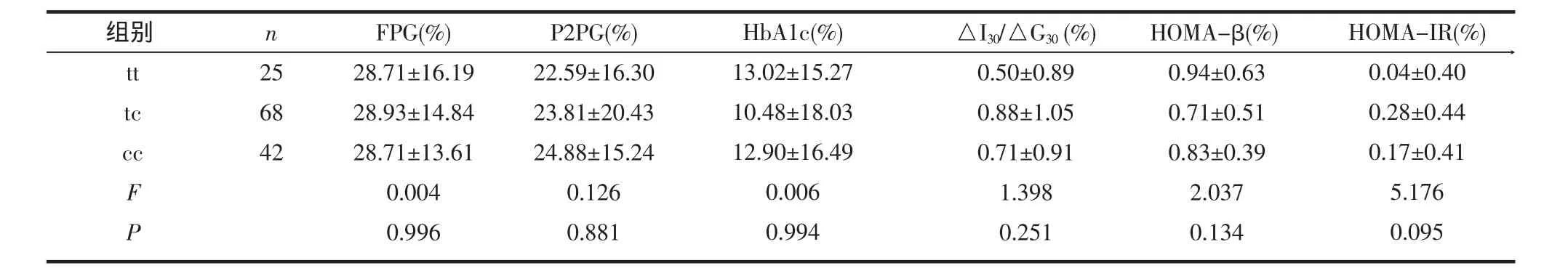
表2 外显子16-3c/t各基因型治疗后生化指标变化率比较(±s)
HOMA-IR、HOMA-β、△I30/△G30的变化率取自然对数后的±s
组别tt tc cc F P n 256842FPG(%) 28.71±16.1928.93±14.8428.71±13.610.0040.996P2PG(%) 22.59±16.3023.81±20.4324.88±15.240.1260.881HbA1c(%) 13.02±15.2710.48±18.0312.90±16.490.0060.994△I30/△G30(%) 0.50±0.890.88±1.050.71±0.911.3980.251HOMA-β(%) 0.94±0.630.71±0.510.83±0.392.0370.134HOMA-IR(%) 0.04±0.400.28±0.440.17±0.415.1760.095
表3 外显子33T/G(S1369A)各基因型治疗后生化指标变化率比较(±s)
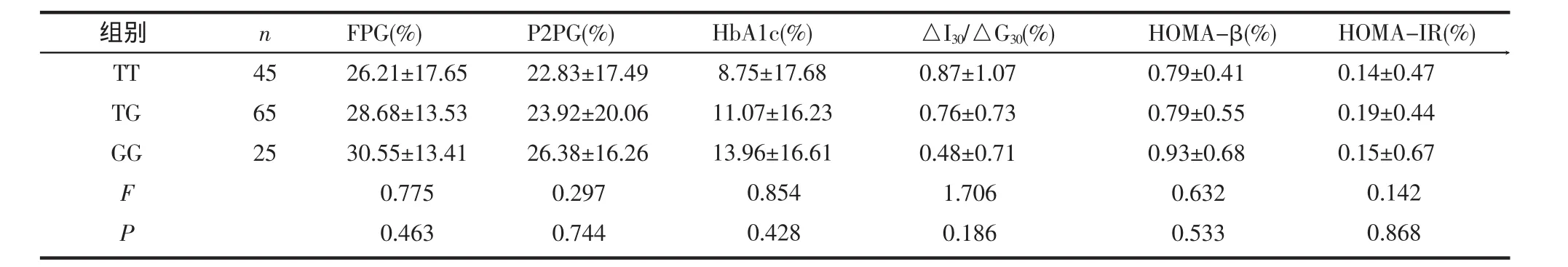
表3 外显子33T/G(S1369A)各基因型治疗后生化指标变化率比较(±s)
HOMA-IR、HOMA-β、△I30/△G30的变化率取自然对数后的±s
组别TT TG GG F P n 456525FPG(%) 26.21±17.6528.68±13.5330.55±13.410.7750.463P2PG(%) 22.83±17.4923.92±20.0626.38±16.260.2970.744HbA1c(%) 8.75±17.6811.07±16.2313.96±16.610.8540.428△I30/△G30(%) 0.87±1.070.76±0.730.48±0.711.7060.186HOMA-β(%) 0.79±0.410.79±0.550.93±0.680.6320.533HOMA-IR(%) 0.14±0.470.19±0.440.15±0.670.1420.868
3 讨论
SUR1基因位于11号染色体短臂上的15.1亚区,主要编码分布于胰岛β细胞膜的磺脲类受体[3]。SUs药物的作用机制是通过与其受体——ATP敏感性钾通道(KATP)上的SURl亚单位结合,引起内向整流钾通道(Kir6.2)亚单位关闭,使细胞去极化,激活电压依赖性Ca2+通道,Ca2+内流,使胰岛素释放而起到降糖作用[4]。本研究结果显示:所有基因型患者在经过格列齐特治疗后,FPG、P2PG、HbA1c显著下降,表明格列齐特对该人群的降糖作用明显;△I30/△G30和HOMA-β值较前明显升高,HOMA-IR值明显下降,表明治疗后患者的早期胰岛素分泌、胰岛β细胞功能及胰岛素抵抗均得到明显的改善。可能主要与格列齐特降低了糖毒性对胰岛β细胞的抑制、改善了早期胰岛素的分泌及其胰外降糖作用有关,这与格列齐特的药理作用相一致。
SUR1基因的变异可能会引起蛋白质结构改变或表达异常,从而改变KATP的活性,影响SUs的降糖疗效[5]。本研究探讨了两个常见多态性——外显子16-3c/t和33T/G(S1369A)对SUs作用的影响。本组病人中外显子16-3c/t基因中“t”等位基因发生频率为56.30%,“c”等位基因发生频率为43.70%,外显子33T/G(S1369A)的“G”等位基因发生频率为42.59%,“T”等位基因发生频率为57.41%。本结果与白种人[6-7]及不同地域黄种人[8-9]T2DM患者的基因位点变异频率不同,可能与人群的选择及种族差异等因素有关。
关于SUR1基因外显子16-3c/t的多态性与SUs药物疗效相关性的报道较多。Hansen等[6]对健康年轻成年人中具有双杂合子(外显子18C/T和16-3c/t)变异者静脉给予甲苯磺丁脲,其第一时相胰岛素、C肽水平分别下降40%、50%,提示外显子18C/T和16-3c/t变异时,可能会影响SUs药物刺激胰岛β细胞分泌胰岛素。在T2DM患者中,关于16-3c/t多态性是否影响SUs降糖疗效的研究结果不一,陈莉丽[5]和纪立农等[8]得出了阳性结果,但大部分人群中没有观察到阳性结果。本研究中外显子16-3c/t基因位点的多态性与格列奇特降糖疗效分析结果表明,3个基因型之间其降糖疗效未见明显差异。原因可能为16-3c/t突变为内含子突变,突变位于内含子-外显子接头上,距离第16外显子只有2个碱基,该位置可能会对mRNA的剪接和加工产生影响,但不一定直接导致SUR1蛋白结构的异常[5]。本试验结果推测SUR1的外显子16-3c/t基因可能并非影响SUs降糖疗效的易感基因,由于SUR1基因与真正易感基因连锁的不均一性,导致不同人群有不同结果;也可能与出现假阴性结果有关。因此对外显子16-3c/t基因多态性是否影响SUR1的功能需进一步证实。
最新报道显示在中国1268名T2DM患者中33T/G(S1369A)的多态性与格列齐特的降糖效应相关[10]。本组病人中外显子33T/G(S1369A)的“GG”型组格列奇特治疗后降糖率最高,其次为“TG”型组,“TT”型组最低,这表明该基因突变纯合型患者较杂合型及野生纯合型患者相比有更强的降糖效果。尽管本试验各组间差异未达到统计学意义,但FPG、P2PG、HbA1c的下降率有变化趋势,如果加大样本量、延长观察时间可能会出现阳性结果。本试验推测外显子33T/G(S1369A)基因突变可能使SUR1的结构或功能发生改变,促使胰岛素的分泌增加,也可能使SUs降糖药物与KATP通道结合力或所引发的降糖反应加强,对T2DM的降糖治疗有较好的作用,但其确切的机制目前仍不清楚。外显子33T/G(S1369A)基因突变引起SUR1结构及功能改变的研究报道较少,有待于进一步研究。
综上所述,天津地区T2DM患者SUR1基因的外显子16-3c/t和33T/G(S1369A)基因多态性可能不会改变SUs药物的疗效,但不能排除SUR1基因的其他多态位点对格列奇特降糖疗效的影响。本试验仅为T2DM的SUs药物基因组学研究的初探,我们期待更大型、更全面的临床研究来证实其相关性,从而为T2DM患者的高度个体化用药提供线索。
[1] 王劲松,周玲,成金罗,等.磺酰脲类受体基因多态性与2型糖尿病的相关性研究[J].遗传,2004,26(1):8
[2] Rissanen J,Markkanen A,Karkkainen P,et al.Sulfonylurea receptor 1gene variants are associated with gestational diabetes and type 2diabetes but not with altered secretion of insulin [J].Diabetes Care,2000,23(3):70
[3] Inagaki N,Gonoi T,Clement JP,et al.Reconstitution of IKATP:an inward rectifier subunit plus the sulfonylurea receptor[J].Science, 1995,270(5239):1166
[4] Ashcroft FM.ATP-sensitive potassium channelopathies:focus on insulin secretion[J].J Clin Invest,2005,115(8):2047
[5] 陈莉丽,李强,邢厚恂,等.磺脲类受体1基因多态性对磺脲类降糖药物作用的影响[J].第二军医大学学报,2007,28(7):765
[6] Hansen T,Echwald SM,Hansen L,et al.Decreased tolbutamide stimulated insulin secretion in healty subjects with sequence variants in the high-affinity sulfonylurea receptor gene [J].Diabetes, 1998,47(3):598
[7] Hani EH,Clement K,Velho G,et al.Genetic studies of the sulfonylurea receptor gene locus in NIDDM and in morbid obesity among French Caucasians[J].Diabetes,1997,46(4):688
[8] 纪立农,韩学尧,王虹,等.磺脲类受体基因多态性与非胰岛素依赖型糖尿病的相关性[J].中华医学杂志,1998,78(10):774
[9] Ohta Y,Tanizawa Y,Inoue H,et al.Identification and functional analysis of sulfonylurea receptor 1variants in Japanese patients with NIDDM[J].Diabetes,1998,47(3):476
[10]Feng Y,Mao G,Ren Y,et al.Ser1369Ala variant in sulfonylurea receptor gene ABCC8is associated with antidiabetic efficacy of gliclazide in Chinese type 2diabetic patients[J].Diabetes Care,2008, 31(10):95
