pH及离子强度对渗滤液水溶性有机物同步荧光光谱的影响
2010-03-07耿春茂席北斗李鸣晓何小松魏自民
耿春茂,席北斗,赵 越,李鸣晓,何小松,魏自民*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.中国环境科学研究院水环境系统工程研究室,北京 100012)
目前,生活垃圾的处理方式主要有卫生填埋、焚烧和堆肥等[1]。由于卫生填埋法简便易行、处理费用较低,已成为各大城市垃圾处理的主要方式[2]。垃圾填埋过程中会产生一种高浓度的有机废水-垃圾渗滤液[3],其中的水溶性有机物(Dissolved organic matter,DOM)占渗滤液中总有机物的80%以上,是造成渗滤液处理工艺出水化学需氧量(Chemical oxygen demand,COD)较高的原因之一[4]。因此,对于渗滤液DOM组成变化规律的研究成为学者们关注的焦点。
对DOM的物质组成及结构变化的研究方法主要有GC-MS联用、红外光谱、紫外光谱、荧光光谱和核磁共振等[5-9]。其中荧光光谱法由于其高灵敏度、高选择性、高信息量、不破坏样品结构等优点,越来越受到研究者的欢迎[10]。在荧光光谱应用于DOM的研究中,目前学者们主要针对不同来源DOM、不同处理过程中的DOM、不同环境条件下DOM的荧光特性及荧光光谱变化规律进行分析研究[11-13]。虽然在pH和离子强度对DOM、腐殖酸等的荧光光谱影响有所报道[14-15],但是在强酸、碱性条件下研究离子强度对于垃圾渗滤液DOM荧光特性的影响鲜有报道。本研究利用同步扫描荧光光谱技术,研究在酸性、中性和碱性条件下,DOM荧光光谱的变化规律和离子强度对于荧光光谱的影响,为阐明填埋场渗滤液中溶解性有机物的性质,了解其化学行为提供进一步的理论依据。
1 材料与方法
1.1 材料
生活垃圾填埋初期(新鲜生活垃圾)、中期(约5年)、后期(约10年)的渗滤液,取自北京阿苏卫填埋场,依次编号为填埋前期、中期、后期。
1.2 渗滤液DOM的提取
取一定体积的新鲜渗滤液,在4℃,12000 r·min-1条件下离心 20 min,上清液过 0.45μm 的微孔滤膜,滤液中的有机物即为DOM。
1.3 不同离子强度的DOM溶液制备
使用Shimadzu TOC-5000 TOC分析仪测定渗滤液DOM的碳含量,配制浓度为20 mg·L-1的渗滤液DOM母液三组,使用HClO4和NaOH溶液调各组样品pH分别为3、7、13,加入的酸碱试剂总量不超过100μmol,忽略浓度稀释效应。然后分别移取各组样品20mL至5个50mL的锥形瓶中,加入KCl使各样品离子强度分别为0、0.1、0.2、0.3、0.4 mol·L-1。
1.4 荧光光谱测定
荧光光谱测定仪器为Perkin Elmer Luminescence Spectrometer LS50B。该仪器的主要性能参数如下:激发光源:150 W氙弧灯;PMT电压:700 V;信噪比>110;带通(Bandpass):Ex=10nm;Em=10nm;响应时间:自动;扫描光谱进行仪器自动校正。各荧光光谱的扫描参数:同步扫描光谱:波长扫描范围为 Eex=200~500nm,Δλ=Eem-Eex=20nm,扫描速度为200nm·min-1。
2 结果与分析
2.1 不同pH条件下渗滤液DOM的同步荧光光谱特性
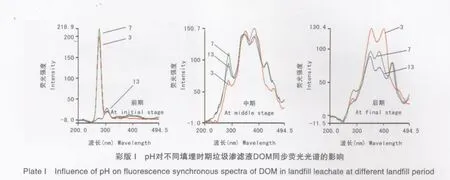
不同pH条件下3个填埋时期渗滤液DOM的同步荧光光谱见彩版Ⅰ。
由彩版Ⅰ可知,填埋前期样品在pH 3和7时最大荧光峰在275 nm附近,而pH 13时转为310nm附近,此峰在pH 3和7时是肩峰。Senesi,Guibault、Pullin和Jie等认为在短波长范围,高荧光强度的特征峰主要由分子结构简单、分子缩合度较低的有机物质形成[16-19];而分子质量较大,复杂化程度较高的有机物质所形成的特征峰处在长波长范围。薛泽春等认为,在Δλ=20nm时,275 nm附近的特征峰是由酪氨酸产生的[20]。彩版Ⅰ表明,前期样品的物质组成成分较简单。主要特征峰是类酪氨酸峰,在pH 13时,可能发生了能量转移,使275 nm处荧光强度降低,310nm附近的荧光峰荧光强度增强。
填埋中期样品在350nm和390nm附近的荧光峰在pH 3下相对于pH 7和13略有红移和降低,这表明在酸性环境中DOM大分子发生了卷曲聚集。在pH 7时各峰的荧光强度最高。Mei、赵越、俞天智和Perdue等认为,在pH 13时,DOM上的给电子基团解离,会导致溶液荧光强度的降低[13,21-24]。Pan等通过zeta电位分析和原子力显微镜等技术对腐殖酸的分析结果表明,在酸性条件下腐殖酸的分子结构会由于电势的减少,使分子内及分子间氢键作用增强而导致分子聚集[25]。本研究中DOM主要组成成分类似腐殖酸物质,在pH 3时DOM分子发生了聚集,pH 13时给电子基团解离导致荧光强度较低,与前人研究结果相似。
填埋后期样品的腐殖化程度更大,275 nm处的荧光峰几乎消失,表明低分子质量的有机物在这种样品中含量较少,荧光强度的大小顺序是pH 3>pH 7>pH 13。Perdue等认为,羧基在 pH 3~6之间会发生质子化,这导致DOM结构离散[24]。本研究表明,填埋后期的渗滤液DOM在pH 3时发生羧基质子化作用使荧光强度最大,pH 13时给电子基团的解离导致荧光强度最小;中期样品与后期样品一样,在430nm附近的荧光峰在pH 7和pH 13下都存在,但pH 3时消失。这种现象未见报道,可能与各种DOM在不同pH下的分子结构变化有关。
2.2 不同离子强度下渗滤液DOM的同步荧光光谱特性
填埋前、中、后期的渗滤液水溶性有机物在pH 3、pH 7和pH 13时,分别在离子强度0~0.4 mol·L-1下的同步荧光光谱列于彩版Ⅱ,各荧光峰强度见表1。
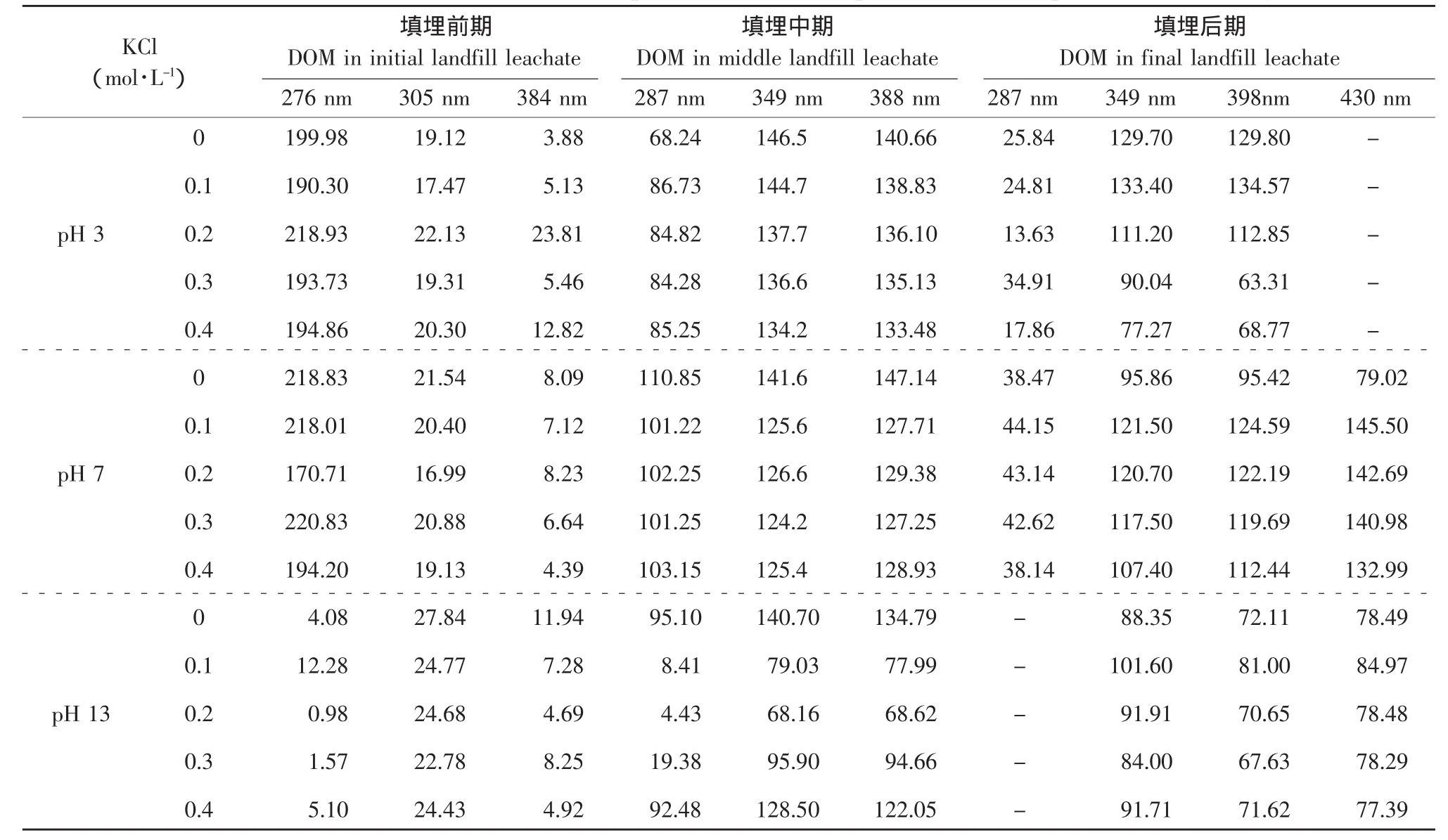
表1 不同pH和离子强度下各填埋期DOM同步荧光光谱荧光峰强度变化Table1 Variation of synchronous scan spectra fluorescence peak in different pH and ionic strength
填埋前期渗滤液DOM的主要成分是小分子的类蛋白物质,腐殖质含量较低,在pH 3和7时各荧光峰受离子强度影响相对较小;在pH 13时受离子强度影响较大,但各峰变化规律不一致。推测在pH 13时,DOM分子上的给电子基团解离,加入KCl后使盐析效应更显著,这导致荧光强度大体上随离子强度的增加而降低。
填埋中期渗滤液DOM的组成成分逐渐转化为大分子的腐殖质物质[7],在pH 3和pH 7下,各位置荧光峰强度变化很小而且位置几乎没有移动。随着KCl的加入,pH 7时荧光强度略有下降,pH 3时荧光强度上升,但随离子强度的增加荧光变化不明显。当环境pH等于13时,离子强度对荧光的影响显著,各荧光峰随离子强度的增加荧光强度先降低后升高。在碱性条件下,DOM结构离散。推测在pH 13时加入的阳离子导致了DOM分子的卷曲作用和盐析作用使荧光强度发生了降低[14]。随后的荧光强度增加可能是由于解离的酚羟基与钾离子反应的结果。
填埋后期渗滤液DOM在pH 3时430nm处的荧光强度较低,pH 13时287 nm处的荧光强度较低,因此二者不做统计。在pH 3下,287 nm处荧光峰受离子强度影响不显著,而349 nm和398 nm处,离子强度为0.1 mol·L-1时,荧光强度略有增高,随后随离子强度增加而降低;在pH 7下,荧光强度先升高后稳定;在pH 13时,荧光强度受离子强度的影响过程与前二者相似,但变化程度相对较小。造成这些现象的可能原因是填埋后期渗滤液DOM的组成成分中类蛋白含量较少,荧光量子产率低,因而,短波处的荧光强度变化较小;而含量较高的类腐殖质物质在不同pH下的分子结构不同,因此,受盐作用的影响不同。Lee等认为在非常低的离子强度下,腐殖质的大分子结构是易变和展开的,具有离散构型[26];随着离子强度的逐渐增加,阳离子同DOM分子上的官能团发生反应;在更高的离子强度下,会发生DOM分子间相互作用和盐析效应,二者共同作用,导致DOM分子结构发生卷曲,表现为荧光强度的降低。
3 讨论
本研究发现,pH与离子强度对于渗滤液DOM的荧光光谱都有较大的影响。在酸、碱及中性条件下对渗滤液DOM不同离子强度下的同步荧光光谱进行测量,结合pH的变化分析DOM理化性质的变化,更好的解释了离子强度对于荧光光谱的影响,其中pH对于荧光光谱的影响同前人结果一致[13,21-25]。目前关于离子强度对荧光光谱变化的报道相对较少[13-16],在不同pH下离子强度的影响更鲜见报道。一般认为离子强度对于荧光光谱影响不大,而本研究表明,酸、碱性条件下同步荧光光谱变化较大,这一方面可能与DOM的来源不同有关;另一方面,不同填埋时期渗滤液DOM的组成成分不同,也是导致荧光光谱变化的主要原因之一。本研究对渗滤液处置方法的研究具有一定的理论指导意义。要揭示离子强度影响的变化规律,还需在更广泛的pH范围内对于离子强度的影响做更深入细致的研究。
4 结论
a.渗滤液DOM受pH影响显著,其同步荧光光谱各荧光峰在不同pH下的位置与强度均不同。
b.离子强度对渗滤液DOM影响比较显著,对于三个样品来说,pH 3或pH 13时的影响更明显,推测是由于分子的卷曲与盐析作用的导致的荧光强度改变。
[1]孙睿,张宇,苍晶.高温菌群接种生活垃圾好氧堆肥的实验[J].东北农业大学学报,2007,38(1):35-38.
[2]吴大鹏,陶虎春.影响Fenton法处理晚期垃圾渗滤液CODcr去除因素的研究[J].东北农业大学学报,2009,40(5):50-52.
[3]张军政,杨谦,席北斗,等.垃圾填埋渗滤液溶解性有机物组分的光谱学特性研究[J].光谱学与光谱分析,2008,28(11):2583-2587.
[4]He P J,Xue J F,Shao L M,et al.Dissolved organic matter(DOM)in recycled leachate of bioreactor landfill[J].Water Research,2006,40(7):1465-1473.
[5]Lu X Q,maie N,Hanna J V,et al.Molecular characterization of dissolved organic matter in freshwater wetlands of the Florida everglades[J].Water Research,2003,37(11):2599-2606.
[6]Huo S L,Xi B D,Yu H C,et al.Characteristics of dissolved organic matter(DOM)in leachate with different landfill ages[J].Journal of Environmental Sciences,2008,20:492-498.
[7]席北斗,魏自民,赵越,等.垃圾渗滤液水溶性有机物荧光谱特性研究[J].光谱学与光谱分析,2008,28(11):2605-2608.
[8]Baker A,Curry M.Fluorescence of leachates from three contrasting landfills[J].Water Research,2004,38:2605-2613.
[9]Dai J Y,Zhou J M,Qin S P.Binding of pyrene to dissolved organic matters:Fractionation and characterization[J].Journal of Environmental Sciences,2004,16(6):928-933.
[10]傅平青,刘丛强,吴丰昌.溶解有机质的三维荧光光谱特征研究[J].光谱学与光谱分析,2005,25(12):2024-2028.
[11]ma H Z,Allen H E,Yin Y J.Characterization of isolated fractions of dissolved organic matter from natural waters and a wastewater effluent[J].Water Research,2001,35(4):985-996.
[12]Said-Pullicino D,Kaiser K,Guggenberger G,et al.Changes in the chemical composition of water-extractable organic matter during composting:Distribution between stable and labile organic matter pools[J].Chemosphere,2007,66(11):2166-2176.
[13]Mei Y,Wang L Y,Wu F.Effects of water chemistry and concentrations of dissolved organic matter on its fluorescence characteristics and molecular conformation[J].Chinese Journal of Geochemistry,2009,28(4):413-420.
[14]Ghosh K,Schnitzer M.Fluorescence excitation spectra of humic substances[J].Canadian Journal of Soil Science,1980,60:373-379.
[15]Mobed J J,Hemmingsen S L,Autry J H,et al.Fluorescence characterization of IHSS humic substances:Total luminescence spectra with absorbance correction[J].Environmental Science and Technology,1996,30(10):3061-3065.
[16]Sensi N,Miano T M,Provenzano M R,et al.Characterization,differentiation,and classification of humic substances by fluorescence spectroscopy[J].Soil Science,1991,152(4):259-271.
[17]Guibault G G.Practical fluorescence:Theory,methods and techniques[M].New York:marcel Dekker,1973:125-145.
[18]Pullin M J,Cabaniss S E,Rank analysis of the pH-dependent synchronous fluorescence spectra of six standard humic substances[J].Environmental Science and Technology,1995,29:1460-1467.
[19]Chen J,Gu B,LeBoeuf E J,et al.Spectroscopic characterization of the structural and functional properties of natural organic matter fractions[J].Chemosphere,2002,48(1):59-68.
[20]薛泽春,程新胜,杨丽文,等.尼古丁猝灭牛血清蛋白荧光机制的研究[J].上海交通大学学报:农业科学版,2006,24(1):44-47.
[21]赵越,何小松,席北斗,等.介质pH对渗滤液中水溶性有机物荧光光谱特性的影响[J].光谱学与光谱分析,2010,30(2):382-386.
[22]俞天智,滕秀兰,杜金州,等.大亚湾土壤胡敏酸的荧光光谱特征[J].光谱学与光谱分析,1998,18(6):746-750.
[23]Lakowicz J R.Principles of fluorescence spectroscopy[M].2nd.New York:Kluwer Academic/Plenum Publishers,1999:278-327.
[24]Perdue E M.Humic substances in soil sediment and water[M].New York:Wiley,1985:493-582.
[25]Pan B,Ghosh S,Xing B S.Dissolved organic matter conformation and its interaction with pyrene as affected by water chemistry and concentration[J].Environmental Science and Technology,2008,42:1594-1599.
[26]Lee C L,Kuo L J,Wang H L,et al.Effects of ionic strength on the binding of phenanthrene and pyrene to humic substances:threestage variation model[J].Water Research,2003,37:4250-4258.