乳酸对酵母凋亡及某些相关基因表达的影响
2010-03-07李树峰佟慧丽徐婷婷严云勤
卢 丽,李树峰,佟慧丽,冯 霞,徐婷婷,严云勤
(东北农业大学生命科学学院,哈尔滨 150030)
细胞凋亡(Apoptosis)是一种由基因控制的细胞自主性死亡方式,指细胞在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程[1-2]。细胞凋亡研究一直以动物细胞为模型,取得了很多成果。但由于动物细胞代谢通路复杂且具有种属和时空特异性,发展到一定阶段给研究带来了困难。
自1997年madeo等首次报导了酵母细胞的凋亡后,使人们认识到,不仅多细胞真核生物可发生凋亡,单细胞真核生物也可发生凋亡,并且像酵母这样的单细胞生命凋亡能很好地简化研究过程[3]。此后研究发现,多种外源因素均能导致酵母细胞凋亡,如H2O2、次氯酸、阿司匹林、乙酸、NaCl、葡萄糖等。随着研究的深入,人们发现酵母基因组编码很多执行细胞死亡基本分子机制的蛋白质,如凋亡蛋白抑制因子IAP(Bir1)和与线粒体相关联的caspases、Aif、HtrA2/Om(iNma111)等[4-5],有的酵母凋亡中还涉及线粒体中的Fis1、Nuc1、Ndi1[6],活性氧(ROS)在酵母凋亡中也起着重要作用。由不同因素引起的酵母凋亡,可能具有不同的分子机制。由于酵母与多细胞动物凋亡的相似性,酵母作为一种简单的生物模型体系,可能有助于阐明和发现新的凋亡调节机制。
乳酸是某些特殊酵母发酵的正常终产物,在酿造啤酒时,加入适量乳酸既能调整pH促进糖化,有利于酵母发酵,提高啤酒质量,又能增加啤酒风味,延长保质期。在白酒、清酒和果酒中乳酸可用于调节pH,防止杂菌生长,增强酸味和清爽口感。在某些方面,乳酸与酵母有着很大的关联,所以,研究乳酸对酵母凋亡的影响及其相关基因的表达变化,可指导生产实践中对乳酸的应用,同时为其凋亡通路的深入研究做铺垫。
1 材料与方法
1.1 材料
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae)菌株Y187由朱延明教授实验室惠赠。
1.1.2 试剂
溶细胞(Lytiase酶)购自Solarbio;Taq酶和其他PCR试剂(购自宝生物工程(大连)有限公司);TUNEL试剂盒(购自Promega公司);反转录试剂盒(购自康为生物有限公司)。其他常规试剂均为进口分装或国产分析纯。
首先使用水利普查基层登记台账管理系统菜单中的“对象清查清查浏览”功能,点击业务分类的每一项,通过“导出EXCEL”功能,分别形成与Q201~Q803内容对应的24张浏览表,如表Q201(水库工程)导出名为“VIEW_Q201_0.XLS”。为了避免数据的无序性和方便后面的操作,应在软件中先按水利普查自动生成的编码排序后再导出数据。
1.1.3 引物
所有引物均用primer5.0软件设计,上海生工公司合成,所设计引物序列、退火温度和扩增片段大小如下:
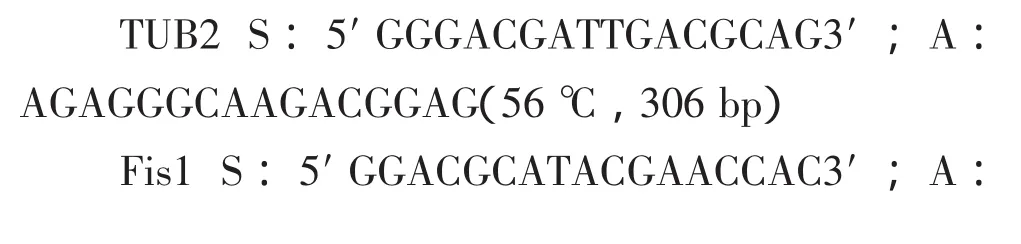

1.2 方法
1.2.1 酵母生长曲线的测定
酵母生长曲线的测定方法参照文献[7]。
1.2.2 乳酸处理酵母
当YPD液体培养基中的酵母细胞处于指数生长前期(OD=0.6~0.9)时,调pH 3.0后,分别加入0、200、250、300 mmol·L-1的终浓度乳酸培养 200 min,而250 mmol·L-1终浓度的乳酸分别培养120、200、260 min。
1.2.3 酵母细胞死亡与凋亡的检测
酵母细胞死亡检测采用美兰染色法[7]。酵母细胞的检测采用DAPI染色法、PI染色法、TUNEL染色法[8-10]。RT-PCR法检测一些凋亡相关的基因表达按试剂盒指南操作。
1.2.4 数据处理与分析
RT-PCR结果经Glyko BandScan4.3进行OD值扫描后,数据采用DPS7.05软件进行统计和分析。
2 结果与分析
2.1 酵母细胞的生长曲线和死亡率检测结果
2.1.1 酵母细胞的生长曲线
采用分光光度计法测量酵母细胞的生长曲线,培养8 h左右,酵母生长开始进入指数期,随后培养到约18 h这个区间,酵母细胞生长迅速,基本呈几何级数生长。培养20 h后,酵母细胞生长极其缓慢,基本处于停滞状态,此时,酵母细胞数达到最大值,处于稳定生长期,如图1所示。
2.1.2 酵母细胞的死亡情况
根据前人试验结果可知,当酵母细胞被外源刺激3 h后死亡率达到80%~90%时,凋亡的程度最大。所以本试验通过一系列的试验选择200、250、300 mmol·L-1三个乳酸终浓度进行试验。
用美兰溶液对酵母细胞进行染色,普通光镜下观察到死细胞被染成蓝色,而活细胞没有被染上色。在本试验中乳酸的三个浓度处理的酵母细胞,酵母细胞的生长被完全抑制,随着乳酸浓度的增加,死亡比率逐渐增加,200 mmol·L-1终浓度的乳酸处理酵母细胞200 min,约有30%左右的细胞发生死亡;250 mmol·L-1终浓度的乳酸处理120、200和260 min时,酵母的死亡率在55%~62%之间;当乳酸终浓度达到300 mmol·L-1时,处理120 min后,死亡率基本达到90%,该浓度处理的前120 min内,酵母的死亡比率增长很快(见图2)。
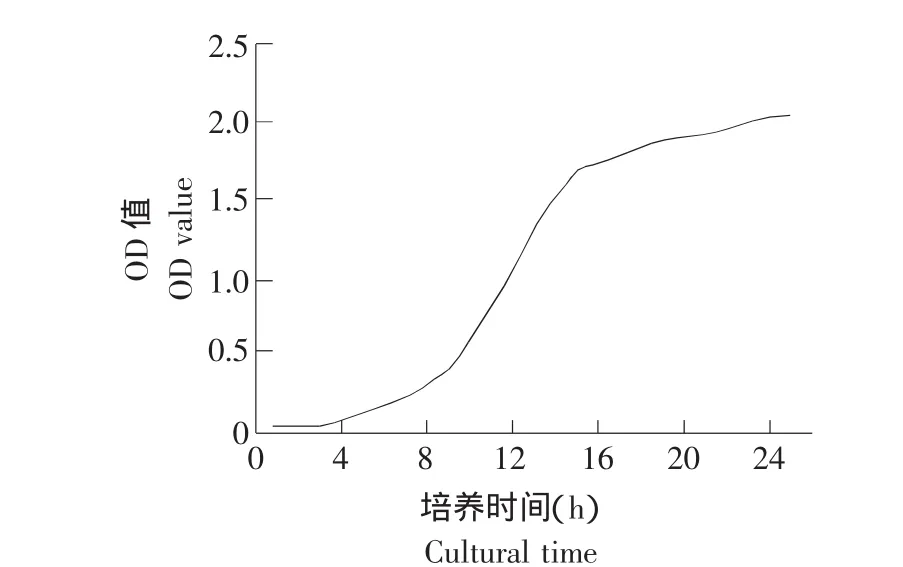
图1 酵母细胞在YPD培养基中的生长曲线Fig.1 Growth curve of yeast cell in YPD culture medium
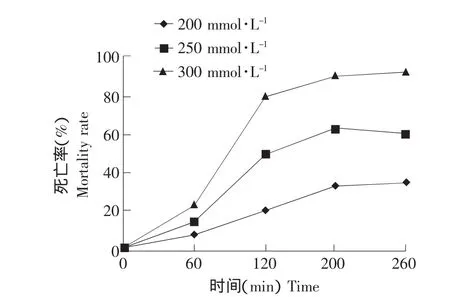
图2 乳酸处理酵母细胞的死亡率曲线Fig.2 Mortality rate curve of lactic acid treatment yeast cells
2.2 凋亡情况检测结果
2.2.1 DAPI染色情况
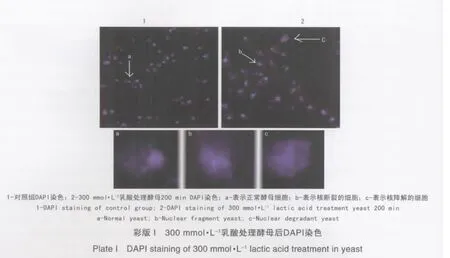
DAPI染色常用于细胞凋亡检测,正常的细胞核核形完整,染色质均匀,当细胞发生凋亡时,染色质固缩,向外周聚集,形成周边化,紧接着染色质进一步固缩,形成很多颗粒物,最后细胞核破裂形成碎片,核解体。因本试验中300 mmol·L-1的终浓度乳酸处理200 min可引起90%左右的酵母细胞死亡,如果引起的死亡是以凋亡的形式进行,那么这个条件的死亡率应该凋亡程度最大。所以对可能引起最大凋亡程度的300 mmol·L-1乳酸终浓度处理的酵母进行凋亡检测。DAPI染色后,在荧光共聚焦显微镜下可观察到酵母细胞发生核断裂和核降解的凋亡表型(见彩版Ⅰ),核断裂而产生核扩散的状态,图中染色的范围比对照组的细胞大一些,可以初步确定乳酸能够引起酵母细胞发生凋亡,但还需做进一步的凋亡验证。
2.2.2 PI染色情况
酵母细胞进行PI染色后,在荧光显微镜下观察计数统计如图3所示,对照组的细胞,PI透膜率基本为零,即基本没有细胞被染色;200 mmol·L-1乳酸处理200 min后PI透膜被染成红色的细胞仅约2%~4%;引起90%左右死亡率的300 mmol·L-1乳酸处理200 min后的检测结果仅有少于10%的细胞被染色。可见,本试验设置的三种乳酸浓度的PI透膜率相比于细胞的死亡率是非常小的一部分,基本可以忽略。由于PI仅能透过坏死细胞的细胞膜而对核染色,但细胞发生死亡而没有被PI染色,说明大部分死亡细胞的细胞膜并没有遭到破坏,这符合凋亡发生的情况,所以进一步确定是凋亡作用的结果。
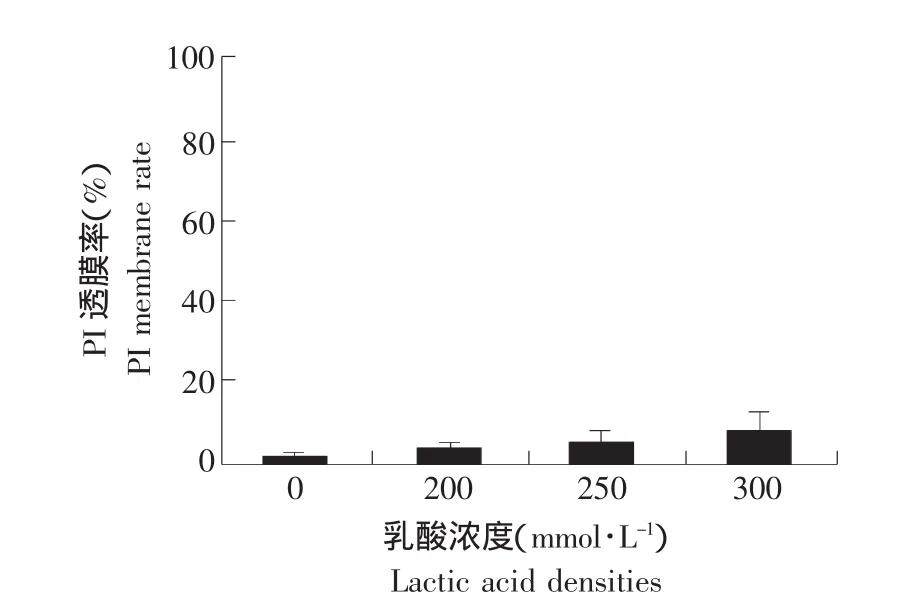
图3 不同终浓度乳酸处理酵母细胞200 min的透膜率Fig.3 Through membrane rate of different densities of final lactic acid treatment yeast cells in 200 min
2.2.3 TUNEL染色情况
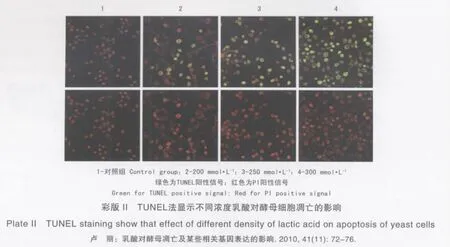
TUNEL是一种用来检测细胞凋亡的分析方法,细胞凋亡时内源性核酸内切酶被激活,细胞自身的染色质或DNA被切割,出现单链或双链缺口,TUNEL可以有效的去探测DNA片段的产生。酵母细胞进行TUNEL染色后,在共聚焦荧光显微镜下观察,对照组的酵母细胞没有显示TUNEL阳性。200 mmol·L-1终浓度乳酸处理酵母细胞200 min,TUNEL阳性率不到30%,当终浓度达到300 mmol·L-1时,TUNEL阳性率可达到80%以上,可见随着乳酸浓度的增加TUNEL的阳性率逐渐增加(见彩版Ⅱ)。由250 mmol·L-1的终浓度乳酸处理培养酵母细胞不同时间,不同培养时间在本试验设置的这3个时间梯度中内TUNEL阳性率基本都在60%作用左右,随着处理时间的延长,TUNEL的阳性率并没有显著变化。TUNEL检测结果表明通过以上的凋亡检测基本可以断定,乳酸引起的酵母细胞死亡是以凋亡的形式进行,其凋亡程度随乳酸处理浓度的增加而增加,但与乳酸处理时间无明显改变。
2.3 RT-PCR检测相关基因的表达
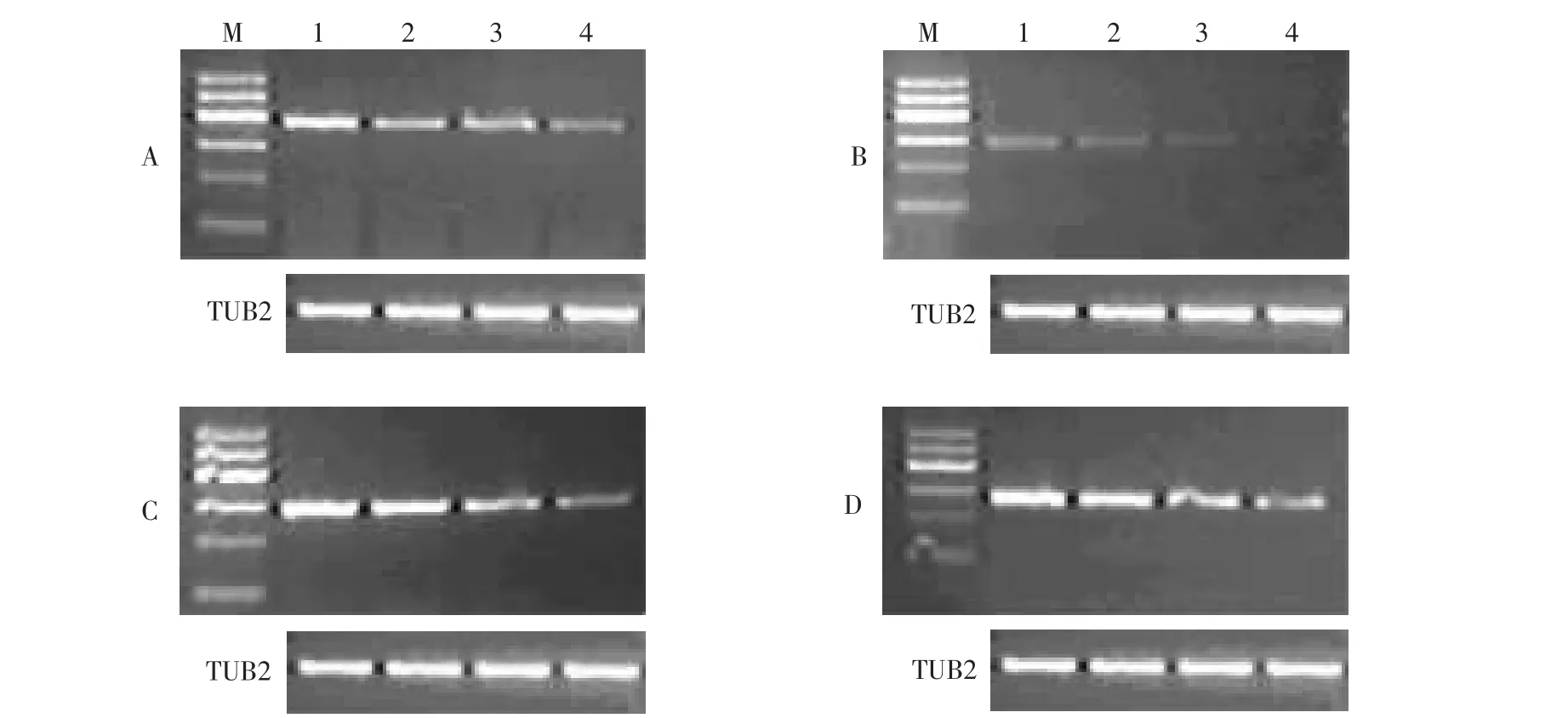
图4 不同浓度乳酸对酵母细胞基因表达的影响Fig.4 Effect of different densities of lactic acid on gene expression of yeast cells
本试验选择了线粒体中与凋亡相关的几个蛋白基因(Yca1、Aif1、Nma111、Nuc1、Ndi1、Fis1、SOD1、SOD2)和酵母中唯一的凋亡蛋白抑制因子Bir1。通过RT-PCR法检测这几个基因的表达量变化,结果表明,随着乳酸终浓度的增加及凋亡程度的增加,得到Fis1、Bir1、SOD1、SOD2四种基因的表达量随之降低且差异显著(P<0.05)(见图4)。图中第1泳道的对照组中,四种基因均有表达,随着乳酸处理浓度(即凋亡程度)的增加,这四种基因的表达都呈递减趋势,而且1与2,2与3,3与4间的差异均显著(P<0.05);当乳酸终浓度达到300 mmol·L-1引起约80%以上的凋亡时,这四种基因的表达量最低。但处理时间的增加对这四种基因表达并没有显著改变(P>0.05)。Yca1、Aif1、Nma111、Nuc1、Ndi1基因的表达随着处理浓度和时间的增加都没有显著变化(P>0.05)。
3 讨论
醋酸、酒精等多种外源刺激可引起酵母凋亡,显现与动物相似的凋亡表型,乳酸作为酵母发酵的产物之一和工业添加剂影响酵母的作用价值,但其对酵母凋亡的影响还未见报道。近年来的研究表明,在酵母的凋亡过程中线粒体、Yca1和ROS具有中心作用[12],凋亡蛋白抑制因子Bir1具有重要调控作用,所以在乳酸引起的酵母凋亡中,检测线粒体中的相关基因、ROS相关基因和Bir1基因表达变化,对细胞凋亡理论研究及指导生产实践有一定的理论意义和实际应用价值。
在本试验条件下,200 mmol·L-1的乳酸已经完全抑制酵母细胞的生长并使细胞死亡,随着处理浓度的增加,酵母细胞的死亡率随之增加。DAPI染色可知,乳酸引起酵母细胞核断裂和核降解,这是凋亡细胞的特征;能够区分坏死和凋亡的PI染色表明,几乎所有死亡的酵母细胞膜并没有破坏,乳酸引起的酵母细胞死亡属于细胞凋亡;TUNEL染色进一步证明,乳酸引起的酵母细胞死亡是以凋亡的形式进行,而且,随着乳酸处理浓度的增加,酵母的凋亡程度也随之增加。但是随着处理时间的延长,酵母细胞的死亡率和凋亡率都无显著变化,这种无时间依赖性的原因可能是乳酸对酵母的损伤在处理的2 h内乳酸的毒性已经发挥作用,2 h后并没有进一步的损伤积累。
采用RT-PCR方法分析线粒体中的一些基因和酵母中唯一的凋亡蛋白抑制因子Bir1的基因表达变化,结果表明,随着凋亡程度的增加Fis1、Bir1、SOD1、SOD2四个基因的表达量随之降低。Fis1p在线粒体断裂中起作用,也显示抑制凋亡的功能,如Fis1酵母突变株经H2O2处理后凋亡程度增加[6]。Fannjiang等研究表明,酵母Fis1p的抗凋亡功能能被Bcl-2或bcl-xl功能性替换,暗示Fis1p以类Bcl-2方式作用[13]。而本试验中Fis1基因表达的降低,可能是其在凋亡的过程中起着一个类Bcl-2的作用,具体作用机制有待深入研究。Bir1p是酵母中凋亡蛋白抑制因子IAP家族的唯一成员,抑制下游的caspase,Bir1p显示抗凋亡功能,酵母细胞缺少Bir1p显示典型的凋亡特征及ROS的产生[4]。本试验中Bir1基因表达的下降可能调节加强了Yca1p的激活从而促使凋亡发生;Yca1基因的表达没有显著变化,它对凋亡的作用还有待于深入检测其蛋白活力变化。对线粒体中的Aif1(凋亡诱导因子)、Nma111(细胞凋亡核介导因子Htra2/Omi类蛋白)、Nuc1(核酸内切酶)、Ndi1(人类细胞AMID的酵母同源物)的检测并没有得到显著的变化,为进一步阐明这些蛋白在乳酸诱导凋亡中的作用,还需进一步检测其蛋白活力,或采用构建突变株的方法来进行检测。
本试验中在乳酸处理培养120~260 min酵母凋亡的黄金时间内,随着凋亡程度的增加,SOD1(细胞质超氧化物歧化酶)、SOD2(线粒体超氧化物歧化酶)基因的表达随之降低。Fabrizio等研究在酵母中任意过表达SOD1或SOD2可增加其寿命,酵母的长期生存需要这二者[14],但乳酸处理使酵母凋亡,寿命缩短,可能因此使SOD1和SOD2的表达降低。本试验所检测的各基因在酵母凋亡过程中的相互关联及其作用机制尚需深入研究。
4 结论
a.乳酸引起的酵母细胞死亡具有剂量依赖性,无时间依赖性。
b.经DAPI、PI、TUNEL染色证明,乳酸引起的酵母细胞死亡是以凋亡的形式进行。
c.RT-PCR检测表明,与凋亡相关的Fis1、Bir1、SOD1、SOD2基因的表达量随着凋亡程度的增加而降低。
[1]范京惠,左玉柱,李一经.细胞凋亡的研究进展[J].东北农业大学学报,2005,36(6):804-807.
[2]刘翔,杨明瑜,曹灿,等.热激诱导番茄果实细胞色素C的释放[J].东北农业大学学报,2009,40(1):23-27.
[3]madeo F,Frohlich E,Frohlich K U.A yeast mutant showing diagnostic markers of early and late apoptosis[J].J Cell Biol,1997,139:729-734.
[4]Walter D,Wissing S,madeo F,et al.The inhibitor-of-apoptosis protein Bir1p protects against apoptosis in S.cerevisiae and is a substrate for the yeast homologue of Omi/HtrA2[J].J Cell Sci,2006,119:1843-1851.
[5]Wissing S,Ludovico P,Herker E,et al.An AIF orthologue regulates apoptosis in yeast[J].J Cell Biol,2004,166:969-974.
[6]Eisenberg T,Buttner S,Kroemer G,et al.The mitochondrial pathway in yeast apoptosis[J].Apoptosis,2007(12):1011-1023.
[7]白毓谦.微生物实验技术[M]济南:山东大学出版社,1987.
[8]周峻岗.酿酒酵母高尔基体搪基化及生物学功能的研究[D].遂宁:山东大学,2007.
[9]Kitagaki H,Araki Y,Funato K,et al.Ethanol-induced death in yeast exhibits features of apoptosis mediated by mitochondrial fission pathway[J].FEBS Letters,2007,581:2935-2942.
[10]Ludovico P,Sousa M J,Silva M T,et al.Saccharomyces cerevisiae commits to a programmed cell death process in response to acetic acid[J].Microbiology,2001,147:2409-2415.
[11]Aguila E M D,Dutra M B,Silava J T,et al.Comparing protocols for preparation of DNA-free total yeast RNA suitable for RT-PCR[J].BMC Molecular Biology,2005,6:9.
[12]mazzoni C,Falcone C.Caspase-dependent apoptosis in yeast[J].Biochimica et Biophysica Acta,2008,1783:1320-1327.
[13]Fannjiang Y,Cheng W C,Lee S J,et al.Mitochondrial fission proteins regulate programmed cell death in yeast[J].Genes Dev,2004,18:2785-2797.
[14]Fabrizio P,Pletcher S D,Minois N,et al.Chronological agingindependent replicative lifee span regulation by Msn2/Msn4 and Sod2 in Saccharomyces cerevisiae[J].FEBS Lett,2004,557:136-142.