PRRSV和PCV-2二重PCR检测方法的建立及初步应用*
2010-03-06吴发兴吴美芹高许雷朱紫祥张燕霞李晓成
王 林,吴发兴,吴美芹,高许雷,李 平,4,朱紫祥,5,张燕霞,张 志,李晓成*,单 虎
(1.青岛农业大学,山东青岛266109;2.中国动物卫生与流行病学中心,山东青岛266032;3.招远市畜牧局,山东烟台265400;4.新疆农业大学,新疆乌鲁木齐830052;5.西北农林科技大学,陕西杨陵712100)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrone,PRRS),俗称“猪蓝耳病”,是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrone virus,PRRSV)引起的一种急性传染病,主要引起妊娠母猪繁殖障碍和仔猪的呼吸道疾病[1-2]。猪圆环病毒(Porcine circovirus,PCV)是迄今发现的一种最小的动物病毒,具有PCV-1和PCV-2两种血清型。PCV-1无致病性,但广泛存在于猪体内及猪源传代细胞系。猪圆环病毒2型(Porcine circovirus type2,PCV-2)具有致病性,可引起猪体质下降、消瘦、腹泻,还可表现出生长发育不良、皮肤苍白、肌肉衰弱无力,甚至出现贫血、黄疸等症状[3]。
两种病毒在临床上常呈混合感染,都可引起早产、流产、死胎、弱胎、木乃伊胎等繁殖障碍[4-5]。目前,可用血清学方法或病毒分离鉴定对这两种病原的感染进行诊断[6],但是耗时长,灵敏度低,不能满足生产上的需要。多重PCR技术是在同一PCR体系中加入多对引物,对多个目的基因同时进行扩增的分子生物学诊断方法,可同时检测多种病原体或多个基因型,达到对多种疾病的同步诊断,缩短检测时间的目的[7-9]。为此,我们开展了二重PCR技术检测PRRSV、PCV-2的研究,建立同时快速鉴别诊断两种病毒的方法。本研究根据二重PCR引物设计要求设计各自PCR引物,在优化单项PCR检测方法的基础上,初步建立了敏感的二重PCR检测方法,为预防和控制这两种疾病提供快速诊断方法。
1 材料与方法
1.1 材料
1.1.1 细胞毒参考毒株 PRRSV、PCV-2、猪伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)、猪细小病毒(PPV)、猪流感病毒(SIV)细胞毒参考毒株均由中国动物卫生与流行病学中心监测室提供。
1.1.2 组织病料的来源及处理 临床组织病料是2009年秋季,采集于河北省和安徽省不同类型的发病猪场或养殖户的疑似发病猪以及屠宰场。无菌操作剪取1.0 g~2.0 g病料,加少量灭菌PBS(含青霉素、链霉素),剪碎,用无菌研磨器研磨至糊状,再用PBS按1∶4的体积比稀释成悬液,样品经处理后分管置-70℃冻存备用。
1.1.3 试剂 DNA zol Regent、Trizol Regent均购自Invitrogen公司;AMV反转录酶、Rnase-Inhibitor、r Taq DNA聚合酶、dNTPs、DNA Marker DL 2 000等均购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 引物设计与合成 根据基因库提供的PRRSV和PCV-2基因序列,通过Blast分析软件分别对基因的序列进行分析,选择了PRRSV的N sp2基因序列和PCV-2的ORF1基因序列,应用计算机Primer软件设计了两对特异性引物以及针对RNA病毒的反转录引物(表1),引物由宝生物工程(大连)有限公司合成。
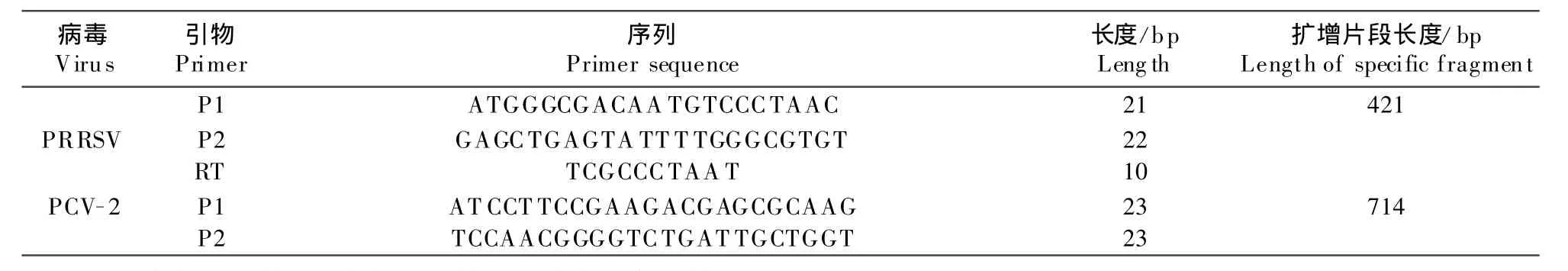
表1 二重PCR引物设计结果Table 1 Resultsof p rimer design for duplex PCR
1.2.2 病毒核酸的抽提 取细胞毒参考株,按Invitrogen公司的DNAzo l Regent DNA试剂盒的操作说明书和TRIzol LS·Reagent RNA试剂盒,提取病毒基因组DNA/RNA。
1.2.3 单项PCR检测方法的建立
1.2.3.1 RNA病毒RT-PCR的最佳反应条件PRRSV反转录反应(RT)总体积为20μL:5×AMV bu ffer 4μL,AMV反转录酶0.5μL,RNase抑制剂0.5μL,RT引物1μL,dNTP Mixture(2.5 mmol/L)4μL,DEPC灭菌水7μL,病毒RNA模板3μL,混匀,42℃水浴作用1.5 h,即得到cDNA模板,置-20℃保存备用。
RT-PCR反应条件:总体积为25μL,10×PCR bu ffer 2.5μL,dNTPM ix ture(2.5 mmol/L)2μL,上下游引物各0.5μL,Taq 0.5μL,灭菌双蒸水16μL,cDNA模板3μL。
RT-PCR扩增条件:95℃5 m in;94℃50 s,55℃50 s,72℃1 m in,循环35次;72℃延伸10 min。
1.2.3.2 DNA病毒单项PCR的最佳反应条件PCV-2的最佳反应体系:总体积为25μL,10×PCR Bu ffer 2.5μL,dNTP M ix ture(2.5 mmol/L)2μL,上下游引物各0.5μL,Taq 0.5μL,灭菌双蒸水16μL,DNA模板3μL。
最佳扩增条件:95℃5 m in;94℃50 s,54℃50 s,72℃1 min,循环35次;72℃延伸10m in。1.2.4 二重PCR方法的建立及反应条件的优化 引物用量:加入的引物量(上下游引物的分别用量)选择PRRSV/PCV-2为:0.5μL/0.5μL、0.5μL/0.4μL、0.4μL/0.4μL、0.4μL/0.3μL、0.3μL/0.3μL、0.3μL/0.25μL、0.25μL/0.25μL、0.25μL/0.2μL、0.15μL/0.25μL、0.15μL/0.15μL不同用量进行扩增。
dNTP用量:分别选择1、1.5、2、2.5、3、3.5、4μL不同用量进行扩增。模板用量:双模板扩增分别选择PRRSV/PCV-2为:4μL/4.5μL、4μL/4μL、4μL/3.5μL、4μL/3μL、3μL/4μL、3μL/3.5μL、3μL/3μL、3μL/2.5μL、3μL/2μL、2μL/3μL、2μL/2.5μL、2μL/2μL进行扩增。
反应温度:退火温度分别选择52、53、54、55、56、57、58、59、60℃进行扩增。
1.2.5 二重PCR的特异性试验 以建立的二重PCR检测方法,对PRRSV、PCV-2、CSFV、PRV、PPV、SIV细胞毒等分别进行PCR操作,验证该二重PCR检测方法的特异性。
1.2.6 二重PCR的敏感性试验 将提取的DNA模板和cDNA模板,分别进行10倍系列稀释,并将二者按各个稀释度混合,按已优化的PCR反应的最佳条件进行PCR扩增,以确定最小检测量。
1.2.7 二重PCR的重复性试验 以建立的二重PCR检测方法,重复3次,以验证结果的可靠性。
1.2.8 二重PCR的初步应用 对2009年秋季河北省和安徽省的143份临床疑似病料进行检测。将疑似病料(肝、肺、脾、肾等),加入少量灭菌PBS,用无菌研磨器研磨至糊状,再用PBS按1∶4的体积比稀释成乳剂,于-20℃、37℃反复冻融3次,在4℃以8 000 r/m in离心10min,取上清,用于提取核酸进行二重PCR和单项PCR的检测。
2 结果
2.1 单项PCR扩增结果
以RRRSV的cDNA和PCV-2的DNA为模板,分别用各自特异性引物进行扩增,PRRSV、PCV-2均扩增出清晰条带,大小分别与预期的421 bp、714 bp结果相符(图1)。
2.2 二重PCR反应条件的确定
试验通过对反应系统中PRRSV和PCV-2两对引物的用量、dNTP用量、模板用量、反应温度等多项实验,对反应条件进行优化。在相同反应条件下,本着条带较亮、二聚体较少、试剂用量较少的原则,确定反应条件。即在25μL反应体系中,PRRSV的上下游引物用量分别为0.25μL、PCV-2的上下游引物用量分别为0.2μL,PRRSV的cDNA的模板用量为3μL、PCV-2的DNA的模板用量为2.5μL,10×PCR bu ffer 2.5μL,dNTPM ixture 2μL,Taq 0.5μL,灭菌双蒸水13.6μL。在此条件下,二重PCR以如下反应程序为佳:95℃5 min;94℃50 s,55℃50 s,72℃1 m in,循环35次;72℃延伸10 min。在最佳反应条件下,二重PCR扩增的目的条带与预期结果相符(图2)。
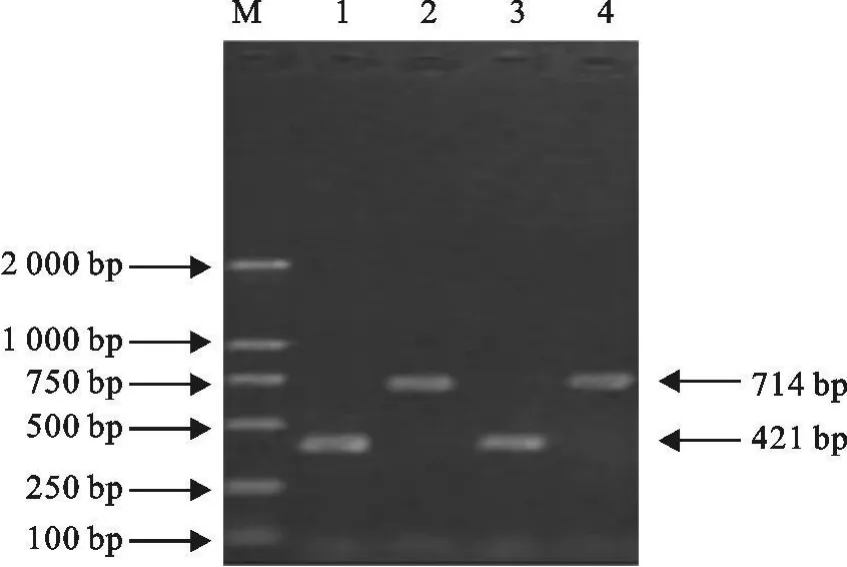
图1 单项PCR的扩增结果Fig.1 The results of monomial PCR

图2 二重PCR的扩增结果Fig.2 The resu lts of duplex PCR
2.3 二重PCR特异性试验结果
采用该研究建立的二重PCR扩增条件,对RRRSV、PCV-2、CSFV、PRV、PPV、SIV以及PRRSV/PCV-2的cDNA/DNA的模板人为混合后进行扩增,结果含有PRRSV和PCV-2的核酸样品均成功地扩增出与试验设计相符合的PRRSV 421 bp的目的片段,PCV-2 714 bp的目的片段。不含此两种核酸的样品,没有条带出现(图3)。
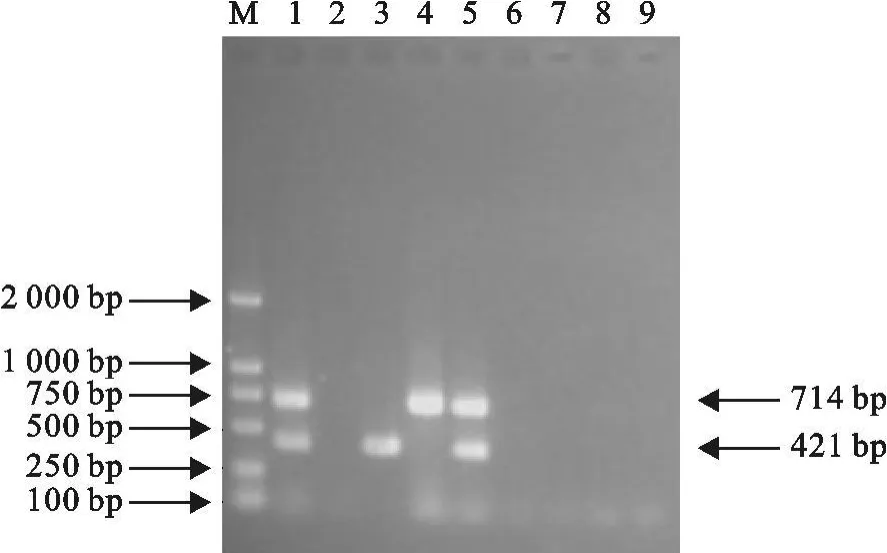
图3 二重PCR特异性试验Fig.3 Specific assay of duplex PCR
2.4 二重PCR敏感性试验结果
在上述引物用量、dNTP用量、模板用量、反应温度等优化条件下,该二重PCR方法扩增的cDNA/DNA模板以及1∶10、1∶102、1∶103、1∶104均出现可见的目的条带(图4)。
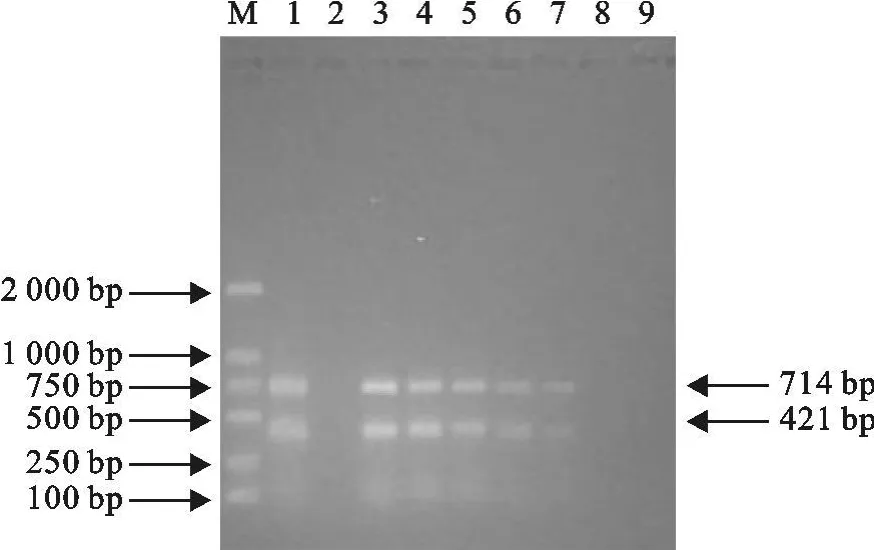
图4 二重PCR扩增的敏感性试验Fig.4 Sensitivity assay of duplex PCR
2.5 二重PCR重复性试验结果
以建立的二重PCR检测方法,重复3次,结果在421 bp处和714 bp处,均得到了清晰可见的目的条带。
2.6 二重PCR的初步应用
对来自河北省和安徽省的143份临床病料进行了二重PCR扩增试验,单纯感染PRRSV的有28份,单纯感染PCV-2的有41份,既感染PRRSV又感染PCV-2的有22份。
将二重PCR扩增实验结果与单项PCR扩增试验结果比较,两者有较高的符合率,其阳性符合率在92.6%以上(表2),结果表明该多重PCR体系的特异性和敏感性较好。
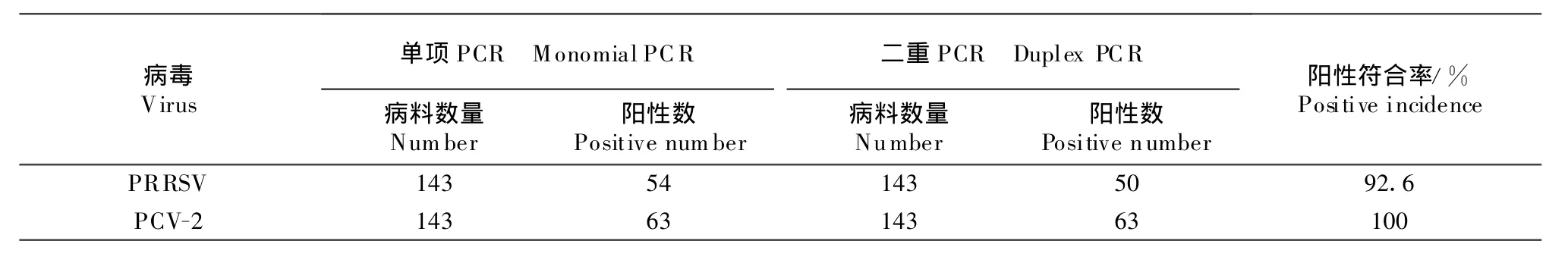
表2 被检病料单项PCR与多重PCR检测对比试验结果Table 2 The comparative detection of PRRSV and PCV-2 in clinical samples by monomial PCR and duplex PCR
3 讨论
PRRSV和PCV-2是目前危害养猪业最为严重的疾病,给我国养猪业造成了严重的经济损失,且两种病毒临床上常呈混合感染,给临床诊断带来困难[10]。
本试验在进行PRRSV和PCV-2单项PCR的基础上,通过对病毒引物、dNTP、模板用量及反应温度的筛选,建立了PRRSV和PCV-2二重PCR的快速特异的鉴别诊断方法。
对于二重PCR反应,引物的设计至关重要。引物不仅决定着反应程序的退火温度,而且对建立的二重PCR反应的敏感性和特异性也起着很大的影响。二重PCR在一个反应管中使用两套引物,与常规PCR相比,二重PCR由于同时涉及到了两种模板和两对引物,因而容易出现非特异扩增或不能扩增。这就要求二重PCR中各扩增条件更加苛刻,对引物量要求要适当。本研究的二重PCR需用于检测临床样品,由于提取的DNA/cDNA模板数量多,使PCR扩增容易出现非特异条带,要求二重PCR中各扩增条件和反应成分更加苛刻[11-12]。对引物和模板的量要适当,过高的引物和模板易造成非特异扩增样品,而特异性扩增产物量过多,电泳时出现特异性条带过宽、亮度太强,也会影响其他条带的鉴定,调节引物浓度和模板可以限制过多特异PCR产物的产生。经试验调节,适当减少PCV-2引物量及其DNA模板的用量,适当加大PRRSV引物量及其cDNA模板的用量,在其他条件相同的情况下,检测效果更好[13]。
试验表明,该二重PCR方法具有很好的敏感性及特异性,能够快速、准确的鉴定及区分PRRSV和PCV-2两种病毒,能够应用于临床样品中PRRSV和PCV-2的单个或混合感染。
[1] van Gucht S,van Reeth K,Pensaert M,et al.Interaction between porcine reproductive respiratory syndrome virus and bacterial endotoxin in the lungs of pigs:potentiation of cytokine production and respiratory disease[J].J Clin Microbiol,2003,41(3):960-966.
[2] Chung W B,Lin M W,Chang W F,et al.Persistence of porcine reproductive and respiratory syndrome virus in intensive farrow-to-finish pig herd s[J].Can JVet Res,1997,61(4):292-298.
[3] 祝卫国,宋长绪,王贵平,等.猪2型圆环病毒广东株ORF2基因在大肠埃希氏菌中的表达[J].中国兽医科技,2004,34(12):3-5.
[4] 王泽洲,于 勇,吴 越,等.猪生殖障碍疾病的研究概况[J].中国兽医科技,2007,37(9):823-826.
[5] Allan G M,McNeilly F,Kennedy S,et al.Isolation of circoviruslike viruses from pigs with a wasting disease in the USA and Eu rope[J].JVet Diagn Investi,1998,10(1):3-10.
[6] 李和平.河南省猪呼吸与繁殖障碍综合症流行病学调查[D].陕西杨陵:西北农林科技大学,2006.
[7] Hirohito O,Osamu T,Takuya H,et al.Multiplex PCR and multiplex RT-PCR for inclusive detection of major swine DNA and RNA viruses in pigs with multiple infections[J].JVirol Methods,2009,160:210-214.
[8] 曹洪志,颜其贵,郭万柱,等.多重PCR技术在动物疫病诊断中的应用[J].中国动物检疫,2007,24(1):45-47.
[9] Lee C S,Moon H J,Yang JS,et al.Mu ltiplex PCR for the simultaneousdetection of pseudorabies virus,porcine cytomegalovirus,and porcine circovirus in pigs[J].Virol Method s,2007(1):39-43.
[10] Harms P A,Halbur P G,Sorden SD.Three cases of porcine respiratory disease complex associated with porcine circovirus type 2 infection[J].Swine Health Prod,2002,10:27-30.
[11] 郁宏伟,杨润德,崔弈杰,等.猪伪狂犬病病毒及猪细小病毒二联PCR检测方法的建立[J].中国预防兽医学报,2006,28(2):216-219.
[12] 韩 勇.应用多重方法检测猪伪狂犬病毒、细小病毒和圆环病毒2型[D].河南郑州:河南农业大学,2007.
[13] Sambroo k J,Russell DW.分子克隆实验指南[M].3版.北京:科学出版社,2005:698-699.
