Ⅱ型单纯疱疹病毒糖蛋白D在杆状病毒表达系统中的表达*
2010-03-06姜德玉赵晓燕李君丽王希良于三科
姜德玉,刘 坤,赵晓燕,张 伟,李君丽,王希良,于三科*
(1.西北农林科技大学动物医学院,陕西杨陵712100;2.军事医学科学院微生物流行病研究所病原微生物生物安全国家重点实验室,北京100071)
Ⅱ型单纯疱疹病毒(Herpes simplex virus 2,HSV-2)感染可引起生殖器疱疹[1],其发病率在性病中仅次于淋病和梅毒[2]。如果孕妇感染HSV-2则极易产生流产或造成胎儿先天畸形和智力低下,60%~70%受感染新生儿可因此而死亡,幸存者中95%伴有后遗症。在美国每年造成的直接经济损失超过2亿美元[3]。此外,HSV-2感染可增加艾滋病和宫颈癌的感染机率[4]。使用疫苗将是最经济有效防控HSV-2感染的方法,但目前仍没有临床可用的HSV-2疫苗。
HSV-2疫苗主要有全病毒灭活苗、减毒苗、亚单位苗和核酸疫苗等多种形式[5],其中亚单位疫苗研究进展最为明显。G laxo Smithk line疫苗研究组研发的糖蛋白D-AS04亚单位疫苗具有良好的免疫原性,这种疫苗已经在进行Ⅲ期临床扩大试验,有望成为最先上市的HSV-2疫苗。
糖蛋白是HSV-2的主要免疫原,可诱导细胞和体液免疫应答,产生高滴度的中和抗激发迟发型超敏反应和T细胞增殖。HSV-2的11种糖蛋白中糖蛋白D(glycoprotein D,gD)是宿主体液免疫反应的主要靶标之一,能诱导产生较高水平的中和抗体,成为亚单位疫苗的首选[5-6]。
本研究基于杆状病毒表达体系,将Ⅱ亚单纯疱疹病毒优势靶标糖蛋白D转座至穿梭质粒,最后形成重组杆状病毒。再利用真核表达体系表达更接近天然构象的蛋白,为下一步对此种亚单位疫苗的评价奠定了基础。
1 材料与方法
1.1 材料
1.1.1 病毒与细胞 HSV-2 333株(GenBank Z86099)、Vero细胞、DH 5α感受态细胞、DH10Bac感受态E.coli和Sf9细胞由军事医学科学院微生物流行病研究所免疫室保存。
1.1.2 主要试剂 低分子质量蛋白Marker、DNA Marker DL 2 000/15 000、MiniBEST V iral RNA/DNA Extraction Kit Ver 3.0试剂盒、各类酶以及pMD18T vector均为宝生物工程(大连)有限公司产品;pFastBacⅠ质粒载体、CellfectinⅡReagent脂质体转染试剂盒、通用引物均为Invitrogen公司产品;HSV-2 gD antibody(A 33)(sc-80824)为Santa Cruz公司产品;辣根过氧化物酶(HRP)标记山羊抗小鼠IgG为北京鼎国生物技术有限责任公司产品。1.1.3 引物 引物由上海生物工程技术服务有限公司北京合成部合成,共计4条引物:
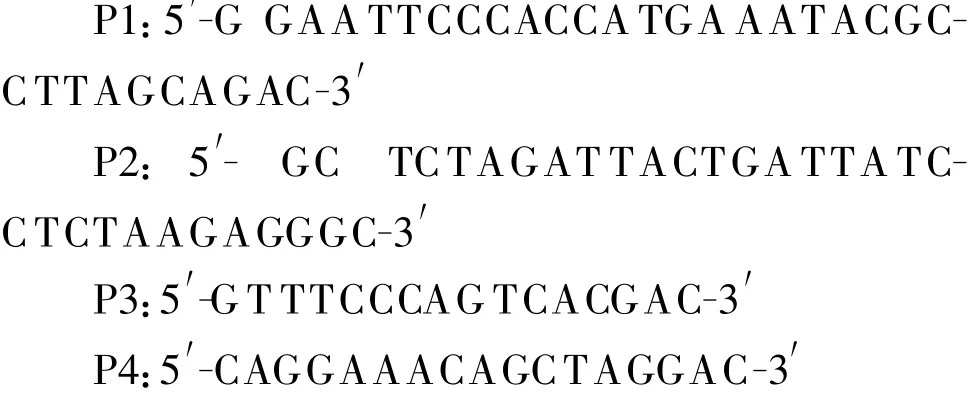
P1与P2为gD特异性引物方框内分别是EcoRⅠ和XbaⅠ酶切位点。P3与P4为通用性引物。
1.2 方法
1.2.1 全病毒DNA提取及gD基因的扩增 生长良好的单层Vero细胞上培养HSV-2 333病毒,病毒收获后取病毒液使用TAKARA公司M iniBEST Viral RNA/DNA Extraction KitVer 3.0试剂盒,参照其提供的说明书提取HSV-2 DNA。取2μL HSV-2 DNA作为模板,用特异性引物P1和P2进行RCR反应:94℃5 min;94℃45 s,55℃45 s,72℃120 s,循环25次;72℃10m in。命名PCR产物为gD,使用宝生物工程(大连)有限公司的胶回收试剂盒回收纯化PCR产物,用10 g/L的琼脂糖凝胶电泳进行鉴定。
1.2.2 重组质粒的获取及鉴定 将gD连接到pMD18T载体上,转化至DH 5αE.coli,保存于-80℃。用Eco RⅠ和XbaⅠ酶对gD和杆状病毒转移载体pFastBacⅠ进行双酶切,然后与从pMD18T-gD上双酶切下的gD进行连接,连接产物转化到DH 5α感受态细胞中。小量提取质粒,利用双酶切方法鉴定、选取阳性克隆,送上海生工生物工程技术服务有限公司测序验证。测序正确后,提取pFast BacⅠ-gD质粒转化DH10Bac感受态细胞,pFastBacⅠ-gD质粒和DH10Bac感受态细胞中的穿梭质粒Bacmid进行转座,产生重组穿梭质粒Bacmid-gD,挑取阳性转座株碱裂解法提取Bacmid-gD,用特异性引物P1/P2以及通用引物P3/P4进行PCR鉴定。
1.2.3 转染及重组杆状病毒的获取与鉴定 转染按照Invitrogen公司Bac-to-Bac·Baculovirus Expression System说明书提供的方法进行。6孔板每孔铺8×105个Sf9细胞,待细胞全部贴壁按质脂体转染法混合8μLCellfectinⅡReagent与1μg重组DNA转染细胞。转染72 h后收集细胞培养上清,用培养上清继续感染细胞,经过3代扩大培养后,收集培养上清作为重组病毒母液,4℃避光保存备用。
1.2.4 重组杆状病毒TCID50的检测 使用半数组织细胞感染量方法测定病毒毒力。测定方法如下,铺一定量的Sf9细胞于96孔板中贴壁,重组杆状病毒连续作10倍稀释从10-1开始同时设空白对照。加入不同稀释度的病毒感染昆虫细胞,27℃作用1 h后,去除含病毒的上清,换上新鲜培养基。27℃培养7 d~10 d,观察细胞病变。
1.2.5 重组蛋白的表达 重组杆状病毒感染培养的Sf9细胞,预设感染指数(multiplicity of infection,MOI)为5,细胞密度为5×105cells/mL,27℃培养72 h,分别收集细胞培养上清和沉淀,将沉淀用预冷的PBS洗涤3次,加入细胞裂解液,30 min内迅速反复冻融3次,于4℃以9 000 r/min离心15m in,将上清收集后于-20℃保存备用。用120 g/L的SDS-PAGE检测细胞裂解后的上清,转到硝酸纤维素膜上,电转条件为90 V、90m in,用含50 g/L脱脂奶粉的TBS缓冲盐溶液(Tris碱3.03 g,NaCl 8.18 g,去离子水定容到1 000mL;pH 7.5)封闭膜2 h。一抗为鼠抗HSV-2单克隆抗体,二抗为1∶6 000倍稀释的辣根过氧化氢酶标记的羊抗鼠IgG。
2 结果
2.1 重组杆状病毒的获得与鉴定
以HSV-ⅡDNA为模板扩增gD基因,10 g/L琼脂糖凝胶电泳显示,得到1条约875 bp的目的片段,大小与预期片段的大小一致,阳性质粒测序鉴定,其结果与预期序列完全一致。杆状病毒重组转移载体pFastBacⅠ-gD双酶切鉴定结果见图1。用通用引物和特异性引物进行PCR鉴定重组杆状病毒穿梭质粒,结果见图1,表明gD基因已经克隆到到杆状病毒穿梭质粒Bacmid中。
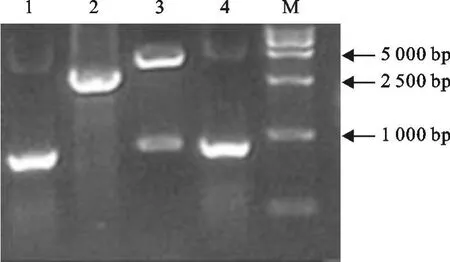
图1 琼脂糖电泳图Fig.1 Agarose gelelectrophoresis of PCR products of gD
2.2 重组杆状病毒转染后细胞病变观察
显微镜观察转染24 h后,细胞停止扩增不再生长。48 h~72 h后细胞直径逐渐变大,细胞核增大且充满整个细胞,随着转染时间延长,细胞边缘渐模糊,96 h后细胞破碎(图2)。由此可见重组病毒转染成功。
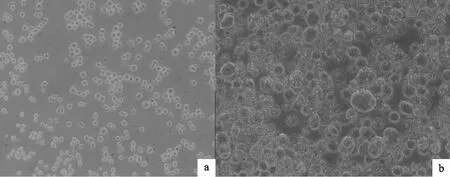
图2 重组杆状病毒感染的细胞病变(200×)Fig.2 CPE of Sf9 cellsafter transfection of recom binant bacm id(200×)
2.3 重组杆状病毒毒力检测
通过观察昆虫细胞病变得到半数细胞感染量,再由此半数细胞感染量结果算出重组杆状病毒毒力为7.5×107pfu/mL(p fu=TCID50×0.69)。
2.4 SDS-PAGE和Western blot检测重组蛋白
细胞感染重组病毒72 h后,收获细胞冻融离心得到上清,用120 g/L分离胶进行SDS-PAGE,试验组与正常细胞无明显差异。Western blot结果表明,重组病毒表达蛋白中有特异性条带出现,结果出现位置35 ku与预期一致(图3)。
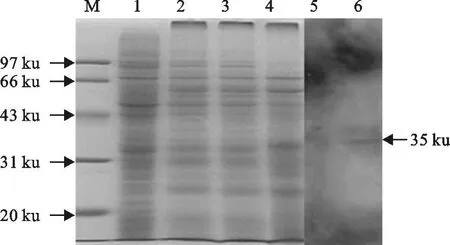
图3 表达产物SDS-PAGE及Western blot试验结果Fig.3 SDS-PAGE and Western blot analysis of products expressed in Sf9 cells
3 讨论
杆状病毒昆虫表达系统是表达外源重组蛋白的主要工具之一,相比于其他表达系统,该系统具有诸多优点,该表达系统能够稳定且高水平的表达外源蛋白[9],其表达的重组蛋白均具有天然活性。首先,此系统不需要多轮筛选纯化重组病毒,显著缩短了工作周期。其次,昆虫细胞要求的培养环境相对宽松,一般实验室都可以满足昆虫细胞生长条件并适于扩大培养。最后,杆状病毒感染具有很强宿主特异性不会形成交叉污染。
Ⅱ型单纯疱疹病毒尚没有上市疫苗,主要是此病毒的致病机制呈现不全,其中包括潜伏机制和复发机制等,成为疫苗研究的障碍。之前的研究多集中体液免疫反应,而临床试验结果陆续证明仅提高体液抗体水平不能全面保护机体不受感染[7-8]。近期不断出现关于细胞免疫方面的报道使单纯疱疹病毒疫苗研制的成功提供又一保证。研究证明糖蛋白D分子具有多个中和抗体表位及细胞免疫反应表位[9-12]。
单纯疱疹病毒糖蛋白D作为病毒进入机体及介导免疫反应的主要靶标分子,已在不同的表达系统进行表达。但大多表达产物都具有H IS之类的外源标签,这对后续疫苗产品的形成带来了储多不便。本试验采用Invitrogen公司已经商业化Bac-to-Bac Baculovirus Expression System表达无标签去除信号肽部分糖蛋白D,经分子水平及蛋白水平的鉴定确有特异性表达。现行病毒毒力的测定多采用空斑试验,但由于此种方法操作较复杂且需时较长,所以本试验使用半数组织细胞感染量的方法,得出病毒毒力。从试验结果看,重组蛋白经各个条件的摸索及优化确有相对较高的表达,这样可以后续试验将继续纯化重组蛋白并对其免疫原性进行一系列评价为进一步研制HSV-2重组蛋白疫苗奠定基础。
[1] Whitley R J,Roizman B.Herpes simplex virus:is a vaccine tenable[J].JClin Invest,2002,110(2):145-151.
[2] Celum C,Wald A,Hughes J,et al.Effect of aciclovir on HIV-1 acquisition in herpes simplex virus 2 seropositive women and m en who have sex with men:a randomized,double-blind,placebo-controlled trail[J].Lancet,2008,371(9630):2109-2119.
[3] Morrison L A.Replication-defective virus vaccine-induced protection ofm ice from genital HSV-2 requires CD4 T cells[J].Virology,2008,376(1):205-210.
[4] Nagot N,Ouedraogo A,Foulongne V,et al.Reduction of HIV-1 RNA levels with therapy to suppress herpes simplex virus[J].N Engl JMed,2007,356(8):790-799.
[5] Stanberry L R,Spruance S L,Cunningham A L,et al.G lycoprotein-D-adjuvant vaccine to prevent genital herpes[J].N Engl JMed,2002,347(21):1652-1661.
[6] Verstraeten T,Descamps D,David M P,et al.Analysis of adverse events of potential autoimmune aetiology in a large integrated safety database of AS04 adjuv anted vaccines[J].Vaccine,2008,26(51):6630-6638.
[7] Koelle D M,Corey L.Recent progress in herpes simplex virus immunobiology and vaccine research[J].Clin Microbiol Rev,2003,16(1):96-114.
[8] Wilson SS,Fakioglu E,H erold BC.Novel approaches in fighting herpes simplex virus infections[J].Anti Infect,2009,7(5):559-568.
[9] Bettabi I,Antbony BN,Yoon S,et al.Protective immunity against ocular herpes infection and disease induced by highly immunogenic self-adjuvanting glycoprotein Dlipopeptide vaccines[J].IOVS,2007,48(10):4643-4651.
[10] Koelle D M,Chen H B,Gavin M A,et al.CD 8 CTL from genital herpes simplex lesions:recognition of viral tegument and immediate early p roteins and ly sis of infected cutaneous cell[J].J Immunol,2001,166:4049-4058.
[11] Mikloska Z,Ruckholdt M,Ghadiminejad I,et al.Monophosphoryl lipid A and QS21 increaseCD8 T lymphocyte cy totoxicity to herpes simplex virus-2 infected cell protein 4 and 27 th rough IFN-gamma and IL-12 production[J].J Immunol,2000,164:5167-5176.
[12] Toka F N,Suvas S,Rouse B T.CD4+CD25+Tcellsregu late vaccine-generated primary and memory CD8+T-cell responses against herpes simplex virus type 1[J].JV irol,2004,78:13082-13089.
