痤疮丙酸杆菌对小鼠抗胸膜肺炎放线杆菌血清 7型 9型的免疫保护
2010-03-02李林溪雷连成何伯萍韩文瑜
李林溪,雷连成,高 宇,何伯萍,韩文瑜
(吉林大学畜牧兽医学院,吉林长春,130062)
猪传染性胸膜肺炎是由胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)引起的一种猪的高度接触传染性、致死性呼吸道传染病[1]。至 20世纪 80年代已在世界各地广泛流行。该病可直接损害猪的肺组织,极易造成病猪继发感染其他呼吸道疾病,对养猪业造成重大的经济损失[2]。发病率高达 40%~80%,死亡率6%~20%[3]。迄今为止,APP共有15个血清型[4],而主要血清型之间缺乏交叉免疫保护,因而疫苗研制受到阻碍[5]。现有的 APP疫苗均不能产生令人满意的、覆盖多个血清型的免疫保护作用。在本研究的前期工作中,在研究 APP血清 1型与 5型的差异表达蛋白过程中,发现多个差异蛋白的编码基因与痤疮丙酸杆菌(PA)基因组存在同源序列,同时 ELISA检测表明 PA与 APP存在交叉免疫反应。提示出 PA具有异源免疫保护 APP的作用。经实验证实,PA免疫小鼠 4周后,可产生抗 APP血清 1型和 5型的抗体。应用 APP血清 1型和 5型攻毒,7 d后保护率分别为 95%和 90%,表明 PA对 1型和 5型 APP具有显著保护。特别是抗 PA高免血清,对 APP攻毒小鼠的保护率达到100%[6]。应用于猪体的实验表明,于非特异性免疫刺激剂黄芪多糖免疫相比,免疫 PA组死亡率显著下降,肺损伤系数降低,可产生显著的抗 APP抗体。笔者用 PA活菌及猪抗 PA血清免疫小鼠后,进行APP血清 7型和血清 9型的攻毒实验,同时测定 PA诱导小鼠产生抗 APP血清 7型和 9型的特异性抗体水平,以期研究 PA对 APP血清 7型和血清 9型的异源免疫保护作用。
1 材料和方法
1.1 菌株及血清
PA分离株 S14,由本校微生物与免疫实验室分离并保存。APP血清 7型(CVCC-265),APP血清 9型 APPS5(CVCC-267)标准菌株购自中国兽医微生物菌种保藏管理中心。猪抗 PA分离株 S3血清由本校微生物与免疫实验室制备并保存。
1.2 实验动物
昆明小鼠,雌雄各半,6~8周龄,体重 18~22 g,购自长春高新医学动物实验研究中心。饲养条件符合吉林大学实验动物饲养管理相关规定。
1.3 试剂与仪器
BHI培养基(BD,UK);厌氧培养基胰酪解蛋白胨 2 g;酵母浸膏 1 g;葡萄糖 0.6 g;大豆胨 1 g;L-半胱氨酸盐酸 0.06 g;NaCl 1 g;吐温-80 0.2 g;蒸馏水 200mL;羊抗鼠二抗购于中杉金桥公司;厌氧培养箱(Don Whitley,UK)。
1.4 PA免疫小鼠抗 APP感染小鼠试验
昆明小鼠分成 4组,每组 10只。实验组为第 1组、第 2组;对照组为第 3组、第 4组。第 1组、第 2组小鼠腹腔注射分离得到的 PA分离株 S14,每只 0.2mL(8×109 CFU),第 3组、第 4组小鼠腹腔注射生理盐水,每只注射 0.2 mL。
将 APP菌接种于 BHI液体培养基,在 37℃培养 6~8 h,用生理盐水洗涤菌体 3次,恢复原体积,测定 OD值,参照 OD值与活菌计数的关系,确定活菌浓度。在首次免疫后的第 17天,第 1组、第 3组用10倍 LD50的 APP血清 7型攻毒,每只小鼠腹腔接种 0.2 mL,约含菌为 8×107CFU;第 2组、第 4组用 10倍 LD50的 APP血 9型攻毒,每只小鼠腹腔接种 0.2mL,约含菌为 7×107CFU。攻毒后每 6 h观察 1次,观察 3 d。
1.5 PA免疫小鼠诱导特异性抗 APP血清 7型、9型抗体检测
免疫后第 16天,分别将 PA,S14,APP血清 7型,APP血清 9型菌体超声裂解,工作时间 20 min,离心 5 000 r/min 5min,取上清留作包被抗原。用包被液 50倍稀释抗原,每孔加样 100μL,4℃过夜包被 ELISA反应板,进行血清抗体检测。每组随机抽检 4只,用毛细管从小鼠眼角采血 20μL,制备血清后,测定其对PA和 APP血清 7型、9型的抗体效价,方法参照 Lei等[6]文章,取其均值作为各小组抗体效价。
1.6 抗 PA血清免疫小鼠后抗 APP感染
将质量 18~20 g的昆明小鼠分成 4组,每组 10只,雌雄各半,实验 5组、6组注射抗 PA血清(免疫猪制备)0.5 mL/只,阴性对照组 7组、8组每只注射生理盐水 0.5m L。免疫后 3 h,第 5组、第 7组用 10倍 LD50的 APP血清 7型攻毒,每只腹腔接种 0.2mL,约含菌为 8×107CFU;第 6组、第 8组用 10倍 LD50的 APP血 9型攻毒,每只腹腔接种 0.2m L,约含菌为 7×107CFU。攻毒后每 6 h观察 1次,观察 3 d。
2 结 果
2.1 小鼠攻毒保护率
小鼠免疫及攻毒后死亡结果见表 1。免疫 PA分离株 S14后,应用 APP血清 7型攻毒,观察 3 d后保护率为 60%;应用 APP血清 9型攻毒,保护率达 70%。说明PA异源免疫小鼠后,可对 APP多个血清型(1,5,7,9)提供有效的免疫保护。小鼠免疫猪抗 PA血清后,对 APP血清 7型、9型感染产生了较强的抵抗力,在 3 d的观察时间内无一死亡,保护率达 100%。说明 PA可能诱导动物机体产生抗 APP的特异性抗体。
2.2 血清效价
PA分离株 S14免疫小鼠后,可产生对 APP血清 7型、9型的特异性抗体(表 2)。其中抗 APP血清7型平均抗体效价达1 800,抗 APP血清 9型平均抗体效价达 2 800。说明 PA免疫后可诱导小鼠产生对抗 APP感染的特异性体液免疫应答。

表 1 动物保护实验结果
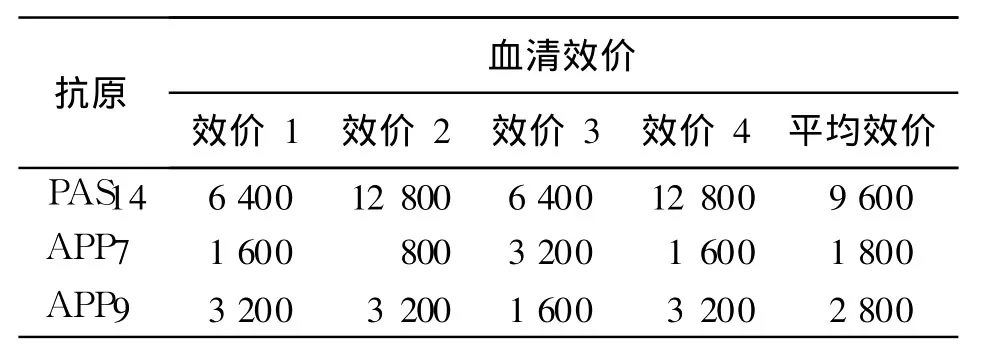
表 2 血清效价实验结果
3 讨 论
痤疮丙酸杆菌(Propionibacterium acnes)是自然界中的常见微生物,与人类痤疮炎症的发生有关[7],具有增强宿主细胞对入侵病原应答效果的作用,与机体呈共生关系[8]。PA可非特异性的提高动物的免疫水平,增强动物对寄生虫[9]、细菌[10]、病毒[11]等多种病原微生物的抵抗力。作为动物的非特异性免疫刺激剂已有商品化产品问世[12],在科研中用于建立非特异性免疫应答的动物模型[13]及免疫佐剂[14]。但迄今为止仍无 PA用于特异性异源免疫的其他报道。
本课题组对 PA诱导小鼠及猪只产生对 APP的特异性免疫保护进行了多项研究,现已证明 PA免疫小鼠[15]或猪只[6]后,对 APP 1型及 5型感染均有显著的免疫保护作用,具有开发为异源疫苗或其他相关生物制品的潜力。本次研究进一步证明了 PA对 APP其他血清型同样具有显著的免疫保护作用,为解决 APP多血清型之间无有效的交叉抗原这一一直困扰疫苗开发工作的难题提供了新的解决思路。同时,PA诱导特异性免疫保护的机理以及免疫保护有效成分的分离和鉴定将是下一步研究的着眼点。
[1] PATTISON IH,HOWELL D G,ELLIOT J.A haemophilus-like organism isolated from pig lung and the associated pneumonic lesions[J].JComp Pathol,1957,67(4):320-330.
[2] LOSINGER W C.Economic impacts of reduced pork production associated with the diagnosis of Actinobacillus p leuropneumoniae on grower/finisher swine operations in the United States[J].Prev VetMed,2005,68(2-4):181-93.
[3] WOESTE K,GROSSE B E.Transmission of agents of the porcine respiratory disease comp lex(PRDC)between swine herds:a review.Part 1--diagnosis,transmission by animal contact[J].Dtsch Tierarztl Wochenschr,2007,114(9):324-326;328-337.
[4] BLACKALL P J,KLAASEN H L,VANDEN BOSCH H,etal.Proposalof a new serovar of Actinobacillus p leuropneumoniae:serovar 15[J].VetMicrobiol,2002,84(1-2):47-52.
[5] BEIW,HE Q,YAN L,et al.Construction and characterization of a live,attenuated apxIICA inactivation mutant of Actinobacillus pleuropneumoniae lacking a d rug resistance marker[J].FEMSMicrobiol Lett,2005,243(1):21-27.
[6] LEI L,SUN C,LU S,et al.Selection of serotype-specific vaccine candidate genes in Actinobacillus pleuropneumoniae and heterologous immunization with Propionibacterium acnes[J].Vaccine,2008,26(49):6 274-6 280.
[7] TH IBOUTOT D M.Overview of acne and its treatment[J].Cutis,2008,81(1Supp l):3-7.
[8] COGEN A L,NIZET V,GALLO R L.Skin microbiota:a source of disease or defence?[J].Br JDermatol,2008,158(3):442-455.
[9] CLARK IA,COX F E,ALLISON A C.Protection ofmice against Babesia spp and Plasmodium spp with killed Corynebacterium parvum[J].Parasitology,1977,74(1):9-18.
[10] DINSMORE R P,CATTELL M B,STEVENS RD,etal.Efficacy of a Propionibacterium acnes immunostimulant for treatment of chronic Staphylococcus aureusmastitis[J].JDairy Sci,1995,78(9):1 932-1 936.
[11] MEGID J,CREMONINID N,LEOMIL H.Distribution of rabies virus in infectedm ice,vaccinated and subm itted to P acnes as immunomodulator[J].Comp Immunol Microbiol In fect Dis,2002,25(4):237-248.
[12] FLAMINIO M J,RUSH BR,SHUMANW.Immunologic function in horses after non-specific immunostimu lant administration[J].Vet Immunol Immunopathol,1998,63(4):303-315.
[13] ISEKIH,TAKABATAKE N,OTA N,et al.Babesia:the p rotective effects of killed Propionibacterium acnes on the in fections of two rodent Babesia parasites in mice[J].Exp Parasitol,2008,118(4):543-548.
[14] VILELA M C,GOMESD C,MARQUESDA S E A,et al.Successful vaccination against Leishmania chagasi infection in BALB/c mice with freeze-thawed Leishmania antigen and Corynebacterium parvum[J].Acta Trop,2007,104(2-3):133-139.
[15] 杨鹏,雷连成,谢芳,等.痤疮丙酸杆菌对小鼠抗胸膜肺炎放线杆菌感染的研究[J].中国预防兽医学报,2009,31(8):596-599.
(责任编辑:朱宝昌)
