离子液体催化合成食用香料乳酸乙酯的研究
2010-02-27张小曼
张小曼
(昆明学院 化学科学与技术系,云南 昆明 650031)
乳酸乙酯为无色透明液体,具有特殊的水果、奶油和郎姆酒香味,是我国GB2760-86规定允许使用的食用香料,广泛用作食品、饮料、牛奶、奶油和酒类的调香剂,也可做涂料、油漆、树脂和硝化纤维的溶剂[1]。乳酸乙酯在工业上常用硫酸催化法生产,该方法存在设备腐蚀严重,后处理工艺复杂,废液排放量大,原料利用率低等缺点。因此,开发低成本,无污染、环境友好的催化剂已成为合成香料研究的热点问题。离子液体是由有机阳离子和无机或有机阴离子构成的在室温下呈液态的盐。离子液体中阴、阳离子的修饰和嫁接不同官能团,可赋予离子液体特殊的功能。酸性功能化离子液体应用于酯化反应有较好的催化活性[2-4]。本实验制备了1-磺酸丙基-3-甲基咪唑硫酸氢盐([HSO3-pmim]HSO4)酸性离子液体,应用于催化合成乳酸乙酯的反应中,考察了离子液体的催化活性及乳酸乙酯的最佳合成条件,为食用香料乳酸乙酯的化工生产提供可借鉴的实践经验。
1 实验部分
1.1 主要仪器与试剂
508-B型红外光谱仪(PE);INOVA-300H型核磁共振仪(Varian);WAY-1S阿贝折射仪(上海光学仪器厂);SP-501N气相色谱仪(山东鲁南化工仪器厂)。
N-甲基咪唑(纯度≥98%,浙江宁海市凯乐化工厂);1,3-丙烷磺酸内酯、1-氯正丁烷、四氟硼酸钠、乳酸、乙醇、甲苯、乙醚、H2SO4均为化学纯,北京化学试剂厂生产。
离子液体[bmim]BF4、[bmim]HSO4参考文献[5]方法制备。
1.2 [HSO3-pmim]HSO4离子液体的制备
将1,3-丙烷磺酸内酯溶于甲苯中,磁力搅拌下滴加等物质的量的N-甲基咪唑,滴完后缓慢升温至80℃,继续反应2h,析出白色沉淀,过滤,用乙醚洗涤3次,100℃真空干燥,得到[MIM-PS](1-磺酸丙基-3-甲基咪唑盐)。
将[MIM-PS]溶于水中,磁力搅拌下滴加等物质的量的硫酸,滴完后缓慢升温至80℃,继续反应2h,用乙醚洗3次,真空除水3h,得到[HSO3-pmim]HSO4(1-磺酸丙基-3-甲基咪唑硫酸氢盐)。总反应式:
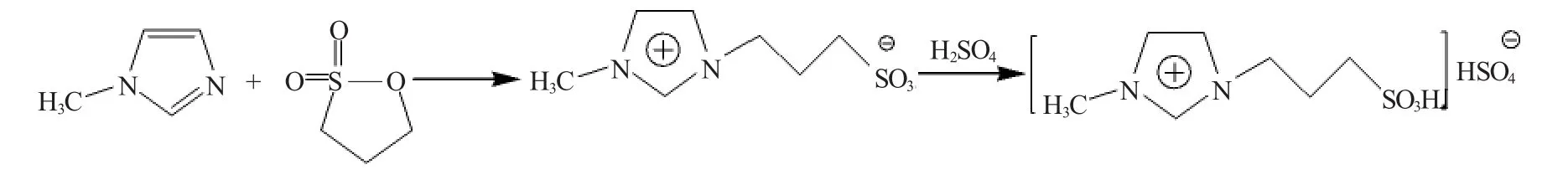
1.3 乳酸乙酯的合成
在装有分水器、温度计和回流冷凝器的三口烧瓶中加入一定量的[HSO3-pmim]HSO4、乳酸、乙醇,磁力搅拌加热回流分水,反应结束后静置冷却,离子液体与乳酸乙酯分层,倾出酯层,取样测定其酸值。采用国家标准提供方法测定反应前后酸值的变化[6],计算酯化率:
所得粗酯用10%Na2CO3溶液洗,再分别用饱和NaCl溶液、蒸馏水洗至中性,分出水层后,经无水MgSO4干燥后,转入蒸馏烧瓶中,常压下蒸馏出未反应的乙醇后减压蒸馏收集61~63℃(2.5kPa)的馏分为产品。

2 结果与讨论
2.1 [HSO3-pmim]HSO4的结构表征
[MIM-PS]的结构表征:1H NMR(300MHz,D2O),δ2.26(m,2H),2.86(t,2H),3.83(s,3H),4.30(t,2H),7.38(s,1H),7.46(s,1H),8.70(s,1H)。IR(KBr),ν/cm-1:3450,3154,3110,2962,1640,1575,1195,1043,746,622,532。
[HSO3-pmim]HSO4的结构表征:1HNMR(300MHz,D2O),δ2.11(m,2H),2.71(t,2H),3.71(s,3H),4.16(t,2H),7.25(s,1H),7.32(s,1H),8.53(s,1H)。IR(KBr),ν/cm-1:3437,3154,2970,1722,1653,1574,1230,11 72,1029,835,582。
以上数据表明与目标离子液体结构相符[7]。
2.2 不同催化剂催化活性的对比
考察不同离子液体对乳酸乙酯合成的催化性能,实验条件为:0.2mol乳酸、0.3mol乙醇、反应时间2.0h,分别加入不同离子液体进行实验,结果见表1。

表1 不同离子液体对酯化率的影响Tab.1 Effect of different ionic liquid on the esteriffication rate
由表1可知,3种离子液体对酯化反应均有良好的催化活性。其中以[HSO3-pmim]HSO4催化活性最好,[bmim]HSO4次之。酯化反应属于酸催化机理的反应,离子液体中阳离子相同时,阴离子的酸性:催化活性:[bmim]HSO4>[bmim]BF4;阴离子相同时,阳离子中咪唑烷基磺酸基化后,对催化活性有增强作用。因此,[HSO3-pmim]HSO4是催化合成乳酸乙酯的优良催化剂。
2.3 乳酸乙酯合成条件的优化
为获得最佳合成条件,以酯化率为考察目标,固定乳酸用量0.2mol,选择酸醇摩尔比、离子液体([HSO3-pmim]HSO4)用量、反应时间和反应温度为考察因素,采用四因素三水平进行L9(34)正交实验,因素与水平的选择见表2,正交实验结果见表3。

表2 因素水平表Tab.2 Factors and levels of test

表3 L9(34)正交实验方案和结果Tab.3L9(34)orthogonal design experiment and results
由表3可知,各种因素对酯化率的影响程度为:酸醇摩尔比(A)>离子液体用量(B)>反应温度(D)>反应时间(C),即酸醇摩尔比对酯化率的影响最大,离子液体用量、反应温度影响次之,反应时间影响最小。其最佳合成条件为:A2B3C2D2,即乳酸 0.2mol、乙醇 0.3mol、离子液体 10mL、反应时间2.0h,反应温度110℃,酯化率较高。
2.4 最优合成条件的验证
在正交实验结果得出的A2B3C2D2最优合成条件下进行平行实验5次,结果见表4。

表4 最佳反应条件的重复实验Tab.4 The confirmation of the optimum reaction conditions
由表4可见,在此合成条件下,不仅酯化率高,而且重现性好,平均酯化率达96.6%,该合成条件可行。
2.5 离子液体[HSO3-pmim]HSO4重复使用性能的考察
酯化反应结束后,将分离出的离子液体蒸馏除水后,用于下次反应中,按上述最优合成条件对催化剂重复使用性能进行实验,结果见表5。

表5 [HSO3-pmim]HSO4重复使用对酯化率的影响Tab.5 Effect of repeated use of[HSO3-pmim]HSO4on the esteriffication rate
由表5可见,离子液体重复使用6次,平均酯化率为96.3%,仍保持良好的催化活性,可以重复使用。
2.6 产品分析
上述方法所得产品为无色透明液体,有特殊的奶油、酒的香味,沸点 154.0℃(101.3kPa),相对密度1.042(20℃),其折光率与乳酸乙酯的文献值相符[1]。在产品红外光谱图中有:C-H键2960cm-1,2876cm-1,C=O键 1735cm-1,C-O 键 1132cm-1的特征吸收峰,与乳酸乙酯标准谱图相符,所得产品为乳酸乙酯,其含量>99%(气相色谱仪分析)。
3 结论
酸性离子液体[HSO3-pmim]HSO4是合成乳酸乙酯反应的良好催化剂,其具有不挥发无污染、催化活性好的特点。离子液体与产物乳酸乙酯不溶,易分离,经简单处理后可重复使用,经济成本较低。实验表明:0.2mol乳酸、0.3mol乙醇、10mL[HSO3-pmim]HSO4,反应时间2.0h,酯化率达96.7%。
酸性离子液体作为一种新型的催化剂,在合成香精、香料的酯化反应中应有很好的应用前景。
[1]凌关庭,唐述潮.食品添加剂手册(第二版)[M].北京:化学工业出版社,1997.372-373.
[2]邓友全.离子液体-性质、制备与应用[M].北京:中国石化出版社,2006.3-8.
[3]岳彩波,魏运祥,吕敏杰.新型酸性离子液体[Hmim]HSO4中合成乙酸酯[J].应用化学,2006,23(11):1282-1285.
[4]刘明灯,赵文军,杨丹红,等.高活性Bronsted离子液体催化酯化反应[J].化学试剂,2007,29(10):587-589.
[5]卢泽湘,袁霞,吴剑,等.咪唑类离子液体的合成和光谱表征[J].化学世界,2005,(3):148-150.
[6]中国标准出版社.化学工业标准汇编-化学助剂[M].北京:中国标准出版社,1996.
[7]丛晓辉,桂建舟,陈晓梅,等.SO3H-离子液体催化苯酚和叔丁醇选择性烷基化反应[J].石油化工高等学校学报,2005,18(2):1-4.
