骨形态发生蛋白在乳腺癌增殖、转移中作用的初步筛选
2010-02-10黄佳祎印国兵孙治君
郭 丹,黄佳祎,印国兵△,孙治君
(重庆医科大学:1.第二附属医院普外科 400010;2.第一附属医院内分泌科 400016)
骨形态发生蛋白在乳腺癌增殖、转移中作用的初步筛选
郭 丹1,黄佳祎2,印国兵1△,孙治君1
(重庆医科大学:1.第二附属医院普外科 400010;2.第一附属医院内分泌科 400016)
目的筛选获得可能与乳腺癌骨转移密切相关的骨形态发生蛋白(BMPs),为后期进一步研究乳腺癌骨转移的机制奠定基础。方法收集10种不同的人乳腺癌细胞株,RT-PCR检测14种BMPs的表达。选择表达频率和水平较高的BMPs,以腺病毒为介导感染高转移性的人乳腺癌细胞株MDA-M B-231。用细胞生长曲线、划痕修复实验及Transwell细胞侵袭实验等检测其增殖、运动和侵袭能力的改变。结果在10种不同的人乳腺癌细胞株中,BMPs普遍表达,其中 BMP2、4、7、11表达频率和水平较高。以腺病毒BM P2、4、7、11感染高转移性的人乳腺癌细胞株 MDA-MB-231,生长曲线结果显示 BMP2组和 BMP4组生长曲线向左上移位,而BMP7组和BMP11组向右下移位;划痕修复实验提示BM P2组和BMP4组划痕愈合提前,而BMP7组和BMP11组延迟;与空病毒组(105±7.0)相比,BMP2组(125±10.0)和BMP4组(130±12.5)穿膜细胞数增加,而 BMP7组(82±5.0)和 BMP11组(71±9.5)的穿膜细胞数显著降低,差异有统计学意义(P<0.05)。结论BMPs与乳腺癌的发生和转移密切相关,尤其是 BMP2、4、7、11值得进一步关注 。
骨形态发生蛋白;乳腺癌;骨转移
乳腺癌是威胁妇女健康最常见的恶性肿瘤之一。全球每年新发病例100万,中国至少占15万。随着治疗水平的不断提高,乳腺癌的预后已获得很大改善,但仍约有65%~75%的患者会发生骨转移,严重影响患者的生活质量。目前对骨转移的治疗主要采用双膦酸盐类抑制破骨细胞的形成和功能,预防和治疗骨相关事件。尽管如此,乳腺癌骨转移的疗效并不十分理想,机制也不完全清楚。而双膦酸盐类可能引起下颌骨骨坏死也逐渐引起重视[1]。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是转化生长因子β超家族的成员之一,最初因其能诱导骨和软骨的形成而得名,对骨骼的胚胎发育和再生修复起重要作用。随着研究的深入,发现BM Ps参与调节多种细胞的增殖、分化和凋亡的生物学过程,在胚胎发育、出生后各组织器官内环境稳定及多种肿瘤的发生中都有重要作用,尤其与肿瘤的骨转移密切相关。而乳腺癌因其常伴发骨转移,提示BMPs在其发生中可能具有重要作用。作者初步筛选了14种BMPs对乳腺癌增殖、迁移的影响,拟找出与乳腺癌发生密切相关的BMP亚型,为下一步深入研究其作用机制,提供新的药物靶点打下基础。
1 材料与方法
1.1 材料 10种人乳腺癌细胞株及相关腺病毒为美国芝加哥大学分子肿瘤实验室馈赠,RT及PCR相关试剂、DNA Marker、T RIzol为 TakaRa产品,细胞培养相关试剂为 Hy-Clone产品,Transwell小室为 Millipore公司产品,人工基质胶(ECM)为 Sigma公司产品。
1.2 实验方法
1.2.1 RT-PCR检测14种BMPs在不同人乳腺癌细胞株中的表达 分别接种10种不同的人乳腺癌细胞株于T-25细胞培养瓶,待细胞融合度达70%~80%时收集细胞,Trizol法提取总RNA,RT-PCR试剂盒逆转录获得cDNA。半定量PCR检测相关目的基因的表达,并以GAPDH作为内参进行结果校正(表1)。

表1 引物序列
PCR 反应采用20 μ L 体系:上下游引物(10 μ mol/L)各0.2 μ L,模 板 2 μ L,dNTP mix(10 mmol/L)0.4 μ L,Taq 酶 2 μ L,10×PCR buffer 2μ L,MgCl225 mmol/L 1.2 μ L,灭菌双蒸水13.8 μ L。循环条件为 94℃预变性 5 min,94℃、30 s,55℃、30 s,72℃、40 s,共28个循环;最后72℃延伸5 min。
1.2.2 划痕修复实验 接种人乳腺癌细胞株MDA-MB-231于6孔细胞培养板,选择表达频率和水平较高的 BM P2、4、7、11分别以腺病毒为介导感染细胞株,观察感染效率一致。常规胰酶消化,重新种植细胞于预放“+”形划痕架的6孔细胞培养板,分别于接种后4、16、24 h观察划痕的愈合情况。
1.2.3 生长曲线 接种人乳腺癌细胞株MDA-MB-231于T-25细胞培养瓶,分别感染腺病毒 Ad-GFP、Ad-BMP2、Ad-BMP4、Ad-BM P7、Ad-BMP11,检测荧光表达率一致。消化吹打细胞至单细胞悬液并以20%~30%的密度接种于24孔细胞培养板,分5组,每组3个复孔,连续计数5 d。
1.2.4 T ranswell细胞侵袭实验 Transwell小室中加入32 μ L ECM胶(用6倍体积的无血清DMEM稀释),过夜凝固。人乳腺癌细胞株M DA-M B-231分别感染腺病毒Ad-GFP、Ad-BMP2、Ad-BM P4、Ad-BMP7、Ad-BMP11,荧光表达率一致。常规消化细胞后计数,调整密度为 2.5×105/mL,取 400 μ L加入上室中;在下室中加入 600 μ L含20%FBS的 DM EM 培养液。每组设3个平行样本,置37℃、5%CO2细胞培养箱内培养24 h。小心取出上室,吸尽上室内液体,用湿棉签擦去膜上面未穿过膜的细胞,风干后以无水乙醇固定20 min,苏木精染色。显微镜下观察、计数穿膜细胞数。
1.3 统计学方法 采用SPSS13.0统计软件进行统计学分析,计量数据采用x±s表示,组间差异采用成组设计t检验。
2 结 果
2.1 BM Ps在不同人乳腺癌细胞株中的表达 经半定量RTPCR检测相关目的基因的表达,并以GAPDH作为内参进行结果校正(图1)。结果可见,在所有的乳腺癌细胞株中BM Ps普遍表达,其中BMP2、4、7、11表达频率和水平较高。
2.2 划痕修复实验 选择表达频率和水平较高的BMP2、4、7、11,分别以腺病毒为介导感染人乳腺癌细胞株MDA-MB-231,于 4、16、24 h观察划痕的愈合情况(图2)。结果可见,与空病毒组相比,Ad-BMP2组和Ad-BMP4组划痕愈合提前,而Ad-BMP7组和Ad-BM P11组愈合延迟(实验重复3次)。说明BMP2和BMP4有促进细胞迁移的趋势,而BM P7和BM P11有抑制的趋势。

图1 RT-PCR检测BMPs在不同人乳腺癌细胞株中的表达

图2 24 h后划痕修复情况(LM×100)

图 3 生长曲线检测 BMPs对MDA-MB-231细胞株增殖的影响
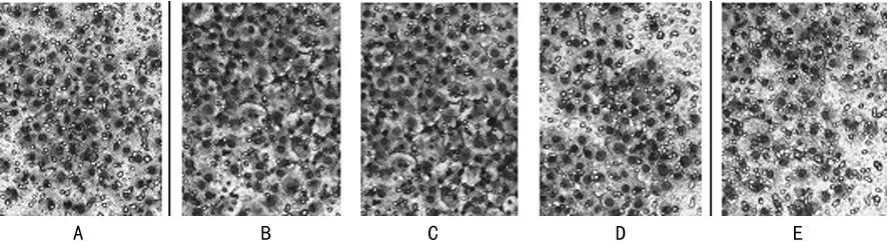
图4 Transwell细胞侵袭实验(LM×200)
2.3 生长曲线 见图3,经腺病毒 BMP2或BMP4感染后,细胞对数生长期前移,平台期水平升高;而BM P7或BM P11感染后,细胞生长曲线向右下移动,细胞增殖被抑制(P<0.05)。
2.4 T ranswell细胞侵袭实验 与空病毒组(105±7.0)相比,BMP2组(125±10.0)和 BMP4组(130±12.5)穿膜细胞数增加,差异有统计学意义(P<0.05),而 BMP7组(82±5.0)和BMP11组(71±9.5)穿膜细胞数显著降低,差异也有统计学意义(P<0.05),见图4。
3 讨 论
乳腺癌骨转移是晚期乳腺癌常见的并发症,严重影响了患者的生存期和生活质量。早期的研究发现BM Ps信号途径在乳腺癌中表达活跃,提示可能与乳腺癌的骨转移密切相关,但机制并不十分清楚[2]。不同的BMPs亚型具有不同的作用。有研究提示,在前列腺肿瘤中,BMP2和BMP6可促进肿瘤细胞的迁移和骨转移[3-4],而BMP9可抑制癌细胞的增殖、迁移和浸润[5]。对乳腺癌的研究发现,不同的BMPs在乳腺癌中的表达水平和功能差异也很大,其中BMP4和BM P7尤其值得重视[6]。杨光等[7]研究发现BMP2在乳腺癌微钙化形成中发挥了重要调控作用。另外,BMP2可通过激活ID1和P38通路促进肿瘤的血管生成[8],对MCF7乳腺癌细胞株有促进转移和浸润的作用[9]。BMP6和BMP7可通过抑制P38信号途径和类固醇硫酸酯的表达来抑制由雌激素介导的乳腺癌细胞的增殖[10],同时,BM P6还可通过减少 deltaEF1的表达抑制MDA-MB-231细胞的转移性[11]。
综上所述,尽管近年来对BMPs在乳腺癌骨转移中的作用有一定的研究,但机制仍不十分清楚。为进一步全面了解各种BMPs在乳腺癌骨转移中的作用,作者广泛筛选了BMPs在多种乳腺癌细胞株中的表达,以期找到与乳腺癌骨转移密切相关的BM Ps亚型,为进一步研究乳腺癌骨转移的机制打下基础。
在该实验中,作者广泛检测了10种人乳腺癌细胞株中BMPs的内源性表达。结果发现在10种人乳腺癌细胞株中BMPs普遍表达,其中 BMP2、4、7、11表达频率和水平较高。这也与Alarmo等[6]的研究相一致。在此基础上,作者构建了腺病毒 Ad-BMP2、Ad-BMP4、Ad-BMP7、Ad-BM P11 分别感染高转移性的人乳腺癌细胞株MDA-MB-231,生长曲线、划痕实验和Transwell细胞侵袭实验提示BM P2和BM P4有促进乳腺癌细胞增殖、迁移和侵袭能力的趋势,而BMP7和BMP11有抑制乳腺癌细胞增殖、迁移和侵袭能力的趋势。该结果说明BMPs在乳腺癌的发生和转移中具有重要的作用,尤其是BMP2、BMP4、BMP7、BMP11 值得进一步的关注。
在下一步实验中,将集中研究 BM P2、BM P4、BMP7、BMP11对乳腺癌细胞增殖、分化和恶性转移等的影响。并进一步研究其作用机制,如对破骨细胞的形成和功能影响,对肿瘤相关基因、黏附因子等表达的影响。该研究有助于阐述BMPs与乳腺癌骨转移发生的关系,为乳腺癌骨转移的治疗和预防提供新的靶点。
[1] Walter C,Al-Nawas B,du Bois A,et al.Incidence of bisphosphonate-associated osteonecrosis ofthe jaws in breast cancer patients[J].Cancer,2009,115(8):1631.
[2] Katsuno Y,Hanyu A,Kanda H,et al.Bone morphogenetic protein signaling enhances invasion and bone metastasis of breast cancer cells through Smad pathway[J].Oncogene,2008,27(49):6322.
[3] Dai J,Keller J,Zhang J,et al.Bone morphogenetic protein-6 promotes osteoblastic prostate cancer bone metastases through a dual mechanism[J].Cancer Res,2005,65(18):8274.
[4] Graham TR,Odero-Marah VA,Chung LW,et al.Abdel-Mageed,PI3K/Akt-dependent transcriptional regulation and activation of BMP-2-Smad signaling by NF-kappa B in metastatic prostate cancer cells[J].Prostate,2009,69(2):168.
[5] Ye L,Kynaston H,Jiang WG.Bone morphogenetic protein-9 induces apoptosis in prostate cancer cells,the role of prostate apoptosis response-4[J].Mol Cancer Res,2008,6(10):1594.
[6] Alarmo EL,Kuukasä rvi T,Karhu R,et al.A comprehensive expression survey of bone morphogenetic proteins in breast cancer highlights the importance of BMP4 and BMP7[J].Breast Cancer Res Treat,2007,103(2):239.
[7] 杨光,张祥宏,张静,等.BMP-2在乳腺癌组织中的表达及其与OPN、ON表达和微钙化的关系[J].临床放射学杂志,2007,26(4):347.
[8] Raida M,Clement JH,Leek RD,et al.Bone morphogenetic protein 2(BM P-2)and induction of tumor angiogenesis[J].J Cancer Res Clin Oncol,2005,131(11):741.
[9] Clement JH,Raida M,Sänger J,et al.Bone morphogenetic protein 2(BMP-2)induces in vitro invasion and in vivo hormone independent growth of breast carcinoma cells[J].Int J Oncol,2005,27(2):401.
[10]Takahashi M,Otsuka F,Miyoshi T,et al.Bone morphogenetic protein 6(BMP6)and BMP7 inhibit estrogen-induced proliferation of breast cancer cells by suppressing p38 mitogen-activated protein kinase activation[J].J Endocrinol,2008,199(3):445.
[11]Yang S,Du J,Wang Z,et al.BMP-6 promotes E-cadherin expression through repressing deltaEF1 in breast cancer cells[J].BMC Cancer,2007,7:211.
Screen of BMPs in metastasis and proliferation of human breast cancer
GUODan1,HUANGJ ia-Yi2,Y IN Guo-bing1△,et al.
(1.Departmentof General Surgery,the Second Af filiated Hospital,Chongqing400010,China;2.Department of Zndocrinology,The1nd Af filiated Hospital,Chongqing Medical University,Chongqing400016,China)
ObjectiveTo screen and identify the role of Bone Morphogenetic Proteins(BMPs)in metastasis and proliferation of human breast cancer.MethodsThe expressions of BM Ps in 10 kinds of human breast cancer cell lines were evaluated by RT-PCR.Then the BM Ps expressing at high level or high frequency were chosen to be overexpressed in human breast cancer cell line MDAMB-231 by adenovirus infection.growth curve,wound-healing experiment and Matrigel invasion assays were performed to study the changes of proliferation,movement and invasion.ResultsBMPs expressed extensively in 10 kinds of human breast cancer cell lines,especially in BM P2,BMP4,BMP7 and BMP11.After infected with Ad-BM P2 or Ad-BMP4,the proliferation of MDA-MB-231 was induced,while reduced in BMP7 and BMP11 group.Wound healing assays showed that the migrated cells increased in BMP2 and BMP4 group and decreased in BMP7 and BM P11 group.Compared with GFP group(105±7.0),the invasive ability of MDA-MB-231 cells was enhanced in BMP2 and BMP4 group(125±10.0 vs 130±12.5)and inhibited in BM P7 and BM P11 group(82±5.0 vs 71±9.5).ConclusionBMPs have closed relationship with the tumorigenesis of human breast cancer,especially BMP2,BMP 4,BMP7,BMP 11.
bone morphogenetic proteins;breast cancer;osseous metastasis
R737.9;R73-37
A
1671-8348(2010)07-0807-03
△通讯作者。
2009-09-23
2009-12-23)
◦论 著◦
