生产聚羟基脂肪酸酯的微生物细胞工厂
2010-02-09李正军魏晓星陈国强
李正军,魏晓星,陈国强
清华大学生命科学学院,北京 100084
聚羟基脂肪酸酯 (Polyhydroxyalkanoates,PHA)是一类广泛存在于微生物细胞内的高分子生物聚酯,一般主要作为碳源和能量的贮藏物质[1-2]。储存型的PHA以疏水性颗粒的形式存在,在一定条件下其含量可以超过细胞干重的 90%[3]。从化学结构上讲,PHA是羟基脂肪酸 (Hydroxyalkanoic acid,HA)的聚合物,结构通式如图 1所示,分子量一般为几万至几百万,不同的PHA及其单体具有不同的侧链R基团。根据单体组成的不同,PHA具有从坚硬质脆的硬塑料到柔软的弹性体等一系列不同的材料学性质。PHA可以由生物可再生资源为原料合成,进入自然界后可以被细菌等生物完全降解,其替代传统的不可降解的塑料可以缓解严重的“白色污染”问题,从而引起世界各国科学界和工业界的广泛重视[4-6]。
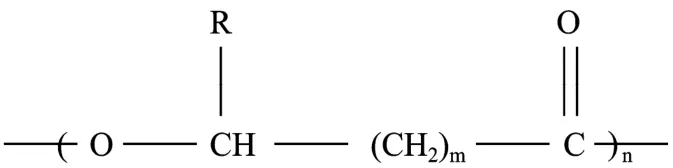
图1 PHA的结构通式Fig. 1 General structure of polyhydroxyalkanoates. m=1−4, n=100−30 000, R=alkyl groups C1∼C15.
1 野生菌中的PHA生产
1.1 PHA的生物合成途径
很多细菌能够在自然条件下积累PHA,其生物合成途径主要有3条 (图2),所需的酶及其底物特异性各有不同[3]。根据合成途径的不同和相关酶的底物特异性,PHA的单体结构也多种多样,其中3-羟基脂肪酸单体包括了3-羟基丙酸到3-羟基十六酸的所有成员,此外还有 4-、5-、6-羟基脂肪酸以及含有不饱和键、带有甲基侧链或者其他功能基团的3-羟基脂肪酸作为PHA单体的情况[7]。
1.1.1 由乙酰辅酶A合成PHB途径
聚 3-羟基丁酸酯 (Polyhydroxybutyrate,PHB)是结构最简单、最早被发现的PHA成员,其生物合成途径以罗氏真养菌Ralstonia eutropha为代表 (图2)。糖类碳源经过糖酵解途径生成乙酰辅酶 A,β-酮基硫解酶PhaA催化2个乙酰辅酶A缩合形成乙酰乙酰辅酶A,然后在NADPH依赖的乙酰乙酰辅酶A还原酶PhaB的作用下还原为(R)-3-羟基丁酰辅酶A,最后由PHA合酶PhaC聚合成PHB[8-9]。
1.1.2 由脂肪酸β-氧化途径合成PHA
以铜绿假单胞菌Pseudomonas aeruginosa和豚鼠气单胞菌Aeromonas caviae为代表的细菌能利用脂肪酸的β-氧化途径合成PHA (图2)。β-氧化途径的中间产物烯脂酰辅酶A在水合酶PhaJ的催化下形成(R)-3-羟基脂酰辅酶 A,再由 PHA合酶聚合成PHA[3]。
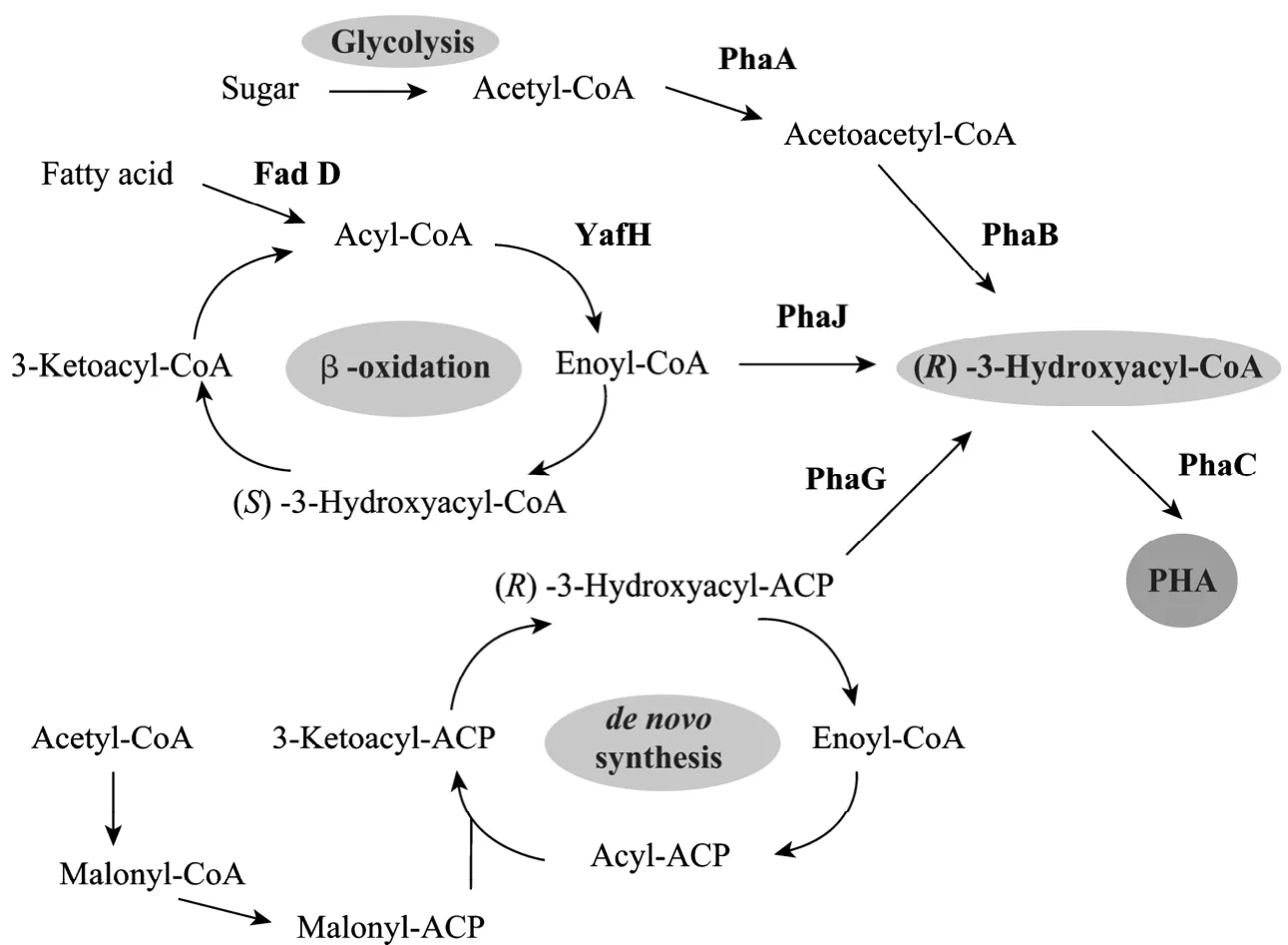
图2 PHA的生物合成途径Fig. 2 Polyhydroxyalkanoate (PHA) synthesis pathway. PhaA: β-ketothiolase; PhaB: NADPH-dependent acetoacetyl-CoA reductase; PhaC: PHA synthase; PhaG: 3-hydroxyacyl- ACP:CoA transacylase; PhaJ: enoyl-CoA hydratase; FadD: acyl-CoA synthase; YafH: fatty acyl-CoA dehydrogenase.
1.1.3 由脂肪酸从头合成途径合成PHA
以恶臭假单胞菌Pseudomonas putida为代表的细菌,能够利用脂肪酸从头合成途径合成 PHA (图2)。乙酰辅酶 A进入脂肪酸的从头合成途径后,其中间产物(R)-3-羟基脂酰-ACP在酰基转移酶 PhaG的催化下形成(R)-3-羟基脂酰辅酶 A,然后由 PHA合酶聚合成PHA[3]。
细菌合成PHA所利用的碳源中,结构与PHA单体类似的被称为相关碳源,如脂肪酸等;结构与PHA单体不同的被称为非相关碳源,如糖类碳源。很多细菌可以利用相关碳源合成包含有多种不同单体的PHA,如细菌可以利用3-羟基丙酸 (3HP)、4-羟基丁酸 (4HB) 和5-羟基戊酸 (5HV) 等相关碳源合成包含有3HP、4HB或5HV的PHA。
1.2 短链PHA的发酵生产
短链PHA (Short-chain-length PHA,scl PHA) 的单体碳原子个数在3∼5个之间,主要包括聚3-羟基丁酸酯、聚3-羟基丁酸3-羟基戊酸酯 (PHBV) 和聚3-羟基丁酸4-羟基丁酸酯 (P3HB4HB) 等。R. eutropha是最常见的scl PHA生产菌,它能利用糖类碳源积累超过细胞干重80%的PHB,细胞干重可达200 g/L以上;当添加丙酸或4-羟基丁酸等作为3HV或4HB的前体时,R. eutropha能够合成 PHBV 或者P3HB4HB。广泛产碱菌Alcaligenes latus也可以用来生产PHB或PHBV,其优点是生长迅速,能利用蔗糖为碳源,但是PHB含量较低,一般只能达到细胞干重的50%左右。
1.3 中长链PHA的发酵生产
中长链 PHA (Medium-chain-length PHA,mcl PHA) 的单体碳原子个数在6∼14之间。嗜油假单胞菌Pseudomonas oleovorans能够利用烷烃为碳源合成mcl PHA,采用两步法连续发酵,前期积累生物量,后期限制氮源供给积累PHA,能够获得超过细胞干重60%的mcl PHA,产率为1.1 g/(L·h)[10]。P. putida可以利用脂肪酸作为碳源合成 mcl PHA,采用脉动补料法,既可以防止碳源限制,又可以防止脂肪酸积累到可以产生抑制的浓度,36 h发酵可获得生物量 131 g/L,PHA含量 59%,最大产率为2.3 g/(L·h)[11]。
1.4 短链中长链共聚PHA的发酵生产
短链中长链共聚PHA (scl-mcl PHA) 是指3HB与长链mcl 3HA单体 (C6∼C14) 形成的共聚物,根据单体组成不同其性能可以从硬塑料到弹性体之间有很大调节空间。嗜水气单胞菌Aeromonas hydrophila可以利用超过12个碳原子的脂肪酸积累3-羟基丁酸和3-羟基己酸共聚酯 (PHBHHx),Chen等[12]报道了在20 000 L的发酵罐中A. hydrophila两步法培养生产PHBHHx的实验,细胞最初在50 g/L的葡萄糖中培养,之后在50 g/L的月桂酸中限磷培养,最终培养46 h后得到的细胞干重和PHA含量分别为50 g/L、50%,共聚物中3HHx的单体含量为11 mol%。
2 PHA生物合成的代谢工程改造
2.1 利用辅酶工程提高PHB的生物合成
NADPH在胞内主要作为氢的传递体参与生物合成反应,例如氨基酸和脂肪酸的合成等。PHB的合成也需要 NADPH作为辅酶还原乙酰乙酰辅酶A (图3),胞内可利用的NADPH的量是影响PHB合成的重要因素。Lee等在含有R. eutropha PHB合成基因的重组大肠杆菌中研究了NADPH对PHB生物合成的调节作用,包括复合Luria-Bertani (LB) 培养基、LB培养基加葡萄糖和化学培养基在内的多种培养基被用于细菌培养,其中 LB加葡萄糖的培养基可以提供最高的[NADPH]/[NADH],因此最利于PHB的积累[13-14]。在化学培养基中添加复合氮源、油酸或氨基酸等能够明显提高PHB的产量,由于氨基酸和油酸的生物合成需要消耗大量的还原力,因此重组大肠杆菌在化学培养基中生产PHB的效率与在复合培养基中相比要低很多[14]。
过表达磷酸戊糖途径中产生NADPH的相关基因,包括葡萄糖-6-磷酸脱氢酶基因 zwf和 6-磷酸-葡萄糖酸脱氢酶基因 gnd (图 3),能够提高胞内[NADPH]/[NADP]的水平,从而促进PHB的合成,但是 NADPH浓度的提高抑制了柠檬酸合成酶的活性,使细胞生长也受到了抑制[15]。调控磷酸戊糖途径中非氧化阶段的关键酶也能促进PHB的合成,过表达转醛醇酶基因talA使得重组大肠杆菌中PHB的含量由28.2%提高到了52.3%[16],过表达转酮醇酶基因tktA可以使PHB的合成提高1.7倍[17]。
嘧啶核苷酸转氢酶可以催化氢在NAD和NADP之间的转化 (图 3),在细胞的生长代谢中起调控辅酶平衡的作用[18]。在重组大肠杆菌中过表达嘧啶核苷酸转氢酶基因udhA,能有效地提高PHB的产量,摇瓶实验中,31 h培养后,过表达udhA的重组菌中PHB的产量为6.42 g/L,而对照菌仅为3.52 g/L[19]。NAD激酶催化NAD的磷酸化生成NADP,是胞内NADP的唯一来源 (图3)。Li等[20]的研究表明,在含有PHB合成途径的重组大肠杆菌中,过表达NAD激酶基因yfjB能够有效地提高胞内辅酶NADP的水平,摇瓶实验中,胞内NADP的浓度提高了1.6∼5.2倍。NADP浓度的提高促进了PHB的合成,6 L的发酵罐培养中,P3HB的产量提高了100%,碳源转化率提高了76%。
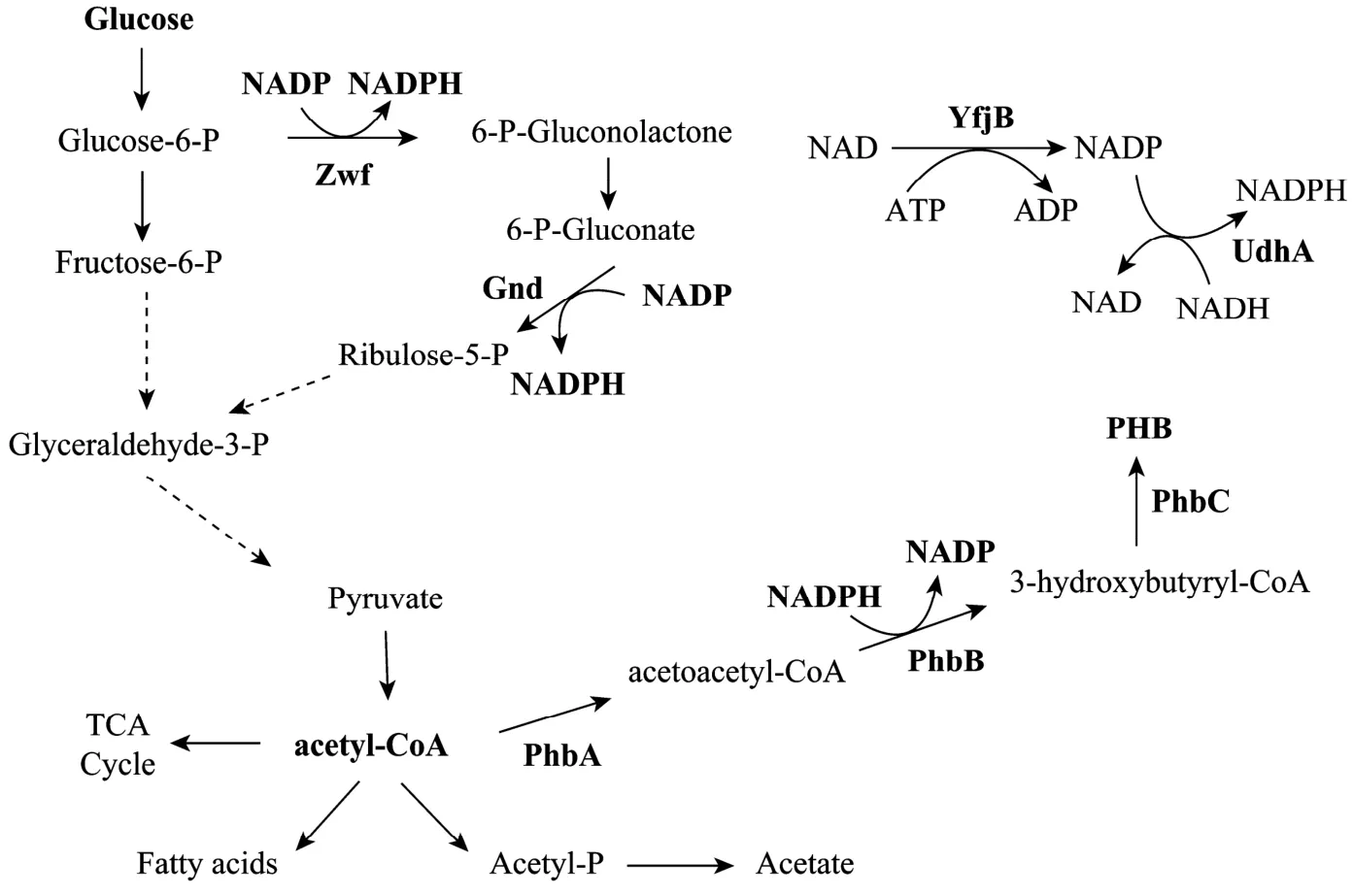
图3 重组大肠杆菌中PHB生物合成的辅因子代谢调控Fig. 3 Cofactor engineering of PHB synthesis in recombinant E. coli. PhaA: β-ketothiolase; PhaB: NADPH-dependent acetoacetyl-CoA reductase; PhaC: PHA synthase; Zwf: glucose-6-P dehydrogenase; Gnd: 6-P-gluconate dehydrogenase; UdhA: pyridine nucleotide transhydrogenase; YfjB: NAD kinase.
2.2 短链中长链共聚PHA的生产
Pseudomonas sp. 61-3和Pseudomonas stutzeri 1317的PHA合酶PhaC161-3和PhaC2Ps具有较低的底物特异性,能够实现不同链长的单体的聚合,得到短链中长链共聚PHA[21-22]。在PHA合成缺陷突变株R. eutropha PHB-4中表达phaC2Ps基因,重组菌可以合成单体组成包括C4∼C12的scl-mcl PHA,占细胞干重的 15%∼41%。利用葡萄糖酸钠和脂肪酸混合碳源培养,通过控制脂肪酸的添加,可以有效调节scl-mcl PHA的单体组成,使3HB单体比例能够在16∼100 mol%之间进行调控。
在R. eutropha PHB-4中表达A. caviae的phaC基因,得到的重组菌能够以豆油为碳源高效地生产PHBHHx,其中3HHx单体含量为5 mol%,细胞干重为123∼138 g/L,PHBHHx含量高达71%∼74%,由豆油生产PHA的转化率为0.72∼0.76[23]。
A. hydrophila 4AK4野生菌可以利用脂肪酸氧化途径合成PHBHHx,为了获得不同单体比例的PHBHHx,并提高菌株生产 PHA的能力,针对其PHA合成途径进行了一系列代谢工程改造。在A. hydrophila 4AK4中表达来源于A. caviae的phaP或phaC基因能提高菌体内PHBHHx含量和3HHx单体比例[24]。表达来源于R. eutropha的phaAB基因可以将胞内脂肪酸氧化产生的乙酰辅酶A用于PHA合成,提高从脂肪酸到 PHA的转化率,同时提高PHBHHx中 3HB单体比例[25]。异源表达透明颤菌Vitreoscilla编码血红蛋白的 vgb基因可以提高细胞对氧的利用率,从而提高细胞干重和 PHBHHx含量[26-27]。
2.3 新型PHA材料的生产
2.3.1 高HDD含量PHA的生产
P. putida能够利用月桂酸合成含C6∼C12单体的mcl PHA,敲除fadB和fadA基因可以弱化其β氧化途径,从而使碳源更多地流向 PHA的合成,提高PHA含量、提高碳源转化率和改变PHA的单体组成。Ouyang等[28]构建了 fadB和 fadA敲除突变株P. putida KTOY06,采用两步法培养,在摇瓶中达到5.31 g/L的细胞干重,其中PHA含量达到细胞干重的84.3%,单体组成中的HDD成分为40.9 mol%,是野生菌的5倍左右。
2.3.2 高HHx含量PHA的生产
A. hydrophila 4AK4 利用月桂酸合成的PHBHHx中3HHx比例在20 mol%以下,通过敲除内源的 PHA合酶基因,表达异源 PHA合酶基因phaC1ps、脂酰辅酶A合酶基因fadDec和脂肪酸转运蛋白基因 fadLpp,构建的重组菌可以利用己酸钠为碳源,积累占细胞干重54%的PHBHHx,其中3HHx比例为95 mol%;以辛酸钠为碳源培养时,重组菌积累占细胞干重51%的三元共聚物 PHBHHxHO,其中3HHx比例为82 mol%[29]。
2.3.3 PHV和PHHp的生产
Shen等[30]用戊酸、庚酸、壬酸和十一酸等奇数碳脂肪酸培养A. hydrophila 4AK4,发现其能利用十一酸合成聚 3-羟基戊酸酯 (Polyhydroxyvalerate,PHV),采用两步法摇瓶培养,在第二步中添加8 g/L的十一酸,细菌能达到5 g/L的细胞干重,PHV含量超过45%。Wang等[31]的研究发现,fadBA敲除突变株P. putida KTOY06可以利用庚酸盐合成聚3-羟基庚酸酯 (Polyhydroxyheptanoate,PHHp),在矿物盐培养基中,添加10 g/L庚酸盐为碳源,细菌能够达到3.7 g/L的细胞干重,PHHp含量超过71%。
2.4 利用单一糖类碳源生产PHA共聚酯
通常情况下,3HB以外的PHA单体的聚合需要相关碳源的添加,例如4HB单体的聚合需要4-羟基丁酸或1,4-丁二醇等,3HV单体的聚合需要丙酸或戊酸,mcl 3HA单体的聚合需要脂肪酸或烷烃。这类相关碳源的价格普遍比糖类碳源贵很多,且对细胞毒性较大,发酵过程中需要以分批补料的方式添加,操作较为繁琐。以相对廉价的简单糖类碳源来生产PHA共聚酯,将能有效地降低其生产成本,促进PHA材料的工业化生产和应用开发,因此引起了很多研究者的兴趣,目前取得的一些进展见表1。

表1 利用简单碳源生产PHA共聚酯的研究Table 1 Metabolic engineering of microorganisms for production of PHA from simple carbon sources
2.4.1 利用葡萄糖生产P3HB4HB
Valentin等[38]通过在大肠杆菌中异源表达 R. eutropha的 PHB合成操纵子 phaCAB和克氏梭菌Clostridium kluyveri的琥珀酸降解相关基因sucD、4hbD和orfZ,构建出能够利用葡萄糖生产P3HB4HB的基因工程菌 (图4)。在摇瓶实验中,重组菌能够积累超过细胞干重50%的P3HB4HB,4HB单体含量为2.8 mol%,但细胞干重处于较低的水平。Li等[32]同样利用上述代谢途径,对基因表达进行了优化,并对大肠杆菌的琥珀酸半缩醛脱氢酶基因 sad和gabD 进行敲除 (图 4),获得了更高的细胞干重和4HB单体含量。在6 L的发酵罐实验中,经过32 h的培养,细胞干重达到24.7 g/L,含有62.0%的P (3HB-co-12.1 mol% 4HB)。热力学及材料力学性质的研究表明,与PHB相比,P3HB4HB共聚酯的结晶度下降,断裂伸长率提高,表现出明显的弹性体的特点。
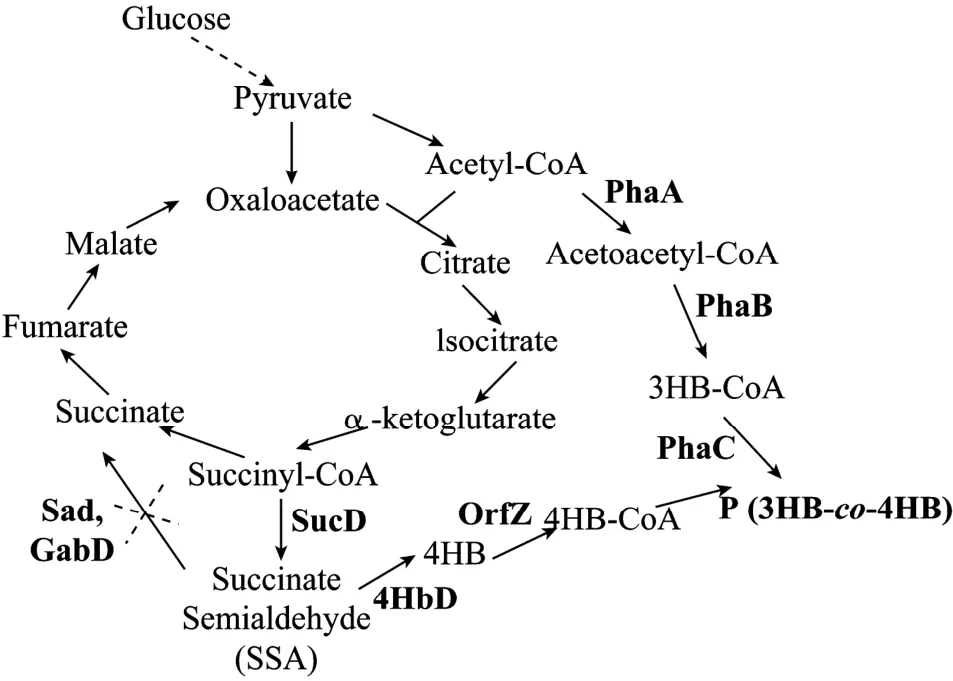
图4 利用葡萄糖为碳源在重组大肠杆菌中合成P3HB4HBFig. 4 P3HB4HB producing pathway in recombinant E. coli cultivated with glucose as carbon source. PhaA: β-ketothiolase; PhaB: NADPH-dependent acetoacetyl-CoA reductase; PhaC: PHA synthase; SucD: succinate semialdehyde dehydrogenase; 4HbD: 4HB dehydrogenase; OrfZ: 4HB-CoA:succinyl-CoA CoA transferase; Sad and GabD: non-CoA acylating succinate semialdehyde dehydrogenase of E. coli.
2.4.2 利用甘油生产PHBV
大肠杆菌中存在sbm-ygfD-ygfG操纵子,能够催化琥珀酰辅酶 A生成丙酰辅酶 A,肠道沙门氏菌Salmonella enterica中prpC基因催化丙酰辅酶A与草酰乙酸缩合成 2-甲基柠檬酸。Aldor等[33]通过在prpC突变的S. enteric JE4199中表达sbm-ygfD-ygfG和不动杆菌 Acinetobacter 的 PHB合成操纵子phbBCA,实现了由甘油来生产PHBV,其中3HV单体含量为14 mol%,PHBV达细胞干重的40%以上。
2.4.3 利用简单碳源生产短链中长链共聚PHA
Taguchi等[22,34]在R. eutropha PHB-4中表达源自Pseudomonas sp. 61-3的phaG和phaC1基因,重组菌可以利用果糖合成短链中长链共聚的PHA,其中3HB单体含量为95∼97 mol%,在此基础上表达R. eutropha的phbAB基因使得PHA含量由26%提高到 43%[22,34]。将肉桂地链霉菌 Streptomyces cinnamonensis的ccr基因以及A. caviae的phaCJ基因导入R. eutropha PHB-4中,得到的重组菌能够利用果糖合成占细胞干重48%的PHBHHx,其中3HHx单体含量为1.5 mol%,共聚物中的 C6前体是通过PhaA催化的丁酰辅酶A延伸合成的,ccr基因起了催化巴豆酰辅酶A生成丁酰辅酶A的作用[36]。
在一般培养中,A. hydrophila 4AK4野生菌不能利用糖类碳源合成PHBHHx或者PHB,将来源于大肠杆菌、删除了前导序列的编码硫酯酶I的tesA基因导入A. hydrophila 4AK4,重组菌可以利用葡萄糖酸钠合成PHBHHx,通过限磷或限氮可使PHBHHx含量提高到10%,3HHx含量为14 mol%[35]。在P. putida GPp104中表达 R. eutropha的 phaB、A. hydrophila的phaC以及本身的phaG基因,得到的重组菌可以用葡萄糖合成PHBHHx,其含量最高可达19%,其中3HHx含量为5 mol%[35]。
Ouyang等[37]删除了P. putida KT2442的PHA合成操纵子的大部分序列,获得了一株PHA合成功能丧失的突变株P. putida KTOY01,在其中表达底物特异性较低的 phaC2Ps基因以及 R. eutropha的phbAB基因,得到的重组菌株可以在以葡萄糖为碳源的摇瓶培养基中获得2.37 g/L的细胞干重,PHA含量为22.8%,其中含88 mol% HB和12 mol%中长链单体。
3 微氧条件下生产PHB的研究
在不影响产物形成的情况下,降低细菌发酵过程中的氧气供给能够减少发酵工业中最大的能量消耗——通氧搅拌。无氧发酵可以生产多种产品,如乙醇、乳酸和琥珀酸等,但是在无氧环境下生产PHB是非常困难的,因为现有的PHB生产菌种都是好氧生长菌,在氧气供应不足时菌体生长难以维持。有些实验室尝试利用无氧发酵来产生PHB,希望能够有所突破,但是尚未取得明显的效果[39]。目前,一些研究者的眼光逐渐由无氧生产转向了微氧生产。相比好氧发酵,微氧发酵有着培养过程简单、生产规模容易扩大的优点,而且微氧培养也无需像严格厌氧发酵那样需在氮气保护等辅助手段下进行,因此在生产上更为简单易行,对设备的要求也更低。
Alexeeva等在敲除了 ArcA的大肠杆菌突变体中发现,在充分好氧或严格厌氧的情况下菌体的代谢水平并没有发生变化,但敲除ArcA却能明显提高细菌在微氧环境中的呼吸作用,同时菌体内的氧化还原状态也有改变[40]。Nikel等尝试使用AcrA突变的重组大肠杆菌在微氧条件下合成PHB,取得了一定效果[41],在微氧条件下,通过分批补料的方式添加甘油为碳源,60 h的培养获得了10.8 g/L的PHB产量[42]。
Wei等[43]将厌氧启动子引入到 PHB的微氧生产,以解除菌体在微氧环境下PHB合成基因不能正常表达的问题。经过检索分析筛选出 9个厌氧启动子作为候选,通过实验比较从中找到了微氧条件下具有较高活性的乙醇脱氢酶启动子 PadhE,将 PadhE应用于微氧PHB的生产,使得菌体中PHB的含量从30%提高到了48%。研究还发现改变菌体代谢流能够提高PadhE的活性,将PadhE应用于乙酸缺失突变体E. coli JW2293和JW2294中,在微氧条件下,两株突变体比野生型显示了更高的 PHB合成能力,PHB的含量分别达到了58%和67%[43]。
4 PHA合成基因作为代谢调控的因子提高工业生产菌的代谢潜能
4.1 PHA的合成提高微生物的抗逆性
PHA的合成与细菌的抗逆性之间存在着密切的联系,微生物积累PHA能够增加其在多变环境中的竞争能力。例如PHB在碳源过剩以及氮、磷等营养缺乏时合成,可以作为碳源和能源的储存物;当环境中的营养物质缺乏时,PHB可以使得细胞的生存时间延长,从而渡过难关。López等[44-45]的研究发现,在恶劣的环境下PHB野生菌R. eutropha比其PHB积累缺陷菌有更强的耐受能力。在固氮菌中,PHB的积累还可作为调节细菌生存环境中氧含量的因子,也可用作电子供体,赋予细菌在生命进化过程中更强的竞争力[44]。
Zhao等[46]利用能生产共聚物 PHBHHx的A. hydrophila 4AK4野生菌和不产PHBHHx的PhaC突变株A. hydrophila CQ4作比较来研究PHA合成的抗性原理,发现野生菌 4AK4对各种环境因子包括高温、低温、紫外照射、有机溶剂、高渗透压和过氧化氢等的抗逆性均高于突变菌 CQ4。分子水平上检测rpoS表达量发现,较高的存活率与较高水平的rpoS表达量相偶联,在环境因子的刺激下,细菌内PHBHHx的存在会增强胞内包括rpoS在内的基因的表达,而rpoS的表达则会与RNA聚合酶结合激活各种压力蛋白的表达,从而保护细菌免受环境压力的毒害。
4.2 PHA合成基因在工业微生物中的应用
PHA在细菌内的积累主要有两方面的影响,一是作为碳源和能源的储存物,二是消耗还原型辅酶,避免其积累对细胞代谢产生负面影响。PHA的合成消耗掉了胞内的代谢资源,使整个碳源和能源的分布发生了很大的变化,由此可推测PHA合成途径可以改变胞内的整体代谢调节,对微生物的其他新陈代谢也产生了影响。PHA合成基因在工业微生物菌株中的表达,可以从整体上调控微生物的代谢,从而提高含PHA基因重组菌的产品产率。
4.2.1 PHA的合成对谷氨酸棒杆菌中谷氨酸合成的影响
Liu等[47]通过优化基因表达,成功地在几株谷氨酸棒杆菌 Corynebacterium glutamicum中表达R. eutropha的PHB合成基因phbCAB,摇瓶培养中积累PHB的重组菌的谷氨酸产量分别提高了17%∼39%,发酵罐培养中,含有 phbCAB的重组 C. glutamicum ATCC14067与野生菌株相比,细胞干重提高10%,葡萄糖的消耗增加13%,谷氨酸的产量则提高23%。由于PHB合成基因的引入,使得胞内NADPH的水平下降,细胞为了增加 NADPH的合成,更多的代谢流流向了糖酵解途径和TCA循环,进而促进了谷氨酸的合成;同时由于PHB合成对碳源的分流,减少了副代谢产物乳酸的产量。
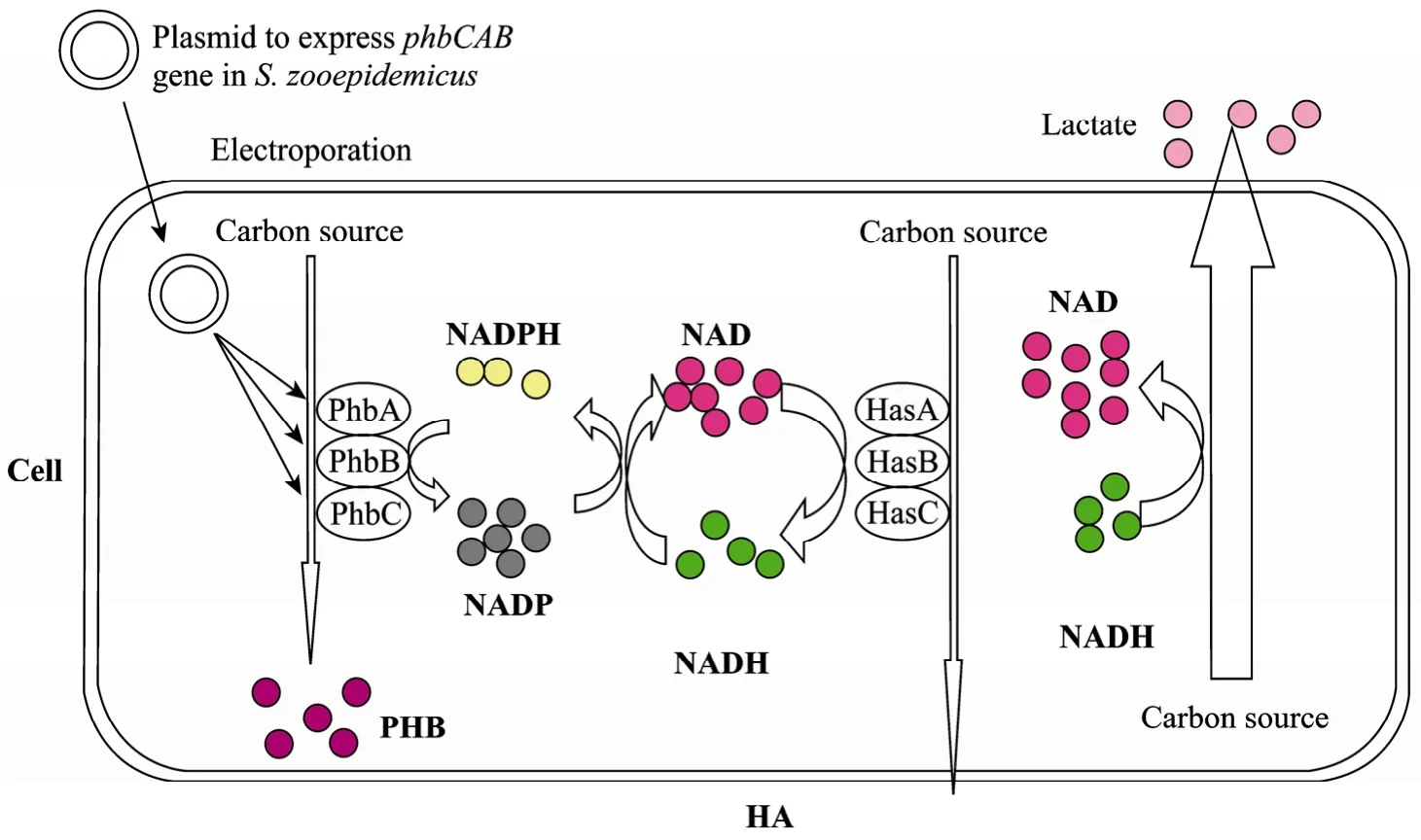
图5 PHB合成基因在兽疫链球菌中表达提高透明质酸生产Fig. 5 Expression of PHB synthesis genes in Streptococcus zooepidemicus improved hyaluronic acid production.
4.2.2 PHA的合成提高兽疫链球菌生产透明质酸的能力
在兽疫链球菌Streptococcus zooepidemicus发酵生产透明质酸的过程中,大量的碳源流向乳酸的合成,高浓度的乳酸抑制了菌体的生长和透明质酸的生产。在发酵罐的低溶解氧条件下,生成乳酸是细胞再生NAD的主要途径,Zhang等[48]通过在兽疫链球菌中表达R. eutropha的phbCAB基因,提供了另一条获得氧化力的途径,使乳酸的产量由64 g/L下降到41 g/L,同时增加了透明质酸的合成 (图5)。
4.2.3 PHA的合成对移动单胞菌中乙醇生产的影响
Lai等[49]在移动单胞菌Zymomonas mobilis中表达R. eutropha的PHB合成基因并实现了PHB的积累,48 h的摇瓶培养表明,PHB的积累对运动发酵单胞菌的葡萄糖利用和乙醇合成产生了影响,带有PHB合成基因表达质粒的重组菌的乙醇生产量比野生菌提高了约10%,说明PHB的积累能够在一定程度上提高了运动发酵单胞菌的乙醇生产能力。
5 结论与展望
聚羟基脂肪酸酯 (PHA) 是一类材物化性能多样的生物可降解聚合物,在很多领域都有潜在的应用价值,具有非常好的发展前景。过去几十年中对于PHA合成机制和代谢途径的深入研究使得我们能够构建出各种生产PHA的基因工程菌,这些基因工程菌的生产能力比天然的生产菌株要强很多。合成生物学、系统生物学、生物信息学等的迅速发展提供了强有力的分子生物学工具,将其应用于PHA代谢工程领域,会有利于我们构建更为高效的PHA生产菌,降低PHA材料的生产成本,推动其工业化生产和商业应用开发,促进塑料产业的可持续发展。
REFERENCES
[1] Ahn WS, Park SJ, Lee SY. Production of
poly(3-hydroxybutyrate) by fed-batch culture of recombinant Escherichia coli with a highly concentrated whey solution. Appl Environ Microbiol, 2000, 66: 3624−3627.
[2] Steinbüchel A, Lutke-Eversloh T. Metabolic engineering and pathway construction for biotechnological production of relevant polyhydroxyalkanoates in microorganisms. Biochem Eng J, 2003, 16: 81−96.
[3] Sudesh K, Abe H, Doi Y. Synthesis, structure and properties of polyhydroxyalkanoates: biological polyesters. Prog Polym Sci, 2000, 25: 1503−1555.
[4] Chen GQ. A microbial polyhydroxyalkanoates (PHA) based bio- and materials industry. Chem Soc Rev, 2009, 38: 2434−2446.
[5] Hazer B, Steinbüchel A. Increased diversification of polyhydroxyalkanoates by modification reactions for industrial and medical applications. Appl Microbiol Biotechnol, 2007, 74: 1−12.
[6] Philip S, Keshavarz T, Roy I. Polyhydroxyalkanoates: biodegradable polymers with a range of applications. J Chem Technol Biotechnol, 2007, 82: 233−247.
[7] Steinbüchel A, Valentin HE. Diversity of bacterial polyhydroxyalkanoic acids. FEMS Microbiol Lett, 1995, 128: 219−228.
[8] Peoples OP, Sinskey AJ. Poly-beta-hydroxybutyrate biosynthesis in Alcaligenes eutrophus H16: characterization of the genes encoding beta-ketothiolase and acetoacetyl-CoA reductase. J Biol Chem, 1989, 264: 15293−15297.
[9] Peoples OP, Sinskey AJ. Poly-beta-hydroxybutyrate (PHB) biosynthesis in Alcaligenes eutrophus H16: identification and characterization of the PHB polymerase gene (phbC). J Biol Chem, 1989, 264: 15298−15303.
[10] Jung K, Hazenberg W, Prieto M, et al. Two-stage continuous process development for the production of medium-chain-length poly(3-hydroxyalkanoates). Biotechnol Bioeng, 2001, 72: 19−24.
[11] Kellerhals MB, Kessler B, Witholt B. Closed-loop control of bacterial high-cell-density fed-batch cultures: production of mcl-PHAs by Pseudomonas putida KT2442 under single-substrate and cofeeding conditions. Biotechnol Bioeng, 1999, 65: 306−315.
[12] Chen GQ, Zhang G, Park SJ, et al. Industrial scale production of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate). Appl Microbiol Biotechnol, 2001, 57: 50−55.
[13] Lee IY, Kim MK, Park YH, et al. Regulatory effects of cellular nicotinamide nucleotides and enzyme activities on poly(3-hydroxybutyrate) synthesis in recombinant Escherichia coli. Biotechnol Bioeng, 1996, 52: 707−712.
[14] Lee SY, Lee YK, Chang HN. Stimulatory effects of amino acids and oleic acid on poly(3-hydroxybutyric acid) synthesis by recombinant Escherichia coli. J Ferment Bioeng, 1995, 79: 177−180.
[15] Lim SJ, Jung YM, Shin HD, et al. Amplification of the NADPH-related genes zwf and gnd for the oddball biosynthesis of PHB in an E. coli transformant harboring a cloned phbCAB operon. J Biosci Bioeng, 2002, 93: 543−549.
[16] Song BG, Kim TK, Jung YM, et al. Modulation of talA gene in pentose phosphate pathway for overproduction of poly-beta-hydroxybutyrate in transformant Escherichia coli harboring phbCAB operon. J Biosci Bioeng, 2006, 102: 237−240.
[17] Jung YM, Lee JN, Shin HD, et al. Role of tktA gene in pentose phosphate pathway on odd-ball biosynthesis of poly-beta-hydroxybutyrate in transformant Escherichia coli harboring phbCAB operon. J Biosci Bioeng, 2004, 98: 224−227.
[18] Sauer U, Canonaco F, Heri S, et al. The soluble and membrane-bound transhydrogenases UdhA and PntAB have divergent functions in NADPH metabolism of Escherichia coli. J Biol Chem, 2004, 279: 6613−6619.
[19] Sanchez AM, Andrews J, Hussein I, et al. Effect of overexpression of a soluble pyridine nucleotide transhydrogenase (UdhA) on the production of poly(3-hydroxybutyrate) in Escherichia coli. Biotechnol Prog, 2006, 22: 420−425.
[20] Li ZJ, Cai L, Wu Q, et al. Overexpression of NAD kinase in recombinant Escherichia coli harboring the phbCAB operon improves poly(3-hydroxybutyrate) production. Appl Microbiol Biotechnol, 2009, 83: 939−947.
[21] Chen JY, Liu T, Zheng Z, et al. Polyhydroxyalkanoate synthases PhaC1 and PhaC2 from Pseudomonas stutzeri 1317 had different substrate specificities. FEMS Microbiol Lett, 2004, 234: 231−237.
[22] Matsumoto K, Nakae S, Taguchi K, et al. Biosynthesis of poly(3-hydroxybutyrate-co-3-hydroxyalkanoates) copolymer from sugars by recombinant Ralstonia eutropha harboring the phaC1(Ps) and the phaG(Ps) genes of Pseudomonas sp. 61-3. Biomacromolecules, 2001, 2: 934−939.
[23] Kahar P, Tsuge T, Taguchi K, et al. High yield production of polyhydroxyalkanoates from soybean oil by Ralstonia eutropha and its recombinant strain. Polym Degrad Stabil, 2004, 83: 79−86.
[24] Han J, Qiu YZ, Liu DC, et al. Engineered Aeromonas hydrophila for enhanced production of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) with alterable monomers composition. FEMS Microbiol Lett, 2004, 239: 195−201.
[25] Qiu YZ, Han J, Chen GQ. Metabolic engineering of Aeromonas hydrophila for the enhanced production of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate). Appl Microbiol Biotechnol, 2006, 69: 537−542.
[26] Ouyang SP, Han J, Qiu YZ, et al. Poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) production in recombinant Aeromonas hydrophila 4AK4 harboring phbA, phbB and vgb genes. Macromol Symp, 2005, 224: 21−34.
[27] Qiu YZ, Ouyang SP, Shen ZY, et al. Metabolic engineering for the production of copolyesters consisting of 3-hydroxybutyrate and 3-hydroxyhexanoate by Aeromonas hydrophila. Macromol Biosci, 2004, 4: 255−261.
[28] Ouyang SP, Luo RC, Chen SS, et al. Production of polyhydroxyalkanoates with high 3-hydroxydodecanoate monomer content by fadB and fadA knockout mutant of Pseudomonas putida KT2442. Biomacromolecules, 2007, 8: 2504−2511.
[29] Jian J, Li ZJ, Ye HM, et al. Metabolic engineering for microbial production of polyhydroxyalkanoates consisting of high 3-hydroxyhexanoate content by recombinant Aeromonas hydrophila. Bioresour Technol, 2010, 101: 6096−6102.
[30] Shen XW, Yang Y, Jian J, et al. Production and characterization of homopolymer poly(3-hydroxyvalerate) (PHV) accumulated by wild type and recombinant Aeromonas hydrophila strain 4AK4. Bioresour Technol, 2009, 100: 4296−4299.
[31] Wang HH, Li XT, Chen GQ. Production and characterization of homopolymer polyhydroxyheptanoate (P3HHp) by a fadBA knockout mutant Pseudomonas putida KTOY06 derived from P. putida KT2442. Process Biochem, 2009, 44: 106−111.
[32] Li ZJ, Shi ZY, Jian J, et al. Production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) from unrelated carbon sources by metabolically engineered Escherichia coli. Metab Eng, 2010, 12: 352−359.
[33] Aldor AS, Kim SW, Prather KLJ, et al. Metabolic engineering of a novel propionate-independent pathway for the production of poly(3-hydroxybutyrate-co-3-hydroxyvalerate) in recombinant Salmonella enterica serovar typhimurium. Appl Environ Microbiol, 2002, 68: 3848−3854.
[34] Taguchi S, Matsusaki H, Matsumoto K, et al. Biosynthesis of biodegradable polyesters from renewable carbon sources by recombinant bacteria. Polym Int, 2002, 51: 899−906.
[35] Qiu YZ, Han J, Guo JJ, et al. Production of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) from gluconate and glucose by recombinant Aeromonas hydrophila and Pseudomonas putida. Biotechnol Lett, 2005, 27: 1381−1386.
[36] Fukui T, Abe H, Doi Y. Engineering of Ralstonia eutropha for production of poly(3-hydroxybutyrate-co-3-hydroxyhexanoate) from fructose and solid-state properties of the copolymer. Biomacromolecules, 2002, 3: 618−624.
[37] Ouyang SP, Liu Q, Fang L, et al. Construction of pha-operon-defined knockout mutants of Pseudomonas putida KT2442 and their applications in poly(hydroxyalkanoate) production. Macromol Biosci, 2007, 7: 227−233.
[38] Valentin HE, Dennis D. Production of poly(3-hydroxybutyrate-co-4-hydroxybutyrate) in recombinant Escherichia coli grown on glucose. J Biotechnol, 1997, 58: 33−38.
[39] Carlson R, Wlaschin A, Srienc F. Kinetic studies and biochemical pathway analysis of anaerobic poly-(R)-3-hydroxybutyric acid synthesis in Escherichia coli. Appl Environ Microbiol, 2005, 71: 713−720.
[40] Alexeeva S, Hellingwerf KJ, de Mattos MJT. Requirement of ArcA for redox regulation in Escherichia coli under microaerobic but not anaerobic or aerobic conditions. J Bacteriol, 2003, 185: 204−209.
[41] Nikel PI, Pettinari MJ, Galvagno MA, et al. Poly(3-hydroxybutyrate) synthesis by recombinant Escherichia coli arcA mutants in microaerobiosis. Appl Environ Microbiol, 2006, 72: 2614−2620.
[42] Nikel PI, Pettinari MJ, Galvagno MA, et al. Poly(3-hydroxybutyrate) synthesis from glycerol by a recombinant Escherichia coli arcA mutant in fed-batch microaerobic cultures. Appl Microbiol Biotechnol, 2008, 77: 1337−1343.
[43] Wei XX, Shi ZY, Yuan MQ, et al. Effect of anaerobic promoters on the microaerobic production of polyhydroxybutyrate (PHB) in recombinant Escherichia coli. Appl Microbiol Biotechnol, 2009, 82: 703−712.
[44] López NI, Floccari ME, Steinbüchel A, et al. Effect of poly(3-Hydroxybutyrate) (Phb) content on the starvationsurvival of bacteria in natural-waters. FEMS Microbiol Ecol, 1995, 16: 95−101.
[45] López NI, Ruiz JA, Mendez BS. Survival of poly-3-hydroxybutyrate-producing bacteria in soil microcosms. World J Microb Biotechnol, 1998, 14: 681−684.
[46] Zhao YH, Li HM, Qin LF, et al. Disruption of the polyhydroxyalkanoate synthase gene in Aeromonas hydrophila reduces its survival ability under stress conditions. FEMS Microbiol Lett, 2007, 276: 34−41.
[47] Liu Q, Ouyang SP, Kim J, et al. The impact of PHB accumulation on L-glutamate production by recombinant Corynebacterium glutamicum. J Biotechnol, 2007, 132: 273−279.
[48] Zhang JY, Hao N, Chen GQ. Effect of expressing polyhydroxybutyrate synthesis genes (phbCAB) in Streptococcus zooepidemicus on production of lactic acid and hyaluronic acid. Appl Microbiol Biotechnol, 2006, 71: 222−227.
[49] Lai WJ, Chen GQ. Polyhydroxybutyrate synthesis in recombinant Zymomonas mobilis affected ethanol production. China Biotechnol, 2006, 26: 52−56.赖伟坚, 陈国强. 运动发酵单胞菌积累聚羟基丁酸提高乙醇产量. 中国生物工程杂志, 2006, 26: 52−56.
