黑曲霉作为细胞工厂:知识准备与技术基础
2010-02-09郭艳梅郑平孙际宾
郭艳梅,郑平,孙际宾
中国科学院天津工业生物技术研究所,天津 300308
1 概述
黑曲霉是一种广泛存在于自然界的腐生真菌,其分生孢子头呈褐黑色放射状,分生孢子梗长短不一。顶囊球形,双层小梗 (图 1),多见于粮食、植物性产品和土壤中。黑曲霉又是重要的工业发酵微生物,在工业酶制剂、有机酸发酵方面应用广泛。可生产淀粉酶、酸性蛋白酶、纤维素酶、果胶酶、葡萄糖氧化酶等超过30种酶制剂。因为黑曲霉出色的蛋白质分泌能力,黑曲霉也被开发为通用的异源蛋白表达载体。黑曲霉是柠檬酸、葡糖酸和没食子酸等的主要生产菌。世界上柠檬酸年产量超过150万t,其中 99%以上的柠檬酸都是通过黑曲霉发酵生产的,中国柠檬酸生产的技术和产能都居世界领先地位。另外黑曲霉在甾体转化、传统发酵食品酿制等方面也有所应用。
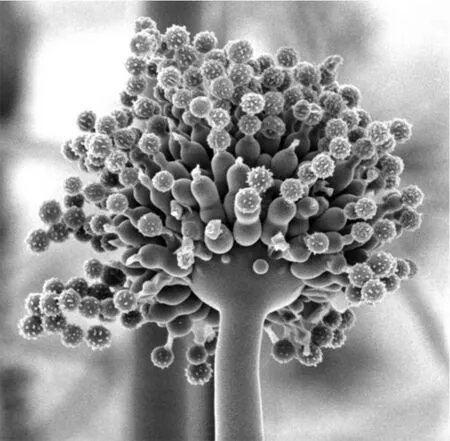
图1 黑曲霉分生孢子梗的扫描电镜图[1] (本图由爱丁堡大学瑞德博士惠供)Fig. 1 Scanning electron microscope photo of Aspergillus niger conidial head[1] (with kindly permission from Dr. Nick Read).
黑曲霉具有强大的聚合物降解酶系,赋予其在各种廉价的培养基上快速生长和发酵的能力,能够在极低的pH下保持旺盛的代谢活性因而不易染菌,能够适应工业发酵中粗放的物料和理化环境,这些品质使黑曲霉成为一种不可多得的工业生产宿主菌,即细胞工厂。但追溯起来,是黑曲霉在柠檬酸工业生产中的应用首先奠定了其在工业发酵上的特殊地位。早在1923年黑曲霉就已经应用于工业生产柠檬酸。到目前为止,利用黑曲霉生产柠檬酸的发酵过程已经成为微生物发酵工业的典范。在近一个世纪的柠檬酸生产过程中,柠檬酸生产的各项性能指标突飞猛进,黑曲霉菌种改造是主要推手,但这其中仍以传统的诱变育种为主。
自上世纪90年代以来,分子生物学的进步率先揭开了全面研究黑曲霉细胞工厂运作机制的序幕。一些基因得到克隆和功能表征,一些针对丝状真菌的分子生物学操作技术也在黑曲霉中得到实现和应用,如敲除载体、转化方法、筛选标记等等。这些都为更好地研究黑曲霉的分子机制奠定了基础。2007年前后,3株黑曲霉菌株基因组的公布,将黑曲霉的研究推入后基因组时代。伴随着分子生物学、系统生物学等学科的迅猛发展,黑曲霉这个高效运作的细胞工厂的神秘面纱正在被逐渐揭开,对黑曲霉细胞工厂进行重新设计和优化的能力正在逐步形成。
2 系统生物学的进步使得对黑曲霉的了解一步步深入
2.1 黑曲霉基因组
近年来,有3株黑曲霉工业菌株先后获得测序。2000年7月荷兰帝斯曼公司 (DSM) 率先启动了对其拥有的工业酶生产菌株黑曲霉CBS 513.88的测序计划。采用BAC和shotgun法,2001年底完成测序,8倍覆盖率,拼接成约500个重叠群 (Contigs),大小34.5兆碱基对,预测有14 000多个基因,但该信息当时仅限于在公司内部使用。大约与此同时,美国 Integrated Genomics 公司完成对黑曲霉菌株ATCC 9029测序,该菌株曾被用于多种酶制剂和有机酸生产的研究。测序采用shotgun法,4倍覆盖率,约10 000个重叠群。形成的数据库通过该公司的生物信息集成数据库ERGO进行销售。2006年美国能源部联合基因组学研究所 (JGI) 完成对柠檬酸生产菌黑曲霉ATCC 1015测序,测序质量与帝斯曼的质量相当,也是8倍覆盖率。基因组大小为37.1兆,较帝斯曼菌株大,预测基因数目约 11 000个。JGI采取的是开放策略,其数据在公开发表之前已经提供给公众下载[2](http://genome.jgi-psf.org/Aspni1/ Aspni1.home.html)。在这种形势下,在对其菌株基因组信息进行了充分的挖掘和专利保护之后,帝斯曼公司及其合作伙伴在Nature Biotechnology上发表论文[3],对黑曲霉基因组进行系统阐述,并公布序列和高质量的基因组注释。同时发表的还有对其中央代谢途径的重建和对其蛋白质分泌途径的解析,成为当时黑曲霉研究领域,特别是在欧洲的企业界和学术界研究者与生物信息工作者联手合作的典范,轰动了当时的学术界和产业界。本文作者有幸参与了这一工作,在重建黑曲霉分泌途径方面做了一点工作。
黑曲霉基因组数据的公布为功能基因组学的深入研究奠定了基础,转录组、蛋白组和代谢组方面的数据很快得到了发表,使细胞工厂设计和代谢工程研究变得更加便捷,也为通过工程手段提高工业生产菌株性能提供了新的思路和方法。
2.2 蛋白质分泌途径
黑曲霉具有高效表达和分泌某些蛋白质、特别是各种水解酶的能力,但是并非所有异源蛋白都能够通过黑曲霉实现过量胞外生产。虽然通过一些技术手段,例如采用基因融合、蛋白酶缺失、分子伴侣和折叠酶过量表达等工程菌株改造策略,在某些情况下可以提高一些异源蛋白的产量,但是在很多情况下仍难以奏效。蛋白质的分泌机制和其改造是异源蛋白生产的瓶颈问题。
真核生物胞外蛋白质的分泌是一个非常复杂的过程。分泌蛋白通常在N端有信号肽序列,它引导分泌蛋白定位于糙面内质网膜的核糖体上合成,随后信号肽被切除,并在内质网中进行加工、修饰;然后被运输到高尔基体中进行进一步的翻译后加工,形成有特定结构和功能的蛋白质;最后通过高尔基体发生的分泌小泡与质膜融合,将其包含的蛋白质分泌到细胞外,这个过程被称为内质网-高尔基体 (ER-Golgi) 蛋白分泌途径 (图2)。
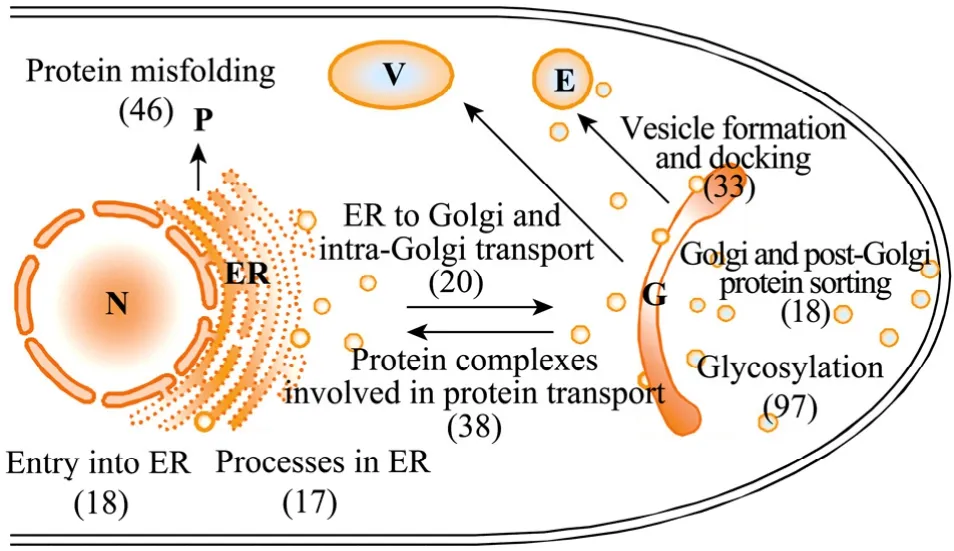
图2 黑曲霉的蛋白质分泌途径[3] (括号中的数字表示涉及该过程的编码基因数量)Fig. 2 Protein secretory pathway of Aspergillus niger[3]. The numbers in parentheses represent the number of coding genes involved in the corresponding process.
通过比较黑曲霉、构巢曲霉、脉胞霉、酿酒酵母等20余种真核生物,我们第一次注释了与黑曲霉蛋白质运输有关的 300多个基因,约占其基因组总量的2%,初步重建了黑曲霉的蛋白质分泌途径[3]。与其他真核生物相比,黑曲霉表现了与众不同的特点,比如具有更多的糖基化基因,具有与细菌类似的IbpA蛋白稳定蛋白质分散,更多的蛋白质二硫键异构酶和肽基脯氨酰异构酶帮助蛋白质折叠,与哺乳动物和酵母菌都不同的未折叠蛋白响应系统(UPR) 等。
2.3 代谢网络调控
在广泛的基因组注释和比较基因组学研究的基础上,孙际宾等重建了黑曲霉基因组规模的代谢网络模型[4](图3),共涉及4 000多个基因,999个不同的酶序列号 (EC number),2 443个代谢反应和2 349个代谢产物。这是黑曲霉第一个全面的代谢网络模型,是以往文献发表的黑曲霉网络的反应数目的 8倍以上。应用此网络模型首先分析了黑曲霉高产柠檬酸的机理[4]。发现黑曲霉除了丰富的多糖水解酶体系外,其糖酵解和三羧酸循环还有丰富的冗余基因,即较多的重复基因拷贝编码催化同一步反应的酶。典型的是柠檬酸合成酶CS和线粒体支链氧化还原酶AOX。与当时基因组序列已经公布的丝状真菌相比,3株获得测序的黑曲霉菌株普遍存在额外的第 5套柠檬酸合成酶,而柠檬酸生产菌株ATCC 1015则具有第 6套细菌来源的柠檬酸合成酶。在柠檬酸的合成过程中,氧气被同时大量消耗。发酵过程停止通气5 min足以导致整个发酵过程发生不可逆的损伤。究其原因,黑曲霉转化葡萄糖生成柠檬酸的过程中,每一分子柠檬酸的合成,都会伴随3分子NADH的产生。大量的NADH只有传递给氧气才能得到氧化再生。除氧化磷酸化电子传递链外,黑曲霉被认为拥有一条不产生能量的电子传递系统,称为支链氧化还原酶AOX。但是,已经发现的 AOX系统经过分子生物学实验证明与柠檬酸高速合成无关,其同源系统在所有真核生物中有着广泛的分布。非常有趣的是,通过基因组分析,发现黑曲霉存在另外一套独有的AOX,称之为AOX2。这一发现,为解释NADH高速循环和柠檬酸快速合成提供了新的思路,也为黑曲霉细胞工厂的重新设计指出了途径。
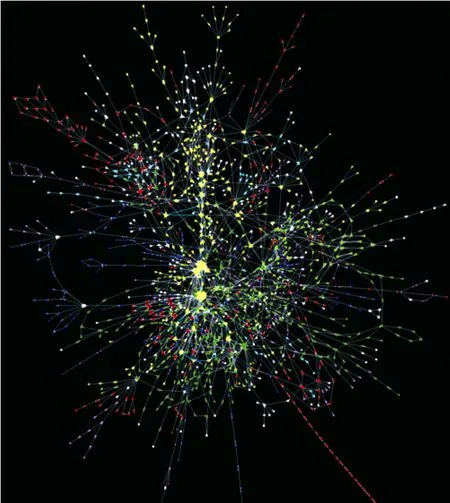
图3 黑曲霉基因组规模代谢网络模型[4]Fig. 3 Genome-scale metabolic network of Aspergillus niger[4].
在黑曲霉代谢网络研究方面的一个里程碑是Jens Nielsen小组2008年发表在Molecular Systems Biology[5]上的工作在深入分析文献数据的基础上,他们建立了包括亚细胞定位和运输反应的全细胞代谢网络,包含文献371篇,生化反应1 190个。结合文献中的宏观数据、流量分析和转录组数据,他们证实了其网络的可靠性,分析了黑曲霉的代谢潜力。与前面介绍的基因组规模代谢网络相比,尽管反应总数少一半左右,但是可靠性有很大提升,同时包含亚细胞定位和运输反应,这些信息对于模型模拟与细胞仿真非常重要。在 Nielsen等的基础上补充更多的可靠的代谢反应,是黑曲霉代谢网络研究的重要方向,将成为黑曲霉细胞工厂设计的重要基础。
2.4 调控网络
尽管对黑曲霉的研究有近百年的历史,在PUBMED中可索引的文献有数千条,但是限于其遗传操作的复杂性,关于黑曲霉基因调控的机理的研究非常少。这种状态一直到2007年黑曲霉基因组序列得以公开后才开始改变。Park等构建了真菌转录因子数据库 (http://ftfd.snu.ac.kr),从 156个真菌的全基因组数据预测了58 890个潜在的转录因子,包括黑曲霉CBS 513.88的679个转录因子,为从构建全基因组规模调控网络提供了条件。通过对 3 000余篇黑曲霉相关研究论文的分析总结,我们汇总了文献中对黑曲霉基因调控网络研究的成果,得到经实验确证了的调控蛋白和其调控关系,同时通过各种计算生物学手段预测新的调控,初步形成了黑曲霉基因调控网路和数据库。同时我们在积极开展高通量的蛋白质-DNA相互作用研究,期望在不远的将来,进一步拓展对黑曲霉调控网络的认识。
2.5 黑曲霉的系统解析
高通量系统生物学分析是理解黑曲霉细胞工厂的重要基础,特别是近几年来,随着黑曲霉基因组的发布,相关研究呈现井喷趋势。甚至在基因组数据正式公布之前,Semova等就于2006年率先发表了在 7种不同培养条件下的 EST (Expressed sequence tags) 数据,包括12 820个EST序列,分属于5 108个基因模型[6]。Meyer等首次通过基因芯片技术分析了在存在抗真菌药物环境下黑曲霉的转录响应[7]。Nielsen研究组发布了黑曲霉、构巢曲霉和米曲霉的三基因组整合型芯片,Affymetrix格式,方便了 3种曲霉的比较分析[8]。他们利用此芯片比较研究了3种曲霉在葡萄糖和甘油两种碳源上基因转录情况,发现了一个重要调控因子Adr1和其保守DNA结合序列,表明在曲霉属、甚至在酿酒酵母和人类中,该调控模式都是相当保守的[9]。
Lu等 2007年就通过二维电泳完成了淀粉酶产生菌黑曲霉在诱导和非诱导条件下 (分别以麦芽糖和木糖为碳源) 的蛋白质组的比较研究,但是相关工作直到2010年才发表[10]。研究表明在诱导和非诱导条件下胞浆蛋白质组并没有明显的差异,主要差异体现在胞外分泌蛋白,特别是植物细胞壁降解蛋白。最近 Jørgensen等作了类似条件下的转录组比较,但是实验是在控制更精确的恒化培养条件下完成的。他们发现在此条件下以麦芽糖为唯一碳源时胞外蛋白量是以木糖为唯一碳源的3倍以上,90种以上与蛋白质分泌途径有关的蛋白发生了上调表达,包括蛋白质 ER转位、折叠、糖基化、质量控制、小体装配和运输等,与未折叠蛋白响应UPR的情况非常类似[11]。荷兰帝斯曼公司比较研究了3种胞外酶生产菌株及其野生型菌株在蛋白质生产条件下转录组和蛋白质组方面的差异[12]。他们发现随着产量和产物性质的不同,细胞的响应存在显著差异,如碳氮代谢、氧化压力蛋白、蛋白质折叠和内质网结合的蛋白质降解系统 (ERAD) 等。通过在β-葡萄糖苷酸酶 (GUS) 高产菌株中过量表达 ERAD因子doaA和寡糖转移酶sttC,GUS的产量确实得到了少量提升。Oliveira等最近通过LC-MS/MS研究了胞外分泌小体 microsome中蛋白质的分布情况,也发现在小体中存在ERAD组分Cdc48,并且首次发现小体中含有14种蛋白体20S亚基组分[13]。
3 构建黑曲霉细胞工厂的实验技术储备
遗传操作系统是基因功能分析和细胞工厂改造的必需工具。随着黑曲霉基因组序列的公布,其遗传操作系统的研究进展十分迅速。
基因敲除是遗传操作中的难点和关键,是基因功能研究和细胞工厂设计中的常用手段。虽然基因敲除目前在细菌、酵母及哺乳动物中已有广泛应用,但对于丝状真菌还存在一些技术问题阻碍其应用。主要包括:克隆和筛选步骤繁琐,获得所需打靶载体费时费力;丝状真菌基因敲除通常需要较长的同源序列;一般在丝状真菌中发生同源重组的频率低,打靶效率低。同源重组的频率主要受打靶载体同源序列的长度、载体构型、打靶位点和菌株等因素的影响。针对上述问题,近年来研究者提出了许多有效的改进措施,在黑曲霉中已经建立了高效打靶系统,这使得黑曲霉的遗传操作变得简便、迅速和高效,为黑曲霉的深入研究和应用铺平了道路。
3.1 基因打靶系统
在进行目的基因敲除过程中,载体构建非常重要。载体一般要包括 2个分别与目标基因两侧同源的臂序列和 1个筛选标记基因。在丝状真菌中进行基因替换通常需要500 bp或更长的同源臂序列[14]。融合PCR法是一种新的用于丝状真菌打靶载体快速构建的方法,通过三轮 PCR可直接获得三片段的融合产物。首先利用融合 PCR实现目标基因替换的是构巢曲霉Aspergillus nidulans (Eidam) Winter、烟曲霉 A. fumigatus Fres.及禾谷镰刀菌 Fusarium graminearum Schw.等。
利用在大肠杆菌中表达的 Lambda噬菌体的Red系统 (gam,bet,exo) 构建置换型打靶载体是一种获得大片段同源臂的有效方法,该方法已成功地用于构巢曲霉基因的敲除[15]。步骤包括:从基因组文库中得到含有曲霉目标基因及其邻近基因的cosmid;扩增带有大肠杆菌/真菌双重筛选标记的PCR片段,两端各有50 bp左右与目标基因同源的序列;在大肠杆菌中借助Lambda噬菌体的Red系统用筛选标记替换cosmid上的待敲除基因,从而获得带有大片段同源序列 (目标基因的邻近基因) 的重组cosmid;将此重组载体导入构巢曲霉中,由于其同源臂很长所以大大提高了同源重组的效率。
转座子队列敲除 (Transposon-arrayed gene knockout,TAGKO) 可以用于多个目标基因替换载体的构建。该方法首先构建真菌cosmid基因组文库,筛选含有目标基因的cosmid。通过转座酶的酶促反应,携带筛选标记的转座子Tn7随机整合入cosmid,破坏其中的基因。带有被转座子破坏的基因的cosmid可直接作为目标载体通过原生质体或孢子电击转化,对染色体上的基因进行置换。TAGKO可以诱导高频率目标基因替换的原因可能是该方法构建的打靶载体通常含有较长的同源序列 (约40 kb)。该方法亦是发现新基因及对基因功能进行分析的有效方法。
在真核生物细胞内存在两种 DNA双链断裂修复机制:一种是同源重组 (Homologous recombination,HR),一种是非同源末端结合 (Non-homologous End Joining,NHEJ)。基因敲除主要是利用了同源重组 (HR) 的原理。非同源末端连接 (NHEJ) 是真核生物细胞在不依赖DNA同源性的情况下,为了避免因DNA或染色体断裂造成的DNA降解或对生命力的影响,强行将2个DNA断端彼此连接在一起的一种特殊的修复机制。这一途径的存在使得打靶载体被随机整合到染色体上,从而大大降低了同源重组子的获得频率。在哺乳动物中 NHEJ途径占据主导地位,而在酵母细胞中则主要由 HR途径修复。现已确定在丝状真菌中NHEJ占主导地位,这也是为什么在黑曲霉等丝状真菌中难以实现定向遗传操作的原因。Ku70和Ku80是NHEJ途径中的核心因子,如果将其敲除则 NHEJ途径被破坏,那么此时 HR途径将占据主导地位,从而大大提高同源重组的效率。自从2004年Ninomiya等[16]成功地将粗糙链孢霉中的Ku70和Ku80敲除而实现了同源重组效率的大幅提升后,这项方法很快被应用到构巢曲霉[17]、黑曲霉[7]、米曲霉[18-19]、酱油曲霉[18-19]中。黑曲霉敲除Ku70及 (或) Ku80后可以实现近乎100%的同源重组率,而野生型仅为10%~30%。
Khang等开发了针对丝状真菌的正反双重筛选体系[20],正选择标记可以筛选出发生重组的转化子,反选择标记排除发生非同源重组的转化子,其应用大大提高了同源重组突变体筛选的效率。这种方法中用到的反选择标记是疱疹单纯病毒胸苷激酶(Herpes simplexvirus thymidine kinase,HSVtk),可以将核苷类似物 5-fluoro-2-deoxyuridine (F2dU) 转化为一种真菌毒性化合物。将HSVtk 基因置于载体目标基因同源区的外侧,异位插入的转化子因无法发生第2次同源重组因而携带该基因,在F2dU 存在的情况下无法存活;而同源突变体因发生第 2次同源重组而去除了HSVtk 基因,可以在F2dU筛选平板上形成菌落。通过上述双重筛选体系获得的转化子理论上就是目标突变体。
在构建黑曲霉细胞工厂时,因为要敲除/改变多个位点,筛选标记不能留在染色体上,因此实现无痕敲除非常重要。我们参照在细菌中广泛应用的基于反向筛选的敲除策略,提出了在黑曲霉中实现无痕敲除的策略 (图 4)。将要敲除的目标基因的左右臂连接,正向与反向筛选标记串联置于其一侧。第1次重组的过程中利用正向筛选标记进行筛选 (图4A),第2次重组则利用反向筛选标记筛选。第2次重组后会出现两种情况:一种为重组出现在预定位置,基因敲除成功 (图4B)。第二种情况为二次交换仍在第一次交换时的位置进行,则二次重组恢复成野生型 (图4C)。而异位插入的情况则较好排除,因为在致死基因存在下添加相应底物会使异位插入转化子致死。
3.2 黑曲霉表达系统优化
黑曲霉具有较高的蛋白质分泌能力、与高等真核生物类似的翻译后加工能力、成熟的发酵工艺和生物安全性等优点,因而成为新一代微生物高效表达分泌系统的研究热点。对黑曲霉表达系统优化改良的工作包括选用强启动子、增加基因拷贝数、构建蛋白酶缺陷突变株、进行基因融合等。
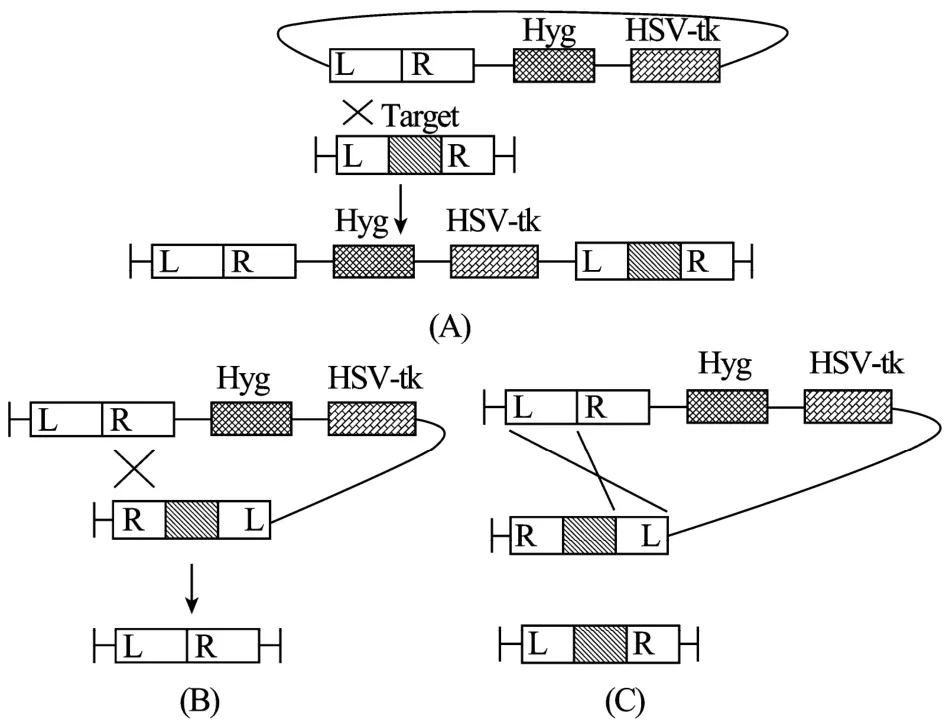
图4 一种黑曲霉无痕敲除策略原理Fig. 4 A proposed strategy for scarless gene knockout in Aspergillus niger.
3.2.1 强启动子
利用强启动子增加外源基因在黑曲霉中的表达是一种最为常见的分子操作手段。在黑曲霉中获得应用的强启动子一般来自于丝状真菌高效表达的基因,常用的比如构巢曲霉和黑曲霉自身的编码甘油醛-3-磷酸脱氢酶基因 (Glyceraldehydes-3-phosphate dehydrogenase,gpdA) 的启动子[21-22]、黑曲霉糖酵解途径组成型丙酮酸激酶基因 (Constitutive glycolytic pyruvate kinase,pkiA) 的强启动子[23-24]等。将目标基因与强启动子偶联,转化黑曲霉从而实现目标基因的高效表达。Liu等[25]将黑曲霉糖化酶基因上游激活蛋白结合位点以多重拷贝的形式插入一个表达型质粒的启动子区,改造后的启动子大大提高了外源基因的表达水平。
3.2.2 增加基因拷贝数
增加外源基因在丝状真菌中的拷贝数,能显著增加重组蛋白的表达产量。江南大学王正祥研究组发现,在黑曲霉染色体整合2~3倍糖化酶基因时,糖化酶的合成量比野生型提高了17.5%[26]。
3.2.3 利用蛋白酶缺陷菌株
黑曲霉自身能产生一些胞内或胞外蛋白酶,能导致过量表达的目标蛋白的降解。为了克服这一困难,往往采用遗传诱变或插入失活的方法得到一些蛋白酶缺陷的黑曲霉。刘丽等[27]通过紫外诱变得到一株胞外酸性蛋白酶活力仅为原株 0.76%的菌株。其生长特性和产糖化酶活力与原株基本一致,但报告基因VHb的分泌表达水平却远高于原始菌株,由此证明酸性蛋白酶缺陷对保护外源蛋白产生了显著效果。
3.2.4 基因融合
为了提高目标基因的分泌表达率,防止表达蛋白被降解,在黑曲霉中也常采用基因融合的方法,即把一个在黑曲霉中能高效表达的基因截短然后与目标基因首尾相连构建表达载体,在黑曲霉中进行表达。融合蛋白可以增加表达蛋白的可溶性,有利于蛋白的纯化。Karnaukhova等[28]将人类的 α蛋白酶抑制因子 (Alpha1-PI) 与黑曲霉中能够高效表达分泌的葡糖淀粉酶G2 (Glucoamylase G2) 相融合,从而将这种原本只能极微量获得的抑制因子产量大大提高,其分泌的有活性的融合蛋白达到12 mg/L。
3.3 筛选标记
遗传转化通常是小概率事件,从大量的未转化细胞(原生质体) 背景中筛选出正向转化子必须依赖于适当的遗传标记,遗传标记可以是原养型生长、药物或抗生素抗性、报告基因产生颜色等视觉特征等。
最初筛选丝状真菌转化子多是利用营养缺陷型菌株,通过将目标基因与营养缺陷的野生型等位基因连锁转移到相应的营养缺陷型菌株中,在基本培养基中筛选原养型生长菌落而得到转化子。目前,主要用于黑曲霉转化的营养缺陷型标记基因有 pyr (嘧啶)、trp (色氨酸)、niaD (硝酸还原酶) 等。但是生产菌株往往不具有营养缺陷标记,所以一般不能用这种方法实现目标基因的遗传转化。
在黑曲霉中广为使用的抗性基因包括潮霉素磷酸转移酶 (hph) 基因 (对潮霉素具有抗性)[29-31]、邻氨基苯甲酸合成酶基因的显性突变基因 (trp3iar) (对5-氟吲哚具有抗性)[32]。
报告基因编码一类特殊的蛋白质或者酶,其特点是易于定性甚至定量检测。用于黑曲霉转化的报告基因主要有 E.coli β-半乳糖苷酶基因 (lacZ)[33]、E. coli β-葡糖苷酶基因 (gus)[12]。这些报告基因编码的酶可以催化指示化合物发生显色反应,不仅能够直观地指示正向转化子,而且可以据此对基因的表达水平进行定量,用于测量启动子启动效率或者测量转录调控关系。
3.4 转化方法
外源 DNA 导入黑曲霉中最普遍使用的方案是CaCl2/PEG介导的原生质体转化法。首先是用溶壁酶处理菌丝体或萌发的孢子获得原生质体,将原生质体、外源载体DNA混合于一定浓度的CaCl2、PEG (聚乙二醇) 缓冲液中进行融合转化。然后将原生质体涂布于再生培养基中培养筛选转化子。1994年日本的 Ozeki等在黑曲霉中建立了孢子电转化法[34]。电转化孢子的方法较原生质体法简单、高效,在多种丝状真菌已有应用实例,是粗糙链孢霉遗传转化的主要方法之一。孢子电转化的过程主要包括:收集培养至少8 d的孢子;将孢子用冷冻山梨醇反复冲洗3次并悬浮;冰上将DNA与细胞轻柔混匀并电转化;之后加入山梨醇混匀涂平板。
4 讨论与展望
黑曲霉可以作为通用细胞工厂的一个前提是其生物安全性。FDA已经认定黑曲霉的安全性属于GRAS (Generally regarded as safe,通常认为是安全的)。基因组数据和对黑曲霉遗传代谢、蛋白质分泌分子机制的理解进一步推动了将黑曲霉开发为细胞工厂的研究活动。黑曲霉蛋白质分泌途径的认识和改造研究非常活跃,包括荷兰帝斯曼及合作者、丹麦技术大学和德国不伦瑞克工业大学等多个有竞争力的团队,有希望在不久的将来,全面解析其高效蛋白质分泌的分子机理,将黑曲霉开发成为一个通用的工业酶和异源蛋白质表达的载体。在代谢工程改造方面,Jens Nielsen的团队在改造黑曲霉生产琥珀酸、苹果酸和柠檬酸方面作了一些工作[35-36]。
另外黑曲霉也可以被开发为次级代谢产物生产的细胞工厂。近年来不断发现黑曲霉可以产生多种次级代谢产物。经过鉴定的不同次级代谢物就有140多种,其诸多次级代谢物在食品、饲料及生物技术产业中都有很好的应用并且被认为是安全的。基因组数据也揭示了黑曲霉产生众多次级代谢产物的分子基础[3],包括数个次级代谢产物基因簇。黑曲霉基因组上有17个非核糖体肽合成酶 (NRPS) 和34个聚酮合成酶 (PKS)。但是近期关于曲霉次级代谢产物赭曲霉毒素A及烟曲霉毒素B2的毒性问题也提醒我们不能因为黑曲霉具有GRAS认证就忽视了对其安全性的关注。
构建黑曲霉细胞工程的工作还刚刚起步,距离应用还有相当大的距离。随着黑曲霉遗传操作工具的不断成熟,可以预见将有更多的团队加入到黑曲霉的改造活动中,黑曲霉作为细胞工厂生产工业酶、异源蛋白质、有机酸、次级代谢产物等将呈现日益美好的前景。
REFERENCES
[1] Read ND. Low-temperature scanning electron microscopy of fungi and fungus-plant interactions//Electron Microscopy of Plant Pathogens. Berlin: Springer-Verlag Press, 1991: 17−29.
[2] Baker SE. Aspergillus niger genomics: past, present and into the future. Med Mycol, 2006, 44(Suppl1): 17–21.
[3] Pel HJ, de Winde JH, Archer DB, et al. Genome sequencing and analysis of the versatile cell factory Aspergillus niger CBS 513.88. Nat Biotechnol, 2007, 25: 221–231.
[4] Sun JB, Lu X, Rinas U, et al. Metabolic peculiarities of Aspergillus niger disclosed by comparative metabolic genomics. Genome Biol, 2007, 8(9): R182.
[5] Andersen MR, Nielsen ML, Nielsen J. Metabolic model integration of the bibliome, genome, metabolome and reactome of Aspergillus niger. Mol Syst Biol, 2008, 4: 178.
[6] Semova N, Storms R, John T, et al. Generation, annotation, and analysis of an extensive Aspergillus niger EST collection. BMC Microbiol, 2006, 6: 7.
[7] Meyer V, Arentshorst M, El-Ghezal A, et al. Highly efficient gene targeting in the Aspergillus niger kusA mutant. J Biotechnol, 2007, 128(4): 770−775.
[8] Andersen MR, Vongsangnak W, Panagiotou G, et al. A trispecies Aspergillus microarray: comparative transcriptomics of three Aspergillus species. Proc Natl Acad Sci USA, 2008, 105(11): 4387−4392.
[9] Salazar M, Vongsangnak W, Panagiotou G, et al. Uncovering transcriptional regulation of glycerol metabolism in Aspergilli through genome-wide gene expression data analysis. Mol Genet Genomics, 2009, 282(6): 571−586.
[10] Lu X, Sun JB, Nimtz M, et al. The intra- and extracellular proteome of Aspergillus niger growing on defined medium with xylose or maltose as carbon substrate. Microb Cell Fact, 2010, 9: 23.
[11] Jørgensen TR, Goosen T, Hondel CA, et al. Transcriptomic comparison of Aspergillus niger growing on two different sugars reveals coordinated regulation of the secretory pathway. BMC Genomics, 2009, 10: 44.
[12] Jacobs DI, Olsthoorn MM, Maillet I, et al. Effective lead selection for improved protein production in Aspergillus niger based on integrated genomics. Fungal Genet Biol, 2009, 46(Suppl1): 141−152.
[13] Oliveira JM, van Passel MW, Schaap PJ, et al. Shotgun proteomics of Aspergillus niger microsomes upon D-xylose induction. Appl Environ Microbiol, 2010, 76(13): 4421−4429.
[14] Yu JH, Hamari Z, Han KH. Double-joint PCR: a PCR-based molecular tool for gene manipulations in filamentous fungi. Fungal Genet Biol, 2004, 41(11): 973−981.
[15] Chaveroche MK, Ghigo JM, Christophe d'Enfert. A rapid method for efficient gene replacement in the filamentous fungus Aspergillus nidulans. Nucleic Acids Res, 2000, 28(22): E97.
[16] Ninomiya Y, Suzuki K, Ishii C, et al. Highly efficient gene replacements in Neurospora strains deficient for nonhomologous end-joining. Proc Natl Acad Sci USA, 2004, 101(33): 12248–12253.
[17] Nayak T, Szewczyk E, Oakley CE, et al. A versatile and efficient gene-targeting system for Aspergillus nidulans. Genetics, 2006, 172(3): 1557−1566.
[18] Takahashi T, Masuda T, Koyama Y. Enhanced gene targeting frequency in ku70 and ku80 disruption mutants of Aspergillus sojae and Aspergillus oryzae. Mol Genet Genomics, 2006, 275(5): 460−470.
[19] Takahashi T, Masuda T, Koyama Y. Identification and analysis of Ku70 and Ku80 homologs in the koji molds Aspergillus sojae and Aspergillus oryzae. Biosci Biotechnol Biochem, 2006, 70(1): 135−143.
[20] Khang CH, Park SY, Lee YH, et al. A dual selection based, targeted gene replacement tool for Magnaporthe grisea and Fusarium oxysporum. Fungal Genet Biol, 2005, 42(6): 483−492.
[21] Hofmann G, Diano A, Nielsen J. Recombinant bacterial hemoglobin alters metabolism of Aspergillus niger. Metab Eng, 2009, 11(1): 8−12.
[22] Varadarajalu LP, Punekar NS. Cloning and use of sC as homologous marker for Aspergillus niger transformation. J Microbiol Methods, 2005, 61(2): 219−224.
[23] Roth AH, Dersch P. A novel expression system for intracellular production and purification of recombinant affinity-tagged proteins in Aspergillus niger. Appl Microbiol Biotechnol, 2010, 86(2): 659−670.
[24] de Graaff LH, van den Broeck HC, Visser J. Isolation and transformation of the pyruvate kinase gene of Aspergillus nidulans. Curr Genet, 1988, 13(4): 315−321.
[25] Liu L, Liu J, Qiu RX, et al. Improving heterologous gene expression in Aspergillus niger by introducing multiple copies of protein-binding sequence containing CCAAT to the promoter. Lett Appl Microbiol, 2003, 36(6): 358−361.
[26] Yao TT, Wang YM, Gu JL, et al. Overproduction of glucoamylase by recombinant Aspergillus niger harboring multiple copies of glaA. Chin J Biotech, 2006, 22(4): 567−571.姚婷婷, 王衍敏, 顾建龙, 等. 携多拷贝 glaA的重组黑曲霉过量合成糖化酶的研究. 生物工程学报, 2006, 22(4): 567−571.
[27] Liu L, Liu J, Qiu RX, et al. Construction of recipient strain of expression-secretion system in filamentous fungi. Chin J Biotech, 2002, 18(6): 667−670.刘丽, 刘谨, 仇润祥, 等. 丝状真菌表达分泌系统中受体菌的构建. 生物工程学报, 2002, 18(6): 667−670.
[28] Karnaukhova E, Ophir Y, Trinh L, et al. Expression of human alpha1-proteinase inhibitor in Aspergillus niger. Microb Cell Fact, 2007, 6: 34.
[29] Punt PJ, Oliver RP, Dingemanse MA, et al. Transformation of Aspergillus based on the hygromycin B resistance marker from Escherichia coli. Gene, 1987, 56(1): 117−124.
[30] Luo X. Cloning and characterization of three Aspergillus niger promoters. Gene, 1995, 163(1): 127−131.
[31] Hoffmann T, Golz C, Schieder O. Foreign DNA sequences are received by a wild-type strain of Aspergillus niger after co-culture with transgenic higher plants. Curr Genet, 1994, 27(1): 70−76.
[32] Adams RR, Royer T. Complete genomic sequence encoding trpC from Aspergillus niger var. awamori. Nucleic Acids Res, 1990, 18(16): 4931.
[33] Davis MA, Cobbett CS, Hynes MJ. An amdS-lacZ fusion for studying gene regulation in Aspergillus. Gene, 1988, 63(2): 199−212.
[34] Ozeki K, Kyoya F, Hizume K, et al. Transformation of intact Aspergillus niger by electroporation. Biosci Biotechnol Biochem, 1994; 58(12): 2224−2227.
[35] Meijer S, Otero J, Olivares R, et al. Overexpression of isocitrate lyase-glyoxylate bypass influence on metabolism in Aspergillus niger. Metab Eng, 2009, 11(2): 107−116.
[36] de Jongh WA, Nielsen J. Enhanced citrate production through gene insertion in Aspergillus niger. Metab Eng, 2008, 10(2): 87−96.
