细胞因子调节垂体M tT/S细胞中人生长激素基因启动子的活性
2010-02-06龚凤英邓洁英朱惠娟张殿喜
龚凤英 邓洁英 朱惠娟 潘 慧 张殿喜
(中国医学科学院北京协和医院内分泌科卫生部内分泌重点实验室,北京 100730)
细胞因子调节垂体M tT/S细胞中人生长激素基因启动子的活性
龚凤英 邓洁英 朱惠娟 潘 慧 张殿喜
(中国医学科学院北京协和医院内分泌科卫生部内分泌重点实验室,北京 100730)
目的:探讨细胞因子白介素-11(IL-11)、睫状神经营养因子(CNTF)和转化生长因子(TGF-β)对大鼠垂体MtT/S细胞中人生长激素(hGH)基因启动子活性的影响及其与垂体特异性转录因子Pit-1蛋白的关系。方法:采用荧光素酶报告基因的方法。首先建立含hGH基因启动子(-484~30 bp)和荧光素酶融合基因的稳定转化MtT/S细胞系,然后用细胞因子刺激,检测细胞培养液和细胞裂解液中GH的含量,反映它们对GH分泌和合成的影响;检测MtT/S细胞内荧光素酶的变化,说明细胞因子对hGH基因启动子活性的作用。将Pit-1蛋白表达质粒(pcDNA-pit-1-cDNA)单独转染或与Pit-1反义寡核苷酸(Pit-1OND)共转染于稳定转化的M tT/S细胞中,观察加入细胞因子后荧光素酶的变化,探讨细胞因子的作用与Pit-1蛋白的关系。结果:IL-11(20 nmol/L)、CNTF(10 nmol/L)能刺激大鼠垂体MtT/S细胞中GH的分泌和合成,增强MtT/S细胞中荧光素酶的表达,分别增加到对照组的134%、122%。TGF-β(5nmol/L)能减少GH的分泌和合成,抑制荧光素酶的表达到对照组的72%。Pit-1蛋白过表达和表达被抑制对细胞因子的调节作用没有影响。结论:IL-11、CNTF和TGF-β通过调节大鼠垂体MtT/S细胞中hGH基因启动子活性影响GH的合成,Pit-1蛋白可能不参与这一调节作用。
细胞因子;生长激素基因启动子;MtT/S细胞;Pit-1蛋白
近年来研究发现,垂体前叶细胞分泌的生长激素(Grow th hormone,GH)作为一种应激激素,在感染、炎症等应激过程中分泌增加,与下丘脑-垂体-肾上腺轴分泌的肾上腺皮质激素释放激素、肾上腺皮质激素等共同调节免疫功能,维持机体内环境的稳定。越来越多的研究表明,免疫细胞分泌的多种细胞因子如 IL-1、IL-2、IL-6、肿瘤坏死因子 α(TNF-α)、白细胞抑制因子(LIF)等均能调节垂体激素的分泌[1]。在原代培养的人和大鼠的正常或垂体瘤细胞以及M tT/S、A tT-20、TtT/GF 等垂体瘤细胞系中,IL-11、睫状神经营养因子(CNTF)能刺激GH、催乳素(PRL)和促肾上腺皮质激素(ACTH)的分泌[2,3],转化生长因子(TGF-β)能抑制GH、PRL的分泌[4]。我们最近的研究也发现,干扰素γ、IL-1和IL-6不仅能调节大鼠垂体GH3细胞中生长激素(GH)的分泌,还能调节GH的合成[5,6]。
Pit-1蛋白是垂体特异性转录因子,是POU蛋白家族(Pit-1、Oct-1和Unc86)成员之一,生长激素释放激素(Growth hormone releasing hormone,GHRH)通过激活细胞内cAMP-蛋白激酶A信号转导途径促进垂体特异性核转录因子Pit-1蛋白的表达,后者与GH基因启动子上-131~-106 bp、-93~-66 bp的两个Pit-1位点结合,促进生长激素基因的转录[7]。
本实验采用荧光素酶报告基因的方法,研究IL-11、CNTF和TGF-β对大鼠垂体MtT/S细胞中hGH基因启动子活性的影响,并探讨Pit-1蛋白在其中的作用,以期对GH基因表达调控的机制有进一步的认识。
1 材料与方法
1.1 质粒及质粒构建 pGL3-484-Luc2(简称484-Luc2)是含有荧光素酶编码基因和人生长激素(hGH)基因启动子-484~+30 bp序列的表达质粒,荧光素酶的表达受hGH基因启动子的控制,可通过测定荧光素酶的活性,反映某些因素对基因启动子活性的影响。pGL3-380-Luc2(380-Luc2),pGL3-250-Luc2(250-Luc2),pGL3-132-Luc2(132-Luc2)和pGL3-66-Luc2(66-Luc2)是分别含有hGH基因启动子从-380 bp,-250 bp,-132 bp,-66 bp至+30 bp序列的质粒,pGL3-484-Luc1(484-Luc1)质粒含hGH基因启动子-484~2 bp的序列。这些质粒的构建在我们以前的文献中有详细描述[5]。pcDNA3.1(+)为含新霉素抗性基因的质粒,pSV-β-Gal为内对照质粒,pGL3-Basic-Luc为无启动子、无增强子、含荧光素酶报告基因的空白质粒,均为Promega公司产品。
1.2 稳定转化MtT/S细胞系的建立 M tT/S细胞(美国ATCC公司)为大鼠垂体瘤细胞株,培养条件为完全DMEM(Dulbecco'smodified Eaglemedium,pH 7.3,美国Gibco BRL公司)培养液,3~4天换一次培养液。
采用脂质体转染法。将生长状态良好的MtT/S细胞以8×105个/孔接种于6孔培养板中,待细胞完全贴壁并生长至底面积的50%~60%时,换为OPTI-MEM减血清培养液(Gibco BRL公司),同时配制A、B两液:A液为250μl OPTI-MEM 培养液和3μl阳离子脂质体DMRIE-C转染试剂 (Gibco BRL公司);B液为250μlOPTI-MEM培养液和转染质粒[包括2.0μg荧光素酶表达质粒pGL3-480-Luc和0.4μg新霉素抗性基因表达质粒pcDNA3.1(+),比例为5∶1],小心混合A 、B两液,室温放置30分钟,加入上述M tT/S细胞中,37℃转染5小时,更换为完全DMEM培养液继续培养48小时。收集细胞,重新接种于60 mm培养皿中,并加入 300μg/L Geneticin G418(Gibco BRL公司),以筛选含新霉素抗性基因的单克隆。约2~3周后,获得数十个单克隆,重新接种,二次克隆筛选。最后获得8个稳定表达荧光素酶并带有新霉素抗性基因的M tT/S细胞克隆,称为稳定转化MtT/S细胞。选择其中的4个MtT/S细胞克隆用于本实验,并始终用含 300μg/L G418的DMEM培养。
1.3 细胞因子刺激实验 将生长良好的稳定转化M tT/S细胞以3×105个/孔接种于24孔培养板中。24小时后,将细胞分为对照组和实验组,对照组不作任何处理,实验组分别加入一定浓度的IL-11、CNTF、TGF-β(美国 Calbiochem 公司),继续培养 4小时后,收集培养液,用于GH测定。裂解细胞,检测荧光素酶活性。
1.4 瞬时转染实验 将生长良好的稳定转化MtT/S细胞以5×105个/孔接种于12孔培养板中,经与前述相似的转染前处理后,将细胞分为对照组和实验组,对照组转染1.5μg pGL3-Basic-Luc空白质粒,实验组单独转染1.0μg pcDNA3.1-Pit-1-cDNA或与0.5μgPit-1OND共转染(用pGL3-Basic-Luc调节转染时质粒DNA的总量,保证每孔所转DAN总量相同)。转染5小时后,更换成无血清DMEM培养液,继续培养34小时,再次更换为无血清DMEM培养液,并加入细胞因子,作用4小时后,裂解细胞,检测荧光素酶活性。
1.5 荧光素酶活性的测定和大鼠GH(rGH)的测定
按照荧光素酶检测试剂盒(Promega公司)的操作说明,将细胞裂解,取20μl细胞裂解液至荧光测定管中,加入100μl荧光素酶反应底物,立即在化学发光仪上,检测发光值,检测时间为20秒。
按照大鼠GH酶免疫测定(EIA)试剂盒(英国Amersham公司)的操作说明,测定每一孔细胞培养液和裂解液的rGH浓度,每个标本重复测定2次,批内和批间差异分别为6.8%和10.2%。
2 结果
2.1 细胞因子对MtT/S细胞GH分泌和合成的影响 本实验中,浓度为20 nmol/L IL-11和10 nmol/L CNTF刺激稳定转化M tT/S细胞后,细胞培养液中的GH含量明显增加,分别为对照组的151%和148%(图1,P<0.001),同时MtT/S细胞裂解液中的GH含量也有轻度增加,分别增加到对照组的112%和115%。将细胞培养液和细胞裂解液中的GH含量相加(表示GH的合成),发现IL-11和CNTF均能增加GH合成到对照组的 146%和144%(图1,P<0.001)。与此相反,浓度为5 nmol/L的TGF-β却使MtT/S细胞培养液中的GH的含量显著减少,为对照组的65%(图1,P<0.001),同样细胞裂解液中的GH也轻度减少,减少到对照组的85%。将二者相加后,表明 TGF-β能把GH合成抑制到对照组的64%(图1,P<0.001)。
2.2 细胞因子对稳定转化M tT/S细胞中荧光素酶表达的影响 浓度为20 nmol/L的IL-11和10 nmol/L的CNTF可促进MtT/S细胞中荧光素酶的表达,分别为对照组的134%和122%(图2,P<0.001);浓度为5 nmol/L的TGF-β却抑制MtT/S细胞中荧光素酶的表达,抑制到对照组的72%(图2,P<0.001)。
2.3 细胞因子影响hGH基因启动子活性与Pit-1蛋白的关系 本实验中,将人Pit-1蛋白表达质粒pcDNA3.1-Pit-1-cDNA转染于稳定转化的MtT/S细胞后,观察到Pit-1蛋白的过表达,使M tT/S细胞中荧光素酶的表达增加24%和27%(图3,柱2与柱1,P<0.001;图4,柱2与柱1,P<0.01),而加入Pit-1反义寡核苷酸Pit-1OND将Pit-1蛋白的表达抑制后,Pit-1的促进作用则消失。进一步地,我们将Pit-1蛋白表达质粒转染于稳定转化的MtT/S细胞的同时加入IL-11或CNTF,细胞中荧光素酶的活性比单独加细胞因子时进一步增高,分别增加了37%和20%(图3,柱5与柱4,P<0.01),分别是无Pit-1蛋白过表达对照组的161%和144%(图3,柱5和柱1,P<0.001)。当加入Pit-1 OND将Pit-1蛋白的表达抑制后,IL-11和CNTF对hGH基因启动子活性的促进作用依然存在(图3,柱6与柱1,P<0.001)。
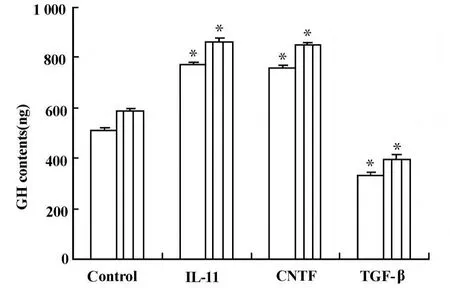
图1 细胞因子对M tT/S细胞中GH分泌和合成的影响Fig.1 The effect of cytokines on GH secretion and synthesisin stableM tT/S cells

图2 细胞因子对M tT/S细胞中荧光素酶表达的影响Fig.2 The effect of cytokines on the hGH gene promoter activities in stableM tT/S cells
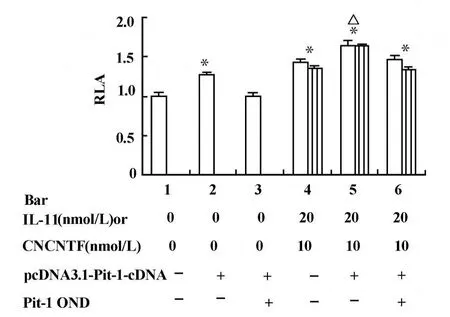
图3 IL-11和CNTF促进hGH基因启动子活性与Pit-1蛋白的关系Fig.3 The relationship between Pit-1 protein and the stimu latory effects of IL-11 and CNTF

图4 TGF-β抑制 hGH基因启动子活性与 Pit-1蛋白的关系Fig.4 The relationship between Pit-1 protein and the inhibitory effect of TGF-β
在稳定转化的MtT/S细胞中,转染Pit-1蛋白表达质粒并加入TGF-β后,细胞中荧光素酶的活性是对照组的102%(图4,柱5与柱1,P>0.05),当加入Pit-1OND抑制Pit-1蛋白的表达后,TGF-β的抑制作用重新又出现(图4,柱6与柱1,P<0.01)。
3 讨论
GH在应激调节过程中分泌增加的调节机制一直是目前该领域的研究热点。本研究成功地建立了带有新霉素抗性基因(用于细胞克隆筛选)和表达荧光素酶的稳定转染M tT/S细胞株。在这一稳定转染MtT/S细胞中,由于稳定整合有hGH基因启动子序列和荧光素酶的融合基因,所以荧光素酶的表达受hGH基因启动子的控制。也就是说任何因素对hGH基因启动子的影响可以通过检测细胞内荧光素酶的活性加以反应。本研究采用体外培养稳定转染MtT/S细胞的方法,在细胞和分子水平研究了免疫细胞分泌的细胞因子IL-11、CNTF和TGF-β对GH分泌、合成以及hGH基因启动子活性的影响。结果表明,IL-11和CNTF促进GH的分泌和合成,而TGF-β抑制GH的分泌和合成。Perez Catro等[2,3]和Auernhammer等[8]在原代培养的人和大鼠垂体细胞以及垂体瘤细胞系中,观察到IL-11和CNTF刺激GH、PRL和ACTH的分泌。用RT-PCR的方法还发现,IL-11和CNTF能促进ACTH mRNA和GH mRNA的表达。Tan等[9]采用同样的方法也发现,TGF-β不仅能抑制大鼠垂体细胞中PRL的基础分泌,还能抑制甲状腺激素释放激素(TRH)刺激的PRL分泌,抑制PRLmRNA的表达。这些研究均表明,免疫细胞分泌的 IL-11、CNTF和TGF-β是多效性的细胞因子,除了通过经典的免疫通路调节机体的免疫和炎症反应外,还能调节垂体分泌的应激激素GH等的分泌和合成,从另外一个途径调节机体的免疫功能。但这些细胞因子调节GH合成的机制如何,目前文献上还没有肯定的报道。本研究采用荧光素酶报告基因的方法,首次报道IL-11和CNTF通过促进hGH基因启动子的活性促进GH基因转录,从而促进GH的合成;而TGF-β则通过抑制hGH基因启动子的活性抑制GH基因转录,抑制GH的合成。
Pit-1蛋白是垂体特异性转录因子,在GHRH促进GH基因表达的过程中,通过与GH基因启动子上的两个Pit-1位点结合,增加GH基因的转录。本实验用Pit-1蛋白过表达和表达被抑制的方法研究也发现,Pit-1蛋白对hGH基因的基础转录具有重要的调节作用。为了进一步探讨Pit-1蛋白是否参与细胞因子对hGH基因转录的调节,本实验将Pit-1蛋白表达质粒单独转染或与Pit-1反义寡核苷酸共转染于稳定转染M tT/S细胞中,然后加入细胞因子,结果发现Pit-1蛋白可能不参与 IL-11和CNTF所诱导的、TGF-β所抑制的hGH基因转录。这与我们以前研究的细胞因子 IL-1α、IL-6、IFN-γ对GH3细胞中hGH基因表达影响的结果相似[5,6]。Delidow等[10]也报道,TGF-β抑制大鼠垂体细胞中PRL基因和GH基因的转录与垂体特异性的转录因子Pit-1蛋白无关。上述资料提示,细胞因子对大鼠垂体MtT/S细胞中GH基因的转录调控机制可能与GHRH调节GH基因表达的机制不同。
M tT/S细胞系是1990年由日本学者Inoue等[11]从大鼠垂体瘤组织建立的。研究发现,MtT/S细胞具有正常GH分泌细胞的超微结构,包括发育良好的粗面内质网、高尔基复合体和丰富的GH免疫反应阳性的分泌颗粒[11]。该细胞能够表达包括GH、糖皮质激素,盐皮质激素和甲状腺激素在内的多种激素的受体。进一步研究发现,GHRH能够剂量依赖性地促进M tT/S细胞中生长激素的分泌[12]。Iwasaki等[13]采用体外培养M tT/S细胞的方法发现,甲状腺激素和雌激素能够直接刺激MtT/S细胞中GH基因启动子的活性,而盐皮质激素则抑制基础GH的表达。我们前期的研究也发现,IL-1β和IL-6不仅能促进大鼠垂体MtT/S细胞中生长激素(GH)的分泌,还能调节促进GH的合成[14,15]。由于MtT/S细胞具有多种GH分泌细胞的特点,而且能表达IL-6、LIF、胰岛素样生长因子-1(IGF-1)等受体,并对多种激素和细胞因子具有良好的反应性,所以,近年来,MtT/S细胞像GH3细胞一样被广泛用来研究GH激素基因转录调控的分子和细胞机制。对比本实验和我们以前的研究结果,发现MtT/S细胞和GH3细胞对同一细胞因子具有一致的反应性[5,6,14,15]。
荧光素酶报告基因方法用于基因转录调控的研究,具有简便易行、定量测定、重复性较好的特点。细胞内荧光素酶的表达受其上游启动子活性的影响,可通过检测荧光素酶的活性,反映某些因素对基因启动子活性的影响。有瞬时转染和稳定转染两种方法。瞬时转染荧光素酶报告基因的方法是用转染试剂将荧光素酶表达质粒暂时导入到培养细胞核内,其独立于细胞基因组染色体外,不随DNA复制而复制,随着细胞增生传代,表达荧光素酶的细胞逐渐减少,所以这一方法不能用于连续长期实验,而且实验的重复性和准确性也因必须重新转染而受到限制。稳定转染荧光素酶报告基因方法,利用DNA复制时同源重组的原理,将荧光素酶表达质粒稳定整合于细胞基因组的细胞克隆筛选出来,并建立成稳定转化的细胞系。该质粒DNA随细胞基因组DNA复制而复制,可以代代相传并稳定表达荧光素酶,这样就大大简化了实验操作,而且重复性和准确性均较好。在本实验和以前的转染实验中,我们也观察到了瞬时转染的局限性和稳定转染的优越性。Hexdall等和Blanton等[16,17]在Hela细胞和猪肌细胞中对两种转染方法进行比较后,也得出了相似的结论。本研究成功地建立了带有新霉素抗性基因(用于细胞克隆筛选)并表达荧光素酶的稳定转化M tT/S细胞系,为今后GH激素基因转录调控机制的研究提供了良好的实验工具。
综上所述,本研究表明,细胞因子 IL-11、CNTF和TGF-β通过调节大鼠垂体M tT/S细胞中hGH基因启动子活性影响GH的合成,IL-11和CNTF起促进作用,TGF-β则起抑制作用。垂体特异性转录因子Pit-1蛋白可能不参与这一调节过程。
1 Nagai Y,OgasawaraH,Taketa Yetal.Expression of inflammatory-related factors in porcine anterior pituitary-derived cell line[J].Vet Immunol Immunopathol,2008;124(3-4):201-208.
2 PerezCastro C,CarbiaNagashima A,Paez Pereda Metal.Effects of the gp130 cytokines ciliary neurotropic factor(CNTF)and interleukin-11 on pituitary cells:CNTF receptorson human pituitary adenomasand stimulation ofprolactin andGH secretion in normal ratanteriorpituitary aggregate cultures[J].JEndocrinol,2001;169(3):539-547.
3 Perez Castro C,Nagashima A C,Pereda M Petal.The gp130 cytokines interleukin-11 and ciliary neurotropic factor regulate through specific receptors the function and growth of lactosomatotropic and folliculostellate pituitary cell lines[J].Endocrinology,2000;141(5):1746-1753.
4 Coya R,Alvarez CV,Perez Fetal.Effectsof TGF-β1 on prolactin synthesisand secretion:An in-vitro study[J].JNeuroendocrinol,1999;11(5):351-360.
5 Gong F Y,Deng JY,Shi Y F.The regulatorymechanism by which interleukin-6 stimulatesGH-geneexpression in ratGH3cells[J].JEndocrinol,2006;190:397-406.
6 Gong F Y,Deng JY,Shi Y F.Stimulatory effect of interleukin-1beta on growth hormonegene expression and growth hormone release from ratGH3cells[J].Neuroendocrinology,2005;81:217-228.
7 McElvaineA T,KorytkoA I,KilenSMetal.Pituitary-specificexpression and Pit-1 regulation of the rat growth hormone-releasing hormone receptor gene[J].MolEndocrinol,2007;21:1969-1983.
8 AuernhammerC J,Melmed S.Interleukin-11 stimulates proopiomelanocortin gene expression and adrenocorticotropin secretion in corticotroph cells:Evidence for a redundantcytokine network in thehypothalamo-pituitary-adrenal axis[J].Endocrinology,1999;140(4):1559-1566.
9 Tan SK,Wang F F,Pu H Fetal.Differential effect of age on transforming growth factor-β1 inhibition of prolactin gene expression versus secretion in rat anterior pituitary cells[J].Endocrinology,1997;138(3):878-885.
10 Delidow B C,BillisW M,Agarwal Petal.Inhibition of prolactin gene transcription by transforming growth factor-βin GH3cells[J].Mol Endocrinol,1991;5(11):1716-1722.
11 InoueK,HattoriM,Sakai Tetal.Establishment of a series of pituitary clonal cell lines differing inmorphology,hormone secretion,and response to estrogen[J].Endocrinology,1990;126:2313-2320.
12 Nogam iH,Hiraoka Y,Inoue Ketal.Regulation of 5'-promoter activity of the rat growth hormone and growth hormone-releasing hormone receptor genes in theM tT/Sand MtT/E cells[J].Neuroendocrinology,2006;84(1):31-41.
13 IwasakiY,Morishita M,AsaiMetal.Effects of hormones targeting nuclear receptorson transcriptional regulation of the growth hormone gene in the MtT/S rat somatotrope cell line[J].Neuroendocrinology,2004;79:229-236.
14 Gong FY,Deng JY,ShiY F.Mek and p38MAPK-dependantpathways are involoved in the positiveeffectof interleukin-6 on human growth hormonegene expression in rat MtT/S somatotroph cells[J].Chin Med Sci J,2008;23(2):73-80.
15 Gong F Y,Deng JY,Shi Y F.Effect of interleukin-1βon growth hormonegeneexpression and its possiblemolecularmechanism in ratMtT/S somatotroph cells[J].ChinMed Sci J,2008;23(4):375-382.
16 Hexdall L,Zheng C F.Stable luciferase reporter cell lines for signal transduction pathway readout using GAL4 fusion transactivators[J].Biotechniques,2001;30(5):1134-1138.
17 Blanton JR Jr,BidwellCA,Sanders DAetal.Plasmid transfection and retroviral transduction of porcine muscle cells for cell-mediated gene transfer[J].JAnim Sci,2000;78(4):909-918.
[收稿2009-11-02 修回2009-12-07]
(编辑 许四平)
Cytokines regulate the promoter activitiesof human grow th hormonegene in rat pituitary M tT/S cells
GONGFeng-Ying,DENGJie-Ying,ZHUHui-Juan,PANHui,ZHANGDian-Xi.DepartmentofEndocrinology,KeyLaboratoryofEndocrinologyofMinistryofHealth,PekingUnionMedicalCollegeHospital,ChineseAcademyofMedicalSciences&PekingUnionMedicalCollege,Beijing100730,China
Objective:To study the effectof interleukin-11(IL-11),ciliary neurotropic factor(CNTF)and transform ing grow th factor-β(TGF-β)on the hGH gene promoter activity in ratpituitaryM tT/S cells and the interaction with pituitary-specific transcription factor Pit-1.Methods:Stab le transformedMtT/S cell linewhich containshGH gene promoter-484-30 bp and luciferase reportergene firstly established,then the concentration of GH in themedium and lysate ofMtT/S cells and luciferase activities in M tT/S cellsweremeasured after treatment these cellsw ith the above cytokines,the effects of cytokines on secretion and synthesis of GH,and the promoter activity of the hGH gene were observed.Results:The Results showed that IL-11(20 nmol/L),CNTF(10 nmol/L)and TGF-β(5 nmol/L)regu lated secretion and synthesis of GH,and the luciferase expression in stable transformed MtT/S cells.IL-11 and CNTF had the stimulatory effect,whereas TGF-βhad the inhibitory effect.Neitheroverexpression of Pit-1 nor inhibiting Pit-1 exp ression affected the regulatory roleof these cytokines.Conclusion:IL-11,CNTF and TGF-βregulate theGH p roduction in pituitaryMtT/S cell line by regulating the hGH gene promoter activity.Pit-1 may notbe involved in these actions.
Cytokine;hGH gene promoter;MtT/S cells;Pit-1 protein
R335.+1
A
1000-484X(2010)02-0146-05
龚凤英(1967年-),女,副研究员,硕士生导师,主要从事神经-内分泌-免疫网络的研究,E-mail:fygong5074@yahoo.com.cn;
及指导教师:邓洁英(1939年-),女,研究员,博士生导师,主要从事神经-内分泌-免疫网络的研究。
·临床免疫学·
